结直肠癌错配修复蛋白与临床病理特征的关系
崔珂珂
(襄城县人民医院病理科,河南 许昌 461700)
结直肠癌(Colorectal cancer,CRC)多发于40岁以上中老年人群,其病理类型以腺癌最为常见,发病原因多与家族遗传、消化道疾病、长期低纤维饮食等有关。现如今,我国CRC发病率呈逐年上升趋势,对人类生命安全造成了极大威胁。据报道,早期CRC患者在经过手术、放化疗等综合治疗后,其5年生存率可达到90%,但仅有39%的患者可在早期确诊[1]。
相关研究指出,CRC发生的分子途径包括微卫星不稳定性、染色体不稳定性和CpG岛甲基化3种,其中微卫星不稳定主要由错配修复(Mismatch Repair,MMR)蛋白失活、造成基因突变产生。MMR系统能够精准识别DNA复制过程中出现的碱基错配,维持人类基因库完整与稳定。MMR功能缺陷,将导致细胞自发突变率增加,加速CRC发生、发展过程[5]。
因此,分析MMR蛋白在CRC患者中的表达情况,探讨MMR蛋白与病理特征的关系,对临床评估CRC患者病情进展,制定针对性诊疗措施具有至关重要的意义。因此,本研究欲通过检测CRC患者MutL同源物1(MutL homolog 1,MLH1)、减数分裂后分离蛋白2(Post-meiotic segregation 2,PMS2)、MutL同源物2(MutS protein homolog 2,MSH2)、MutL同源物6(MutS homolog 6,MSH6)4种MMR蛋白缺失情况,探讨其与临床病理特征的关系,从而为提高临床CRC的诊断效率提供一定指导。
1 资料与方法
1.1 一般资料
本研究经医院伦理委员会批准。选取2018年10月~2021年10月于本院接受根治术治疗的116例CRC患者作为研究对象。纳入标准:符合中CRC的诊断标准[3];术前未接受放化疗治疗;精神正常;患者家属签订知情同意书。排除标准:非原发性CRC者;复发性CRC者;合并林奇综合征者;存在家族性腺瘤性息肉病史者。所有患者中男74例,女42例;年龄46~75岁,平均62.74±5.66岁;肿瘤TNM分期[4]:Ⅰ期12例,Ⅱ期28例,Ⅲ期32例,Ⅳ期44例;分化程度:高分化48例,中分化36例,低分化32例。
1.2 方法
于CRC根治术中获取患者肿瘤组织和癌旁组织标本,检测MMR蛋白表达情况和CRC组织的临床病理特征后,分析MMR蛋白表达与临床病理特征的关系。
1.3 观察指标
1.3.1 MMR蛋白表达情况
选取肿瘤与正常组织同时存在的蜡块制成4 μm厚度切片,采用Evision法行免疫组化,一抗为MLH1、PMS2、MSH2、MSH6,抗体及免疫组化试剂均由上海科敏生物科技有限公司提供。检测结果判读:MMR蛋白在细胞核明确着色为阳性表达,不着色为缺失。 将4种蛋白全部阳性判断为错配修复修复完整(Proficient mismatch repair,pMMR),4种MMR蛋白中任意一种及1种以上蛋白表达阴性判定为错配修复缺陷(Deficient mismatch repair,dMMR)。
1.3.2 CRC临床病理特征
用4%甲醛溶液固定肿瘤组织标本,石蜡包埋,苏木精-伊红(Hematoxylin-eosin,HE)染色,光镜观察病理特征。磷酸缓冲液代替一抗作为阴性对照,阳性对照为已知阳性片;每例均有HE切片做对照观察。
1.3.3 MMR蛋白表达与CRC临床病理特征的相关性分析
应用χ2检验Phi和Cramer's ν系数分析MMR蛋白表达与临床病理特征的关系。
1.4 统计学方法
数据采用SPSS 25.0软件进行统计学分析。计量资料经Shapiro-Wilk正态性检验后以均数±标准差(±SD)表示,采用t检验;计数资料以例数(%)表示,采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 MMR蛋白表达情况
所有患者中,MMR蛋白表达阳性者94例(81.03%),MMR蛋白表达缺失者22例(18.97%);其中MLH1、PMS2、MSH2、MSH6蛋白表达缺失者分别为9例、11例、6例、6例,MLH1和PMS2蛋白共同缺失者4例,MSH2和MSH6蛋白共同缺失者6例,未见4种蛋白共同缺失患者。
2.2 MMR蛋白表达与CRC临床病理特征的关系
不同肿瘤部位、肿瘤TNM分期、分化程度、肿瘤直径患者的MMR蛋白表达缺失具有明显差异(P<0.05);不同CRC家族史、远处转移、淋巴结转移、组织学类型、肉眼分型患者的MMR蛋白表达缺失无明显差异(P>0.05)。见表1。
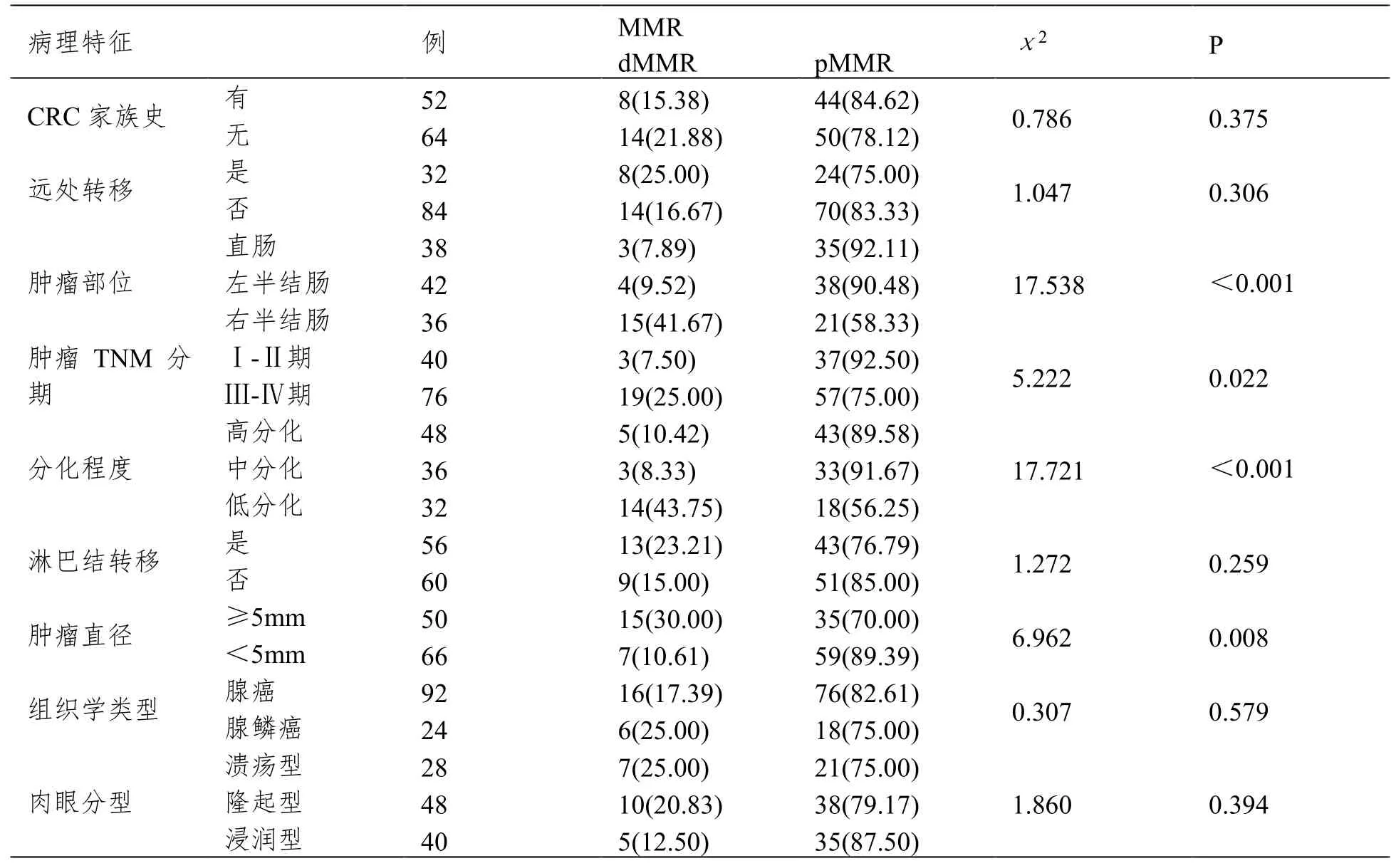
表1 MMR蛋白表达与CRC临床病理特征的关系 (例(%))
2.3 MMR蛋白表达与CRC临床病理特征的关系分析
经χ2检验Phi和Cramer's ν系数分析显示,MM蛋白表达与肿瘤部位、肿瘤TNM分期、分化程度、肿瘤直径呈正相关(P<0.05)。见表2。

表2 MMR蛋白表达与CRC临床病理特征的关系分析
3 讨论
MMR系统能够精准识别DNA复制过程中出现的碱基错配,维持人类基因库完整与稳定;MMR系统由一系列修复DNA碱基错配的酶分子组成,其中包括MLH1、PMS2、MSH2、MSH6,但MLH1、PMS2、MSH2、MSH6中任意一种蛋白缺失均会引起MMR功能缺陷,导致细胞自发突变率增加,加速CRC发生、发展过程[2]。因此,分析MMR蛋白在CRC患者中的表达情况,探讨MMR蛋白与病理特征的关系,对临床评估CRC患者病情进展具有至关重要的意义。
本研究发现,不同肿瘤部位、肿瘤TNM分期、分化程度、肿瘤直径患者MMR蛋白表达缺失比较,差异有统计学意义(P<0.05);且进一步经χ2检验Phi和Cramer's ν系数分析显示,CRC患者MM蛋白表达与肿瘤部位、肿瘤TNM分期、分化程度、肿瘤呈正相关。
其原因可能是:①肿瘤部位:MMR蛋白失活是引起微卫星不稳定的重要原因,而右半结肠CRC主要由微卫星路径引起肿瘤相关基因突变,左半结肠CRC则是通过染色体不稳定路径引起抑癌基因突变引起,因此肿瘤部位与MMR蛋白表达缺失有关[5]。晋龙[6]等研究结果指出,CRC患者MMR蛋白缺失与肿瘤部位相关,位于右半结肠的CRC患者MMR蛋白缺失率明显高于左半结肠患者。本研究结果与之相似。②肿瘤TNM分期:MMR蛋白表达缺失,可引起肿瘤细胞过度增长,肿瘤往往浸润程度深,淋巴结转移率及远端转移率高[7]。因此,CRC患者MMR蛋白表达与TNM分期密切相关。③分化程度:MMR蛋白缺失可引起MMR系统功能缺陷,诱发细胞基因突变,且MMR蛋白缺失越多,肿瘤恶性程度越高,分化越差[8]。李宇阳[9]等研究结果指出,肿瘤分化程度影响CRC中MLH1、PMS2、MSH2蛋白的表达,且分化程度低的肿瘤,MLH1、PMS2蛋白表达缺失更为常见。本研究与上述结论相一致。④肿瘤直径:MMR蛋白表达缺失可引起肿瘤细胞恶性增长,诱发肿瘤直径增大,侵犯其他脏器或穿破脏层腹膜,向远端转移,与宋蒨[10]等研究结论一致。
此外,本研究还存在以下几点局限:①本研究纳入CRC患者样本量偏小,可能会与其他研究存在一定偏差;②样本人群不同环境因素可对会对研究结果产生一定影响;③本研究以4种MMR蛋白中任意1种及1种以上蛋白阴性定义为dMMR,但并未对每种蛋白缺失情况与病理特征间的关系进行分析;④目前研究为观察性研究,只能证明CRC患者MMR蛋白表达与病理特征相关,但关于MMR蛋白缺失与肿瘤TNM分期、分化程度等特征之间的具体机制尚未明确。
综上所述,CRC患者MMR蛋白缺失与肿瘤部位、分化程度、肿瘤直径、肿瘤TNM分期呈正相关,检测MMR蛋白缺失情况能够为临床选择治疗方案提供方向。

