双氢青蒿素对大鼠肝纤维化损伤的缓解作用及对Nrf2/HO-1通路的影响*
史艳伟 米彩锋 牛丽林 李晶晶
1.平顶山市第一人民院消化内科 (河南 平顶山, 467000) 2.郑州大学
肝纤维化是肝脏对多种因素所致肝损伤的伤口愈合反应,肝脏中活化的成纤维细胞通过分泌细胞外基质蛋白,产生纤维性瘢痕,可发展为肝硬化,是肝硬化早期的可逆阶段,如果不及时预防和治疗,可能发展为肝癌和肝衰竭[1,2]。肝纤维化损伤是慢性肝病患者发病和死亡的主要原因,约占肝癌患者死亡率的50%[3,4]。因此,有效抑制肝纤维化发生、发展对肝病患者的临床治疗具有重要意义。青蒿素是从青蒿中分离的一种天然倍半萜烯内酯,具有抗疟、抗血管生成、抗癌和化疗增敏等药理作用[5]。双氢青蒿素(DHA)是青蒿素的主要活性代谢产物,在抗组织纤维化和抗神经元细胞死亡中发挥作用[6]。目前,DHA应用于肝纤维化的治疗研究较少,本研究拟通过建立肝纤维化大鼠模型,探讨DHA对大鼠肝纤维化损伤的缓解作用及对Nrf2/HO-1通路的影响,为DHA相关药物的研发和肝纤维化的临床治疗提供实验依据。
1 材料与方法
1.1 实验动物 SPF级SD大鼠55只,雌鼠27只,雄鼠28只,8周龄,体质量240~300 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。饲养环境:温度20~25℃,相对湿度55%~65%,亮暗循环时间比1∶1,自由饮食、饮水,适应性饲养1周。本研究经医院伦理委员会审核批准。
1.2 药品、主要试剂和仪器 DHA(HPLC≥98%)购自北京索莱宝科技有限公司;超氧化物歧化酶(SOD)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、丙二醛(MDA)检测试剂盒均购自南京建成科技有限公司;兔抗大鼠核因子E2相关因子2(Nrf2)抗体、血红素加氧酶-1(HO-1)抗体、β-actin抗体和辣根过氧化物酶(HRP)标记的山羊抗兔IgG均购自英国Abcam公司;全自动生化分析仪及配套试剂购自深圳迈瑞生物医疗电子股份有限公司;多功能酶标仪购自美国Molecular Device公司。
1.3 建立大鼠肝纤维化模型[7]45只大鼠实验前禁食0.5 d,腹腔注射40 mg/kg戊巴比妥钠麻醉,消毒后行上腹正中切口,抬高肝脏边缘,拨开十二指肠,分离胆总管约3 cm,穿刺可抽出胆汁证实,于近肝门和十二指肠处使用2号丝线各结扎2次,从中间剪断胆总管。术后正常饮水、进食,肌肉注射青霉素,1次/d,共3 d预防感染、鼠毛无光泽、皮肤黄染、体质量减轻等情况发生,当肝脏病理观察显示存在纤维化表现,提示造模成功。另外10只大鼠仅分离总胆管不进行结扎作为假手术组。
1.4 分组及药物干预 将造模成功的41只大鼠(有4只大鼠在造模过程中死亡)按随机数字表法分为模型组(11只)、DHA低剂量组(10只)、DHA中剂量组(10只)、DHA高剂量组(10只)。造模成功24 h后,DHA低、中、高剂量组大鼠分别给予5 mg/kg、15 mg/kg和25 mg/kg DHA(无菌生理盐水配制)灌胃,1次/d,连续14 d。假手术组、模型组大鼠灌胃等量无菌生理盐水。
1.5 大鼠肝功能检测 末次给药后24 h,取各组大鼠腹主动脉血,室温静置1 h,3 000 rpm(离心半径10 cm)离心10 min,取上清液采用全自动生化分析仪及配套试剂检测样品中谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBil)水平。
1.6 大鼠肝组织生化指标检测 采血完毕,颈椎脱臼法处死大鼠,无菌解剖取出肝脏,于4℃预冷的生理盐水中清洗后置于-80℃冰箱保存备用。取100 mg肝脏组织加900 μl预冷的生理盐水,使用匀浆器在冰上制作肝组织匀浆,4 000 rpm(离心半径10 cm)离心10 min,取上清液检测肝组织匀浆中SOD、GSH-Px和MDA水平。
1.7 HE染色观察大鼠肝组织病理学变化 取部分肝脏组织,4%多聚甲醛4℃固定24 h,PBS清洗3次,梯度乙醇脱水,石蜡包埋,组织切片(厚度约5 μm),二甲苯脱蜡,苏木素、伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察大鼠肝脏组织病理学变化。
1.8 Masson染色观察大鼠肝纤维化 石蜡切片用二甲苯脱蜡,Bouin液在37℃温箱中媒染2 h,蒸馏水冲洗至切片上黄色消失,天青石蓝染色液、Mayer染色液依次滴染,酸性乙醇分化,丽春红品红染色液滴染,蒸馏水漂洗后磷钼酸溶液处理10 min,苯胺蓝染色液染色5 min,弱酸溶液处理,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察拍照。
1.9 Western Blot检测肝组织Nrf2/HO-1通路蛋白表达水平 取100 mg冷冻肝脏组织,研磨后加RIPA裂解液提取总蛋白,BCA法测蛋白浓度,蛋白变性,10% SDS-PAGE电泳分离蛋白,目的蛋白转膜至PVDF膜,5%脱脂牛奶室温封闭1 h,分别加入Nrf-2(1∶500)、HO-1(1∶1 000),β-actin(1∶1 000)抗体,4℃孵育过夜,TBST洗膜10 min×3次,再加入HRP标记二抗(1∶2 000),室温孵育1 h,TBST洗膜10 min×3次,加入ECL化学发光液发光,暗室中曝光显影,实验重复3次,Image J软件分析蛋白条带灰度值,计算目的蛋白相对表达量,目的蛋白相对表达量=目的蛋白条带灰度值/内参β-actin蛋白条带灰度值。
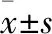
2 结果
2.1 各组大鼠肝功能指标检测结果 见表1。
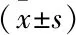
表1 各组大鼠肝功能结果比较
2.2 各组大鼠肝组织SOD、GSH-Px活性和MDA水平 见表2。
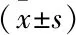
表2 各组大鼠肝组织SOD、GSH-Px活性和MDA水平比较
2.3 各组大鼠肝脏HE染色结果 HE染色结果显示,假手术组大鼠肝小叶结构完整,肝细胞排列有序,形态规则;模型组大鼠肝细胞坏死,发生脂肪变性,排列紊乱,肝细胞间隙有炎性浸润;DHA低、中、高剂量组大鼠较模型组肝组织损伤明显减轻,肝小叶结构均有不同程度恢复,较少肝细胞脂肪变性,炎性浸润不同程度减轻。见图1。

图1 肝脏组织HE染色图 (HE,×200)A:假手术组;B:模型组;C:DHA低剂量组;D:DHA中剂量组;E:DHA高剂量组
2.4 各组大鼠肝组织Nrf2/HO-1通路相关蛋白表达水平 见表3。

表3 各组大鼠肝组织Nrf2、HO-1蛋白表达水平比较
2.5 Masson染色观察结果 假手术组大鼠肝小叶结构完整,肝细胞索排列整齐,肝窦及汇管区可见胶原纤维,几乎无弥漫增生的胶原纤维;模型组大鼠汇管区周围胶原纤维明显增生并向四周延伸,延伸至邻近肝小叶形成纤维间隔,多数纤维间隔完全包裹肝细胞团形成假小叶结构;DHA低、中、高剂量组大鼠较模型组大鼠汇管区周围胶原纤维增生明显减轻,纤维间隔变小,假小叶结构不明显,其中DHA高剂量组大鼠肝脏几乎未见胶原纤维组织增生及假小叶结构。见图2。

图2 各组大鼠肝脏组织Masson染色图 (HE,×400)A:假手术组;B:模型组;C:DHA低剂量组;D:DHA中剂量组;E:DHA高剂量组
2.6 各组大鼠肝组织Nrf2/HO-1通路蛋白表达情况 见图3。

图3 各组大鼠肝组织Nrf2/HO-1通路相关蛋白表达图 A:假手术组;B:模型组;C:DHA低剂量组;D:DHA中剂量组;E:DHA高剂量组
3 讨论
慢性肝损伤的过度修复导致肝纤维化,其特征在于细胞外基质蛋白的过度积累,纤维化是一个动态过程,涉及实质细胞(肝细胞)、肝星状细胞、窦状内皮细胞和浸润免疫细胞等之间的相互串扰,晚期肝纤维化会导致肝硬化、门静脉高压和肝功能衰竭,是肝癌的主要危险因素[8]。抗肝纤维化的机制包括减轻肝脏炎症反应,抗脂质过氧化损伤,抑制肝星状细胞的激活和增殖,调节纤维化因子的合成和分泌以及调节细胞外基质的合成和降解[9]。抗肝纤维化治疗首先在于抑制肝纤维化发展,进而逆转肝纤维化,改善患者肝脏结构和功能,延缓肝硬化失代偿期发生,延长患者生存期等。目前,肝纤维化的临床治疗方法包括病因治疗(抗乙型肝炎病毒等)、抗炎治疗、免疫调节治疗、靶向治疗、干细胞移植及中药治疗等[10,11]。其中,中草药可有效抑制肝脏的病理性血管生成和肝纤维化发生,改善肝脏微循环,并降低肝硬化患者胃肠道出血等[12]。
青蒿素及其衍生物(如DHA)是我国传统的抗疟疾治疗剂,药理学研究表明,其具有抗寄生虫,抗菌,抗癌和抗纤维化的作用[13]。Huang等[14]研究显示,DHA通过抑制Nrf2介导的巨噬细胞核因子-κB活化,对脂多糖诱导的小鼠急性肺损伤发挥治疗作用。Zhang等[15]研究表明,DHA可诱导大鼠纤维化肝中活化的肝星状细胞发生衰老、自噬。Zhang B等[16]研究发现,DHA可以通过抑制磷脂酰肌醇3激酶/蛋白激酶B信号通路调节成纤维细胞的增殖与分化从而缓解小鼠肾纤维化。本研究建立大鼠肝纤维化模型,经DHA干预后检测肝纤维化损伤相关指标显示,低、中、高剂量DHA治疗后大鼠血清ALT、AST、TBil水平降低,肝组织SOD、GSH-Px活性升高,MDA水平降低,肝纤维化损伤程度明显减轻,提示DHA可减轻肝组织氧化应激损伤,改善肝纤维化大鼠肝功能,对大鼠肝纤维化损伤具有缓解作用。
Nrf2是一种广泛存在且进化上保守的细胞内氧化应激防御分子,正常状态下,Nrf2被细胞质的Kelch样环氧氯丙烷相关蛋白1(Keap1)隔离并在碱性条件下靶向蛋白酶体降解,在氧化应激的状态下,Nrf2从Keap1上解离并转移至细胞核,与Maf蛋白形成异源二聚体,识别抗氧化反应元件(Nrf2靶基因调节区域的增强子序列),调控抗氧化相关基因的表达,提高SOD、GSH-Px的活性,发挥抗氧化应激作用[17,18]。Li等[19]研究显示,miR155抑制剂可通过增强Nrf2/HO1信号通路预防线粒体损伤和心肌细胞凋亡,从而改善糖尿病性心肌纤维化。Huai等[20]研究表明,白术内酯Ⅲ通过激活Nrf2/NQO1/HO-1途径减轻博莱霉素诱导的大鼠实验性肺纤维化并其降低氧化应激水平。Khadrawy SM等[21]研究发现,间充质干细胞可通过激活Nrf2/HO-1信号通路改善大鼠肝纤维化、炎症并降低氧化应激水平。本研究结果显示,肝纤维化大鼠经低、中、高剂量DHA干预后,肝组织Nrf2、HO-1蛋白表达水平升高,提示DHA可以激活Nrf2/HO-1信号通路。
综上所述,DHA对大鼠肝纤维化损伤具有明显缓解作用,可激活Nrf2/HO-1信号通路。为DHA相关药物的研发及应用于肝纤维化的临床治疗提供理论支持。

