狄氏副拟杆菌胞外多糖粗提物的免疫调节活性*
祝阳露,张倩,李四菊,曹雪芹,叶思敏,谢智勇
中山大学药学院(深圳),广东 深圳 518107
微生物胞外多糖是指微生物在代谢生长过程中分泌到细胞外或与细胞疏松连接的长链高分子聚合物[1]。作为活性的生物大分子,微生物胞外多糖已经被报道具有多样的活性,包括抗肿瘤、抗氧化、免疫调节、降血糖[2-5]等。同时相较于植物以及动物多糖,由于培养周期短、培养条件易于控制、受地理和气候等因素的影响较少等优点,微生物胞外多糖引起了越来越多研究者的兴趣。
作为肠道共生菌,狄氏副拟杆菌Parabacteroides distasonis由于具有减轻肥胖、缓解结肠炎、结肠癌和多发性硬化[6-9]等多种生物活性近些年来受到了日益增加的关注。但目前已有的研究主要集中于对狄氏副拟杆菌整个菌体的研究,却未曾有关于狄氏副拟杆菌胞外多糖生理活性的研究。胞外多糖作为狄氏副拟杆菌物质基础之一,对胞外多糖研究的匮乏无疑会限制该菌未来的发展利用。因此本研究首次从狄氏副拟杆菌提取得到胞外多糖粗提物,并研究其免疫调节活性,为胞外多糖在免疫增强剂方面的开发利用提供了一定的参考意义,也为从胞外多糖角度探讨肠道菌群的有益功能提供了新的思路。
1 实验部分
1.1 仪器、试剂及材料
5910R 冷冻离心机,购自德国Eppendorf公司;LightCycler 96 实时荧光定量PCR 仪,购自瑞士Roche 公司;Epoch 酶标仪,购自美国BioTek 公司;UV-2600 紫外光谱仪、高效液相色谱仪(HPLC,LC-20AT),购自日本岛津公司;Spectra-Max i3x 荧光定量酶标仪,购自奥地利Molecular Devices公司。
Parabacteroides distasonis菌株,购自广东省微生物保藏中心,编号为ATCC8503;RAW 264.7细胞株,购自美国菌种保藏中心。
噻唑蓝(MTT)、脂多糖(LPS),购自Sigma-Aldrich公司;DMEM 培养基、胎牛血清、青霉素-链霉素,购自Gibco 生物科技公司;脑心浸出液培养基(BHI),购自广东环凯;木瓜蛋白酶,购自北京索莱宝;BCA 蛋白定量试剂盒,购自北京康为世纪;PCR 引物,由上海生工合成;NO 试剂盒,购自上海碧云天生物技术有限公司;活性氧试剂盒,购自武汉伊莱瑞特;单糖标准品(甘露糖Man、鼠李糖Rha、半乳糖Gal、葡萄糖醛酸GluA、半乳糖醛酸GalA、葡萄糖Glu、阿拉伯糖Ara、岩藻糖Fuc),购自上海吉至公司;其他试剂均为分析纯。
1.2 胞外多糖提取
将狄氏副拟杆菌甘油冻存管于37 ℃融化以后,用接种环蘸取少量菌液于固体平板划线并于37 ℃厌氧培养数日,待狄氏副拟杆菌复苏后,选取单克隆菌落接种于脑心浸出液液体培养基中于37 ℃厌氧培养48 h,并以3%的比例扩大培养2 代以后收集发酵液。将发酵液离心(4 000 r/min,4 ℃,30 min)后,取上清于100 ℃水浴加热10 min 以灭活其中的酶,然后将离心后的上清液减压浓缩至原体积的1/3 后,加4 倍体积的冰乙醇搅拌混合,并于4 ℃静置过夜,离心收集沉淀,即得胞外多糖粗提取物。将沉淀加少量去离子水溶解后加木瓜蛋白酶(终质量浓度为1 mg/mL)于65 ℃搅拌反应3 h后,100 ℃灭酶10 min以后,离心收集上清液,再用Sevag 试剂(V三氯甲烷∶V正丁醇=4∶1)反复多次除去蛋白,待中间白色蛋白层消失以后,收集上层液体经减压浓缩、透析、冷冻干燥得到除蛋白后的胞外多糖粗提取物。由于胞外多糖粗提取物中含有大量的色素可能会影响其纯度及生物活性,继而采用AB-8 大孔吸附树脂[10]对除蛋白后的胞外多糖粗提取物进行脱色,并将脱色后的胞外多糖粗提取物,命名为PEP。
1.3 总糖含量、蛋白质含量、紫外光谱测定
以葡萄糖为标准,用苯酚硫酸法[11]对PEP 的总糖含量进行测定。
以牛血清白蛋白为标准,按照BCA 试剂盒的操作对PEP的蛋白质含量进行测定。
用紫外分光光度计在200~400 nm 范围内对PEP 溶液(1 mg/mL)进行扫描,并绘制紫外光谱图。
1.4 单糖组成测定
采用1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化高效液相色谱法[12]对PEP 的单糖组成进行测定。
PEP 的水解:称取5 mg PEP 于反应管中,加入2 mL 的3 mol/L TFA 溶液于135 ℃油浴3 h 进 行水解。水解完成待冷却后,重复3 次加入5 mL甲醇洗涤溶液并减压浓缩至干,以除去残留的三氟乙酸。
PEP及单糖标准品的衍生化:将水解完全并减压蒸干的PEP 糖聚物用800 μL 去离子水溶解,取100 μL 溶 液,加 入0.5 mol/L 的PMP 甲 醇 溶 液 和0.3 mol/L 的NaOH 溶液各100 μL,并于70 ℃放置30 min,待恢复室温后加入105 μL 0.3 mol/L 的HCl溶液进行中和,并加入200 μL去离子水进行稀释,而后重复3次加入600 μL三氯甲烷进行萃取以除去溶液中残留的PMP,最后水层过0.22 μm滤膜过滤后于HPLC进行分析。各单糖标准品按照相同的方法进行衍生化最后进样HPLC进行分析。
HPLC 条件为,色谱柱:C18柱(4.6 mm×250 mm,5 μm,Waters 公司);流动相(体积比):0.05 mol/L 磷酸盐缓冲液(pH6.7)∶乙腈=83∶17;流速:1 mL/min;检测器:二极管阵列检测器;检测波长:250 nm;进样量:10 μL。
1.5 PEP的免疫调节活性
本实验以小鼠单核巨噬细胞RAW 264.7 为模型,对PEP的免疫调节活性进行研究。
1.5.1 细胞培养RAW 264.7 细胞用含有φ=10%胎牛血清和φ=1%的双抗(含10 000 U/mL 的青霉素和10 000 μg/mL的链霉素)的DMEM完全培养基在37 ℃培养箱(φ=5%CO2)培养,每隔2 d传代。
1.5.2 细胞活性测定取对数生长期的细胞,以1×106个/mL 的密度接种于96 孔板(100 μL/孔),过夜培养待细胞贴壁后,弃培养液,空白对照组加100 μL 完全培养基,阳性对照组加100 μL 1 μg/mL 的LPS 溶液,实验组加100 μL 质量浓度分别为50、100、200 μg/mL 的PEP 溶液,培养24 h 后,加入10 μL MTT 溶液(5 mg/mL)避光培养4 h 后,吸弃上清加入200 μL DMSO 溶液于摇床振摇10 min 后于490 nm 测定每孔吸光值。将空白对照组细胞的存活率视为100%。
1.5.3 NO和活性氧测定 按照1.5.2的接种和给药方式培养24 h 后,用NO 试剂盒测定细胞产生的NO 浓度同时细胞的活性氧产生参照活性氧试剂盒测定。
1.5.4 中性红吞噬实验按照1.5.2 的接种和给药方式培养24 h 后,弃培养液,加入0.075%的中性红溶液避光孵育45 min 后,弃上清,细胞用PBS溶液洗3次后,加入醇酸裂解液(V乙醇∶V冰醋酸=1∶1)后于培养箱避光放置2 h 后于540 nm 处测定每孔吸光度。
1.5.5 相关细胞因子表达水平测定细胞以5×105个/mL 接种于6 孔板(2 mL/孔),待细胞贴壁后,吸弃培养液,每孔分别加入2 mL 的DMEM完全培养基,LPS溶液(1 μg/mL)和各质量浓度梯度的PEP 溶液(50、100、200 μg/mL)培养24 h 后,参考伍芳芳[13]的方法提取细胞总RNA,通过逆转录试剂盒合成cDNA 并经过37 ℃15 min,50 ℃5 min,98 ℃5 min 反应后,利用荧光定量PCR 仪检测各细胞因子(引物序列见表1)mRNA的相对表达,反应体系为95 ℃预变性30 s;95 ℃5 s,60 ℃10 s,75 ℃20 s,重 复40 个循环;95 ℃1 min,40 ℃1 min,65 ℃1 s,95 ℃25 个采集点;40 ℃冷却30 s。以GAPDH 为内参基因,用2-△△Ct方法计算各细胞因子的相对表达量。

表1 PCR引物序列Table 1 PCR primer sequences
1.6 数据分析
实验重复3 次,实验中数据以均值±标准偏差的形式表示,采用IBM SPSS 20.0对数据进行单因素方差分析,P<0.05表示存在显著性差异。
2 结 果
2.1 PEP化学组成、紫外光谱分析
以葡萄糖的质量浓度(mg/mL)为横坐标(x),各质量浓度葡萄糖在490 nm 处的吸光值为纵坐标(y),拟合的回归方程为y= 4.166 3x+0.064 6,r2=0.996 6,表明具有良好的线性关系。将PEP 在490 nm 处的吸光值代入方程,由此计算出PEP 的总糖含量为(62.34±1.99)%。以牛血清白蛋白的浓度为横坐标(x),各浓度牛血清白蛋白在562 nm处的吸光值为纵坐标(y),拟合的回归方程为y= 0.842 4x+0.110 8,r2=0.997 3,表明具有良好的线性关系。将PEP 在562 nm 处的吸光值代入方程,由此计算出PEP 的蛋白质含量为(5.66 ±0.44)%。如图1a 所示,PEP 在260 和280 nm 均没有出现明显的吸收峰,说明PEP 不含或含有较少的核酸和蛋白质,该结果与蛋白质含量测定结果一致。
2.2 PEP的单糖组成分析
如图1b 所示,通过将PEP 的液相色谱图与混合单糖标准品衍生化后的液相色谱图进行对比,根据保留时间和峰面积计算可知,PEP主要由甘露糖、鼠李糖、葡萄糖、半乳糖及少量的岩藻糖组成,其组成比例为19.35∶8.70∶5.24∶8.17∶1.00,表明PEP是一个由5种单糖组成的杂多糖。

图1 PEP的紫外光谱图及单糖组成分析Fig.1 UV spectrum and monosaccharide composition analysis of PEP
2.3 PEP对RAW 264.7细胞增殖的影响
采用MTT 实验考察PEP 对巨噬细胞的毒性。如图2a 所示,在50~200 μg/mL 范围内,PEP 对细胞没有毒性,相反可以促进细胞的生长,表明该浓度范围可用于后续的实验。
2.4 PEP 对RAW 264.7 细胞释放NO、活性氧的影响
NO、活性氧是巨噬细胞在活化过程中产生的一些信号分子,在宿主防御病原体侵害等方面占据重要地位[14-15]。因此我们运用试剂盒检测了细胞释放NO、活性氧的情况。如图2b、2c 所示,与空白对照组比较,PEP可以呈浓度依赖地促进巨噬细胞分泌NO、活性氧,上述结果表明PEP 可以通过增加巨噬细胞释放NO、活性氧等信号分子行使其免疫调节功能。
2.5 PEP对RAW 264.7细胞吞噬活性的影响
吞噬活性提高是巨噬细胞被激活后的显著特征,巨噬细胞的吞噬作用可以帮助机体有效抵抗和清除病原体[16]。因此我们采用中性红实验测定了RAW 264.7 的吞噬功能。如图2d 所示,与空白对照组比较,PEP干预后,巨噬细胞的吞噬活性明显增加,并且呈现浓度依赖关系,表明PEP 可以增强巨噬细胞的吞噬功能。
2.6 PEP对RAW 264.7细胞中细胞因子的影响
3 个典型的细胞因子IL-1β、IL-6、TNF-α 在免疫调节中发挥重要作用,可以介导和调节免疫反应[17]。IL-1β和IL-6是免疫应答过渡阶段的重要信号分子,对维持免疫稳态至关重要[18]。同时作为一种多功能细胞因子,TNF-α可以参与对外来感染的防御和清除,促进受损组织的修复,对巨噬细胞的生长和功能起决定性作用[19]。因此,我们采用实时荧光定量PCR 检测了IL-1β、IL-6、TNF-α 3个细胞因子在基因水平的相对表达量。如图3a~c所示,与空白对照组比较,细胞中IL-1β、IL-6、TNF-α 表达量与PEP 的质量浓度呈正相关,表明PEP可以通过提高细胞因子基因的表达水平增强细胞的免疫调节能力。
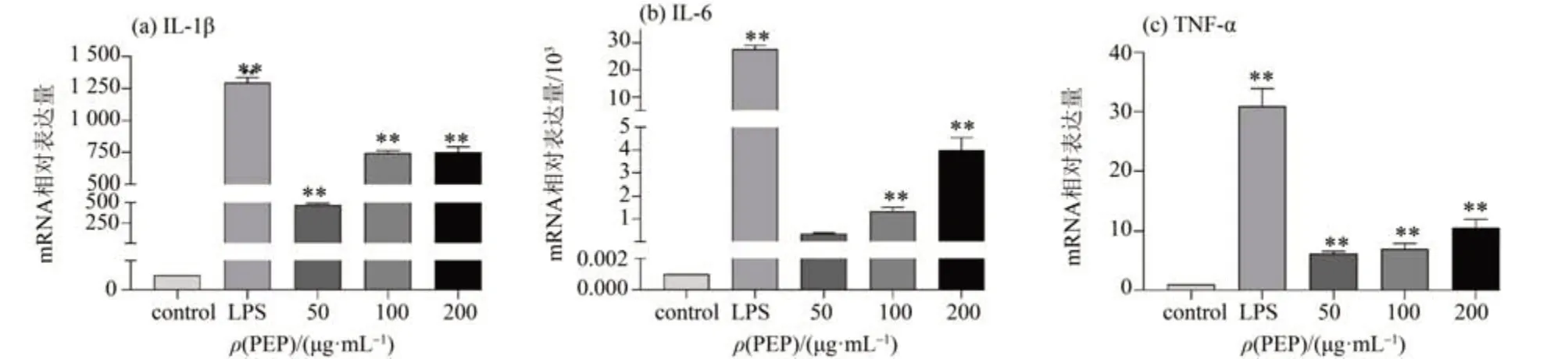
图3 PEP对RAW 264.7细胞的细胞因子mRNA表达的影响Fig.3 Effects of PEP on the mRNA expression of cytokines in RAW 264.7 cells
3 讨论与小结
微生物胞外多糖,尤其是来自于肠道微生物的多糖,由于其属于微生物重要的活性代谢产物,近年来已经成为研究热点之一。目前对胞外多糖的提取主要采用水提取,高浓度乙醇沉淀的方法,本研究也采用该方法对狄氏副拟杆菌胞外多糖进行了初步提取。初步提取得到的胞外多糖往往含有大量的蛋白质和色素等杂质会干扰到多糖的纯度以及活性,因此会采用一系列除蛋白以及脱色的操作对胞外多糖进行下一步的纯化。本研究采用酶法与Sevag 试剂相结合的方法对胞外多糖粗提物进行脱蛋白处理,一方面由于采用木瓜蛋白酶从而大大提高了除蛋白的效率,另一方面也减少了Sevag 试剂的用量,这对于日后胞外多糖的扩大生产具有良好的借鉴意义。树脂脱色具有条件温和,对多糖的保留率高等优点,因此我们采用了AB-8 大孔吸附树脂对胞外多糖进行脱色处理,从而避免出现脱色之余多糖损失过多以及降解等问题。
先天免疫反应是机体抵抗病原体入侵和外来物质的第一个屏障[20]。一些细胞,如巨噬细胞不仅在先天性免疫中发挥着重要作用,同时也作为桥梁,将非特异性免疫与特异性免疫连接在一起[21]。当巨噬细胞被激活以后,可以通过释放出NO、活性氧、细胞因子以及增强吞噬等途径来实现保护机体免受病原体侵害的作用,因此巨噬细胞常常被用于体外免疫活性的研究[22]。相关研究表明,增强免疫系统对免疫抑制、微生物感染、恶性肿瘤等疾病有良好的治疗效果[23]。作为生物反应调节剂,微生物胞外多糖显示出良好的免疫调节活性[24-25]。而狄氏副拟杆菌又是一株被证明具有多种益生活性的肠道共生菌,因此我们提取其胞外多糖,并对其免疫调节活性进行探究,我们发现该胞外多糖是一个纯度较高的多糖,并且可以通过促进巨噬细胞增殖、增加NO、活性氧的释放,增强吞噬功能以及促进细胞因子的表达等多种途径从而发挥其良好的免疫调节活性。
通过提高免疫功能的免疫疗法已成为治疗癌症的临床方法之一[26]。某些多糖可通过增强免疫力达到抗癌活性。例如,人参多糖RGRP-1b 本身对Huh7 肝癌细胞没有作用,但可以通过作用于巨噬细胞增强免疫功能,从而在癌症治疗中发挥作用[27]。此外,柴胡多糖BCAP-1 也具有类似的抗癌作用[28]。由于PEP 具有良好的免疫增强活性,有望在未来作为抗癌药物的佐剂使用。
综上所述,本研究首次从狄氏副拟杆菌中提取得到胞外多糖并证明其具有免疫调节活性。对狄氏副拟杆菌胞外多糖活性的研究一方面推动了胞外多糖的进一步发展,为狄氏副拟杆菌胞外多糖的商业化转化提供了可能,另一方面也为从胞外多糖的角度探讨肠道菌群的益生作用具有借鉴作用。

