参苓白术散对肠道菌群失调幼鼠肺部免疫炎症反应的影响
武妍琳,刘喜平,,贾育新,王小荣,武燕,李永玉,张映红,刘苗
1.甘肃中医药大学附属医院,甘肃 兰州 730000;2.甘肃中医药大学基础医学院,甘肃 兰州 730000
免疫炎症反应是肺部感染、支气管哮喘、慢性阻塞性肺疾病、脓毒症肺损伤等多种呼吸系统疾病发病的重要病理环节。抗生素滥用加重了病原菌感染后肺部炎症的进展,尤其婴幼儿呼吸道黏膜免疫发育不成熟,增加了患儿病死率[1]。研究发现,肠道菌群通过“肠-肺轴”对远端呼吸道黏膜免疫炎症反应有重要影响[2]。婴幼儿消化系统发育不完善,肠道菌群平衡尚未完全建立,抗生素滥用诱发肠道菌群失调,进而引起呼吸道黏膜免疫功能低下,加重婴幼儿肺部炎症反应,进而导致肺部感染及多种呼吸系统疾病的发生发展[3-4]。
参苓白术散出自《太平惠民和剂局方》,由人参、茯苓、白术、山药、白扁豆、莲子肉、薏苡仁、砂仁、桔梗、炙甘草组成,能健脾祛湿、培土生金,临床广泛应用于肺部感染、社区获得性肺炎、慢性阻塞性肺疾病、支气管哮喘等呼吸系统疾病的辅助治疗,可有效缓解症状,提高临床疗效[5]。研究表明,参苓白术散能调节肠道菌群,增强机体免疫功能[6],抑制反复呼吸道感染及肺炎患者机体炎症反应[7-9]。但其具体作用机制仍不清楚。因此,本研究通过抗生素诱导肠道菌群失调幼鼠模型,观察参苓白术散对模型幼鼠肺部免疫炎症反应的影响,以期为临床应用提供依据。
1 实验材料
1.1 动物
3~4周龄SPF级健康雄性Balb/c幼鼠60只,体质量(16±2)g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0006。饲养于甘肃中医药大学SPF级动物实验中心,温度(21±1)℃、相对湿度60%~70%环境,12 h光暗周期,予标准饲料和清洁自来水喂养。本实验经甘肃中医药大学动物伦理委员会审批(2020-264)。
1.2 药物
参苓白术散组方药物饮片购自甘肃中医药大学附属医院中药房,并由甘肃中医药大学药学院景明教授鉴定为正品。依据原方比例,参照现代临床剂量(麸炒白术15 g,山药15 g,茯苓15 g,生晒参15 g,白扁豆12 g,莲子肉9 g,麸炒薏苡仁9 g,砂仁6 g,桔梗6 g,炙甘草10 g)[10],将饮片混合后浸泡30 min,煎煮2次,第1次加8倍量水,煎煮1.5 h,第2次加6倍量水,煎煮1 h,合并2次煎煮液,过滤、浓缩至原药材浓度为1.12 g/mL。双歧杆菌四联活菌片,杭州远大生物制药有限公司,批号202005244,取适量药片粉碎后与生理盐水混合,配制成浓度为68 mg/mL溶液。氨苄西林,珠海联邦制药股份有限公司,批号96003103。盐酸万古霉素,上海源叶生物科技有限公司,批号H13M11Y113102。硫酸新霉素、两性霉素B、甲硝唑,北京索莱宝科技有限公司,批号分别为70210512、511B059、827L021。
1.3 主要试剂与仪器
脂多糖(LPS)、HE染色试剂盒,北京索莱宝科技有限公司,批号分别为408Z033、20190430;小鼠免疫球蛋白(Ig)G、IgM、IgA多因子ELISA检测试剂盒,小鼠肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-10、干扰素-γ(IFN-γ)多因子ELISA检测试剂盒,杭州联科生物技术股份有限公司,批号分别为A00924、202012。Specra Max i3x 型多功能酶标仪,美国Thermo Fisher Scientific公司;Z216MK型冷冻离心机,德国Hermle公司;TS-8型摇床,上海精密仪器制造公司;EG1150型石蜡包埋机、RM2016型石蜡切片机,德国Leica公司;IX51-A12PH型荧光倒置显微镜,日本Olympus公司;Illumina NovaSeq测序平台,美国Illumina公司。
2 实验方法
2.1 混合抗生素溶液配制
参考文献[11]方法制备混合抗生素溶液:将氨苄西林、甲硝唑、硫酸新霉素、盐酸万古霉素、两性霉素B与生理盐水混合,配制成浓度分别为10、10、10、5、0.1 mg/mL溶液。
2.2 造模及分组
从60只幼鼠中随机抽取10只作为空白组,剩余50只幼鼠参考文献[11]方法造模:每12 h灌胃混合抗生素溶液诱导幼鼠肠道菌群紊乱,灌胃体积10 mL/kg,连续21 d。末次灌胃后12 h,采用随机数字表法将50只造模幼鼠分为模型组、阳性对照组及参苓白术散高、中、低剂量组,每组10只。根据体表面积换算各组等效剂量[12],阳性对照组予0.68 g/kg双歧杆菌四联活菌片溶液灌胃,参苓白术散高、中、低剂量组分别予29.12、14.56、7.28 g/kg参苓白术散水煎液灌胃,每日1次,连续7 d。空白组和模型组予等量生理盐水灌胃。
2.3 16S rDNA测序分析
干预结束后,无菌收集幼鼠粪便,液氮中快速冷冻,置于-80 ℃冰箱保存。每组随机选取6个样本,委托苏州帕诺米克生物科技有限公司进行粪便DNA提取、引物合成、DNA测序和肠道菌群多样性检测。通过Illumina NovaSeq测序平台提取全基因组DNA,以稀释后的基因组DNA为模板,根据测序区域,使用带Barcode的特异引物和高效高保真酶进行PCR。通过Qubit定量和文库检测合格后,使用NovaSeq 6000进行上机测序。利用Uparse聚类所有样本的Effective Tags,默认将序列聚集到一致性为97%的OTUs中,将出现频率最高的序列作为OTUs的代表序列,作物种分类注释(设置阈值为0.8~1)。根据OTUs分类分析肠道微生物的物种多样性和物种差异。
2.4 一般状态观察
收集粪便后,除空白组外,其余各组幼鼠以4%水合氯醛腹腔注射(0.01 mL/g)麻醉,参考文献[13]方法,将幼鼠仰卧位固定于45°平板上,用微量进样针吸取1 g/L LPS 50 μL滴于幼鼠咽后壁,诱导炎症反应。每日观察记录幼鼠饮食量、毛发状态、活跃度、体质量等。
2.5 肺组织病理形态观察
LPS一次性诱导后第8日,水合氯醛腹腔注射麻醉幼鼠,仰卧位固定,取肺组织,冲洗后固定于10%多聚甲醛24 h,石蜡包埋,切片(6~10 μm),常规HE染色,镜下观察肺组织病理变化,并进行病理学评分[14]。
2.6 ELISA检测支气管肺泡灌洗液白细胞介素-10、干扰素-γ、肿瘤坏死因子-α含量
分离幼鼠颈部皮肤,暴露气管,留置针插管,预冷无菌PBS冲洗全肺2次,每次0.5 mL,回收冲洗液,室温静置4 h,4 ℃、1 200 r/min(离心半径10 cm)离心5 min,取上清液,按ELISA 试剂盒说明书检测IL-10、IFN-γ、TNF-α含量。
2.7 ELISA 检测血清免疫球蛋白G、免疫球蛋白M、免疫球蛋白A含量
幼鼠麻醉后腹主动脉采血,室温静置1 h,4 ℃、1 200 r/min(离心半径10 cm)离心5 min,分离血清,按ELISA试剂盒说明书检测IgG、IgM、IgA含量。
3 统计学方法
4 结果
4.1 参苓白术散对模型幼鼠肠道菌群多样性的影响
基于幼鼠肠道菌群α多样性指数绘制稀释曲线,由图1可知,样本数量合理、充足。Shannon指数表示物种多样性,Shannon指数越大则菌群多样性越高、物种分布越均匀。与空白组比较,模型组幼鼠肠道菌群Shannon指数明显降低(P<0.01);与模型组比较,阳性对照组和参苓白术散各剂量组幼鼠肠道菌群Shannon指数均明显升高(P<0.01);与参苓白术散低剂量组比较,参苓白术散高、中剂量组幼鼠肠道菌群Shannon指数明显降低(P<0.01)。见表1。主坐标分析(PCoA)结果显示,第一主成分可以解释组间61.29%的差异,第二主成分可以解释组间10.41%的差异,见图2。同时进行组间相似性分析(ANOSIM)显示,空白组和模型组之间r=1,P=0.007,提示组间差异显著。

图1 各组幼鼠肠道菌群稀释曲线
表1 各组幼鼠肠道菌群Shannon指数比较()

表1 各组幼鼠肠道菌群Shannon指数比较()
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与参苓白术散低剂量组比较,△△P<0.01
Shannon指数4.54±0.35 1.29±0.50**2.81±0.30##2.73±0.35##△△2.51±0.22##△△3.53±0.16##组别空白组模型组阳性对照组参苓白术散高剂量组参苓白术散中剂量组参苓白术散低剂量组只数6 6 6 6 6 6

图2 各组幼鼠肠道菌群PCoA
4.2 参苓白术散对模型幼鼠肠道菌群结构的影响
在门分类水平上,与空白组比较,模型组幼鼠肠道变形菌门Proteobacteria丰度明显增加(P<0.01),拟杆菌门Bacteroidota、厚壁菌门Firmicutes丰度明显减少(P<0.01),疣微菌门Verrucomicrobiota差异无统计学意义(P>0.05);与模型组比较,阳性对照组和参苓白术散各剂量组幼鼠肠道变形菌门丰度均明显减少(P<0.01),拟杆菌门、厚壁菌门丰度均明显增加(P<0.01),阳性对照组和参苓白术散高、低剂量组幼鼠肠道疣微菌门丰度明显增加(P<0.05,P<0.01)。见图3。

图3 各组幼鼠肠道菌群门水平物种叠加
在科分类水平上,与空白组比较,模型组幼鼠肠道肠杆菌科Enterobacteriaceae 丰度明显增加(P<0.01), 木 兰 科 Muribaculaceae、 拟 杆 菌 科Bacteroidaceae丰度明显减少(P<0.01);与模型组比较,阳性对照组和参苓白术散各剂量组幼鼠肠道肠杆菌科丰度均明显减少(P<0.01),参苓白术散低剂量组幼鼠肠道木兰科丰度明显增加(P<0.01),阳性对照组和参苓白术散高、中剂量组幼鼠肠道拟杆菌科丰度明显增加(P<0.01)。见图4。

图4 各组幼鼠肠道菌群科水平物种叠加
4.3 参苓白术散对模型幼鼠一般状态的影响
空白组幼鼠精神状态良好,反应灵敏,毛发顺滑光亮,进食正常,粪便正常;模型组幼鼠从LPS诱导肺部炎症后第1日开始出现精神萎靡、竖毛,饮水和进食量减少,体质量减轻;阳性对照组和参苓白术散各剂量组幼鼠自第3日开始精神状态好转,毛发逐渐柔顺,大便成形,食量及体质量逐渐增加,至第6日基本恢复正常,其中以参苓白术散高剂量组最为显著。见表2。
表2 各组幼鼠诱导肺部炎症后不同时点体质量变化(,g)

表2 各组幼鼠诱导肺部炎症后不同时点体质量变化(,g)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与参苓白术散高剂量组比较,△P<0.05,△△P<0.01
组别空白组模型组阳性对照组参苓白术散高剂量组参苓白术散中剂量组参苓白术散低剂量组第7日19.28±0.26 16.33±0.10**19.23±0.30##19.12±0.17##18.87±0.23##18.38±0.13##△△只数6 6 6 6 6 6第1日18.30±0.46 17.47±0.12**17.87±0.12 17.83±0.16 17.87±0.15 17.73±0.22第2日18.50±0.43 16.97±0.14**18.02±0.17##17.85±0.18##17.88±0.17##17.70±0.22##第3日18.58±0.38 16.82±0.15**18.25±0.19##18.13±0.16##18.08±0.21##17.82±0.20##第4日18.87±0.33 16.57±0.20**18.55±0.22##18.48±0.08##18.33±0.27##18.03±0.18##△第5日19.07±0.29 16.47±0.12**18.82±0.22##18.70±0.15##18.52±0.20##18.22±0.23##△△第6日19.25±0.29 16.38±0.10**19.02±0.26##18.95±0.14##18.73±0.24##18.32±0.19##△△
4.4 参苓白术散对模型幼鼠肺组织病理变化的影响
HE染色显示,空白组幼鼠肺组织染色均匀,肺泡结构清晰正常。与空白组比较,模型组幼鼠肺组织细支气管/支气管周围炎性细胞浸润范围和程度明显增加,肺组织损伤严重,可见大面积出血;与模型组比较,阳性对照组和参苓白术散各剂量组幼鼠肺组织炎症病理变化均有所减轻,其中以参苓白术散高、中剂量组最为显著。见图5。与空白组比较,模型组幼鼠肺组织病理评分明显升高(P<0.01);与模型组比较,阳性对照组和参苓白术散各剂量组幼鼠肺组织病理评分均明显降低(P<0.05,P<0.01)。见表3。

图5 各组幼鼠肺组织形态(HE染色,×200)
表3 各组幼鼠肺组织病理评分比较(,分)

表3 各组幼鼠肺组织病理评分比较(,分)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
病理评分2.00±1.00 20.00±1.73**6.67±1.53##7.33±1.15##14.67±1.15##16.33±1.53#组别空白组模型组阳性对照组参苓白术散高剂量组参苓白术散中剂量组参苓白术散低剂量组只数6 6 6 6 6 6
4.5 参苓白术散对模型幼鼠支气管肺泡灌洗液白细胞介素-10、干扰素-γ、肿瘤坏死因子-α含量的影响
与空白组比较,模型组幼鼠支气管肺泡灌洗液IL-10含量明显减少,IFN-γ、TNF-α含量明显增加,差异有统计学意义(P<0.01);与模型组比较,阳性对照组和参苓白术散高剂量组幼鼠支气管肺泡灌洗液IL-10含量明显增加,阳性对照组和参苓白术散高、中剂量组幼鼠支气管肺泡灌洗液IFN-γ、TNF-α含量明显减少,差异均有统计学意义(P<0.05,P<0.01)。见表4。
表4 各组幼鼠支气管肺泡灌洗液IL-10、IFN-γ、TNF-α含量比较(,pg/mL)

表4 各组幼鼠支气管肺泡灌洗液IL-10、IFN-γ、TNF-α含量比较(,pg/mL)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别空白组模型组阳性对照组参苓白术散高剂量组参苓白术散中剂量组参苓白术散低剂量组TNF-α 315.00± 30.7 552.00± 22.8**360.00± 34.2##372.00± 85.3##417.00± 22.8##519.00±171.9只数5 5 5 5 5 5 IL-10 1 225.8± 30.1 868.2± 52.0**1 197.0± 66.3##1 143.4± 78.9#820.2±293.9 921.0± 48.0 IFN-γ 613.5±118.9 949.5± 81.1**679.5± 69.1##721.5± 83.3##763.5±100.4##865.5± 91.5
4.6 参苓白术散对模型幼鼠血清免疫球蛋白G、免疫球蛋白M、免疫球蛋白A含量的影响
与空白组比较,模型组幼鼠血清IgM含量明显增加(P<0.01);与模型组比较,阳性对照组和参苓白术散各剂量组幼鼠血清IgM含量明显减少(P<0.05,P<0.01),以高剂量组差异最显著(P<0.01)。各组IgG、IgA差异无统计学意义(P>0.05)。见表5。
表5 各组幼鼠血清IgG、IgM、IgA含量比较(,ng/mL)

表5 各组幼鼠血清IgG、IgM、IgA含量比较(,ng/mL)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与参苓白术散高剂量组比较,△△P<0.01
组别空白组模型组阳性对照组参苓白术散高剂量组参苓白术散中剂量组参苓白术散低剂量组IgA 57.14±10.77 62.29±10.42 58.86± 7.72 58.67±10.02 58.29± 7.93 59.43± 7.45只数5 5 5 5 5 5 IgG 855.00±102.62 951.00± 86.43 879.00± 82.16 897.00± 69.07 903.00±106.91 939.00± 88.46 IgM 31.63±0.59 36.12±0.60**32.02±0.49##31.59±0.90##34.27±0.46##△△35.04±0.49#△△
4.7 相关性分析
将肠道菌群门、科水平的主要菌种与IL-10、IFN-γ、TNF-α、IgM进行Pearson相关性分析。不同菌群的丰度变化与支气管肺泡灌洗液炎症因子及血清特异性抗体含量存在不同程度的相关性,变形菌门、肠杆菌科丰度与支气管肺泡灌洗液IFN-γ含量呈显著正相关(P<0.05),拟杆菌门丰度与支气管肺泡灌洗液IFN-γ含量呈显著负相关(P<0.05);厚壁菌门丰度与支气管肺泡灌洗液IFN-γ、TNF-α及血清IgM含量呈极显著负相关(P<0.01),与IL-10含量呈显著正相关(P<0.05)。见表6。
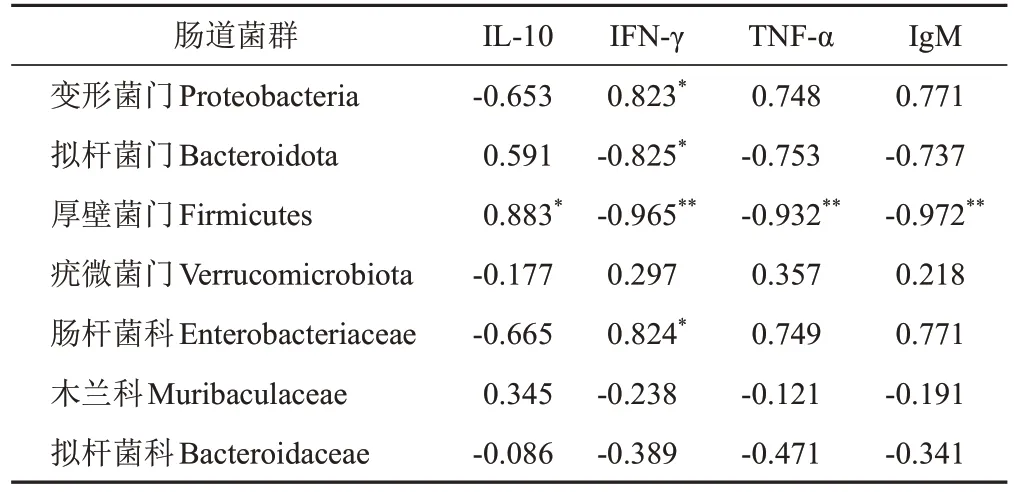
表6 肠道菌群与炎症因子及特异性抗体的相关性分析
5 讨论
正常的肠道菌群为人体生态平衡提供调节作用,包括对调节免疫功能和机体代谢、增加胃肠动力、对病菌的抵抗等。婴幼儿时期呼吸道感染与菌群多样性减少密切相关。研究发现,肠道菌群通过“肠-肺轴”影响呼吸系统疾病的病理和免疫功能[15],肠道菌群失调引起的免疫反应可影响肺部炎症反应,同时也可通过肠黏膜系统和免疫活性因子对机体免疫产生影响[16-18]。中药对肠道菌群的调节相比西药具有全面、双向调节的优势,既能促进益生菌生长,又可抑制有害菌繁殖[19-21]。
本研究通过16S rDNA高通量测序技术分析不同剂量参苓白术散对肠道菌群结构的影响,结果模型组幼鼠肠道厚壁菌门、拟杆菌门丰度显著减少,变形菌门丰度显著增加,菌群丰度及多样性发生变化。厚壁菌门、拟杆菌门是健康宿主共有的优势菌群[3]。不同剂量参苓白术散对肠道菌群的丰度及多样性均有明显回调作用,其中以低剂量组最为显著。在科水平上,模型组幼鼠肠道肠杆菌科丰度显著增加,木兰科、拟杆菌科丰度显著减少,不同剂量参苓白术散干预后,菌群丰度明显回调。肠杆菌科中丰度较低的肠杆菌属和克雷伯菌属等在菌群失调期间可能过度生长和占主导地位[22-23]。克雷伯菌属中的克雷伯杆菌常寄生于动物呼吸道或肠道,为条件病原菌,是引起人类肺炎的病原菌之一,特别是免疫功能低下的新生儿和老年人[24-25]。另外,Deng等[26]研究显示,肠道菌群木兰科的波动可能对炎症和肿瘤发生率有显著影响。
LPS是引起急性肺损伤、脓毒症等病症的重要致病因子,能促进炎症因子产生,引起肺内中性粒细胞聚集和激活。IL-10可通过抑制核因子-κB激活,从而抑制急性肺损伤大鼠肺泡巨噬细胞释放TNF-α、IL-1β等前炎性细胞因子,减轻肺部炎症反应[27]。韩俊阁等[28]发现,高氧刺激下,小鼠肺和大肠黏膜免疫因子TNF-α、IL-1β等具有同步性,这可能是“肺与大肠相表里”的重要生物学基础。本实验中,参苓白术散各剂量组幼鼠支气管肺泡灌洗液中促炎因子TNF-α、IFN-γ含量减少,抑炎因子IL-10含量增加,表明参苓白术散对LPS诱导的肺部炎症有明显改善作用。此外,不同剂量参苓白术散干预后血清IgM含量显著减少,但IgG和IgA含量无明显变化。IgM可作为早期感染的诊断指标,其变化一定程度上说明菌群失调导致肺部免疫感染加重。
相关性分析显示,参苓白术散对有益菌的调节与对免疫反应的调节呈正相关性,说明参苓白术散不仅具有益气健脾、渗湿止泻之功,又可调节肠道菌群和人体免疫功能,提示其可能通过改善肠道菌群结构和多样性提高肺部免疫功能,为阐明“肺与大肠相表里”的机制奠定了基础,可为进一步探讨“培土生金”法防治肠道菌群失调相关肺部免疫疾病提供依据。
综上,参苓白术散可调节抗生素诱导的菌群失调幼鼠菌群丰度及多样性,调整肠道菌群结构,改善肺部免疫炎症反应,但肠道菌群结构与组成相对复杂,目前仍有部分肠道菌群及其生物学意义尚无法完全阐明,还需进一步深入探讨。

