瑶药尖尾枫果实活性部位筛选及其化学成分研究
邹芷琪,于玲玲,潘争红*,宁德生,符毓夏,李连春
1广西中医药大学药学院,南宁 530200; 2广西壮族自治区中国科学院广西植物研究所广西植物功能物质与资源持续利用重点实验室,桂林 541006
尖尾枫Callicarpalongissima(Hemsl.) Merr为马鞭草科紫珠属植物,又名粘手风、赤药子、穿骨风(广西)、牛舌广(福建)等,有祛风湿、祛瘀消肿、止血镇痛之功效[1,2],是广西特色瑶药“七十二风”之一,在壮、瑶等少数民族地区有广泛应用,常以全株入药。目前,关于尖尾枫的研究主要集中在枝叶的化学成分分离[3,4]、含量分析[5]、挥发油提取[6]及药理活性[7,8]等方面,研究显示其枝叶中含有丰富的萜类、苯丙素类、木脂素类、黄酮类、甾醇类及挥发油等成分,而且在抗炎、抗氧化、美白等方面具有良好的生物活性。然而对于资源量丰富的尖尾枫果实,尚未见其化学成分及生物活性报道。本课题组前期对尖尾枫果实进行了精油制备并发现其具有较好的抗炎、美白作用[9]。为了进一步明确尖尾枫的活性部位及其物质基础,本实验以尖尾枫果实为研究对象,通过NO生成抑制模型与多种抗氧化方法进行活性评价,筛选出尖尾枫果实的活性部位,并对其开展化学成分研究,研究结果将阐明尖尾枫果实抗炎、抗氧化作用的物质基础,为尖尾枫资源高效合理利用提供科学依据和理论基础。
1 材料与方法
1.1 仪器与材料
LC-MS-IT-TOF液相质谱联用仪、LC-2030C 3D高效液相色谱仪(日本岛津公司);二氧化碳细胞培养箱、-80 ℃超低温冰箱(Thermo Forma公司);全波长多功能酶标仪(Biotek公司);倒置显微镜(舜宇光学科技有限公司);紫外-可见分光光度计T6(北京普析通用仪器有限公司);超导核磁共振波谱仪(瑞士Brucker公司);HyClone胎牛血清(HyClone公司);LPS、MTT、DMSO(Sigma公司);DMEM培养基(Invitrogen公司);NO检测试剂盒(Promege公司);总抗氧化能力检测试剂盒(碧云天生物技术有限公司);2,2-联苯基-1-苦基肼基(DPPH)(麦克林生化科技有限公司);色谱纯试剂(赛默飞世尔科技(中国)有限公司);氘代试剂(安诺伦(北京)生物科技有限公司);分析纯试剂(广东光华科技股份有限公司)。
细胞株:小鼠单核巨噬细胞(RAW 264.7细胞),购买于中国典型培养物保藏中心。
植物样品采集于广西桂林植物园,经广西植物研究所黄俞淞副研究员鉴定为植物尖尾枫Callicarpalongissima(Hemsl.) Merr的果实。
1.2 实验方法
1.2.1 样品提取
取干燥粉碎后的尖尾枫果实5.0 kg,用95%乙醇于室温下浸提5次,每次48 h,减压回收得到粗提物浸膏802.1 g(Fr.1)。将浸膏与水混悬,依次用石油醚、乙酸乙酯、正丁醇进行萃取,得到石油醚(Fr.2)、乙酸乙酯(Fr.3)、正丁醇(Fr.4)、水(Fr.5)4个部位。
1.2.2 抗氧化活性测定
1.2.2.1 DPPH法测定自由基清除能力[10]
精密称取DPPH 9.859 mg,加无水乙醇配置成0.1 mmol/L的DPPH储备液待用。精密称取Vc(抗坏血酸)样品1 mg,加甲醇配置得到浓度为0.2 g/L的标准溶液。吸取一系列浓度的待测样品和Vc溶液于10 mL的具塞试管中,加水至2 mL,再加2 mL的DPPH储备液,混匀后,避光反应20 min,在517 nm下测定其吸光值。以样品浓度为横坐标,对应的清除率为纵坐标,作回归曲线,并计算出IC50值。以Vc作为阳性对照,实验重复3次。
1.2.2.2 FRAP法测定总抗氧化能力
参照FRAP试剂盒方法,每孔加入FRAP工作液180 μL,5 μL待测样品,混匀,37 ℃反应4 min后测定A593 nm。以一系列不同浓度的FeSO4标准溶液绘制标准曲线,以每1 g待测样品相当于FeSO4的mmol数为该待测样品的FRAP值(FeSO4mmol/g)。实验以Vc为阳性对照,重复3次。
1.2.2.3 ABTS法测定总抗氧化能力
参照ABTS试剂盒方法,每孔加入200 μL的ABTS工作液,待测样品10 μL,室温下反应3 min后测定A734 nm。以一系列不同浓度的Trolox标准溶液绘制标准曲线,以TEAC(Trolox等效物抗氧化能力)来表示样品的抗氧化活性,该值越大,其抗氧化活性越强。实验以Vc为阳性对照,重复3次。
1.2.3 抗炎活性筛选
部位抗炎活性筛选:利用脂多糖(LPS)诱导小鼠巨噬细胞RAW 264.7作为抗炎活性筛选模型,采用Griess法来检测NO的释放量[11]。取对数生长期的RAW 264.7细胞接种于24孔板中,设加药组和LPS组,各组加入终浓度为25 μg/mL的药物和终浓度为0.2 μg/mL的LPS,经培养后取其上清液,加入Griess试剂,混匀反应后于波长570 nm处测定其吸光值。
化合物抗炎活性筛选:加药组各组加入浓度为25 μmol/L的化合物,其余步骤同“部位抗炎活性筛选”。
1.2.4 化合物的分离
Fr.3(351.5 g)经MCI初步分离,用甲醇-水(70%→100%)进行洗脱,得到A1~A5五个组分。A1组分经甲醇反复重结晶得到化合物1(6.6 mg);A2组分经硅胶柱分离,以石油醚-丙酮(50∶1→1∶1)进行洗脱,经TLC检测后合并得到F1~F5共5个组分。F3经凝胶柱色谱(氯仿-甲醇1∶1)和HPLC(乙腈∶水=60∶40→70∶30,40 min,3.0 mL/min)纯化得到化合物3(1.5 mg)、7(2.9 mg)、8(4.1 mg)、9(2.4 mg);F2经硅胶柱,以石油醚-乙酸乙酯(100∶1→10∶1)进行梯度洗脱,得到化合物6(24.2 mg);A3组分经硅胶柱,以石油醚-丙酮(20∶1→2∶1)进行梯度洗脱,再通过HPLC(乙腈∶水=60∶40,2.0 mL/min)进行进一步的分离纯化,得到化合物2(3.4 mg)、4(4.8 mg)、5(3.5 mg)。
1.2.5 数据处理
采用IBM SPSS Statistics 26数据分析软件进行单因素ANOVA显著性分析,实验数据表示为“平均数±标准差”,P< 0.01表示有极显著差异,有统计学意义。
2 实验结果
2.1 抗氧化实验结果
2.1.1 DPPH自由基清除能力评价
如表1所示,尖尾枫各部位均具有一定的DPPH自由基清除能力,其中乙酸乙酯部位(Fr.3)的DPPH自由基清除能力最强。

表1 尖尾枫各部位的DPPH自由基清除能力Table 1 The DPPH radical scavenging ability of C.longissima
2.1.2 总抗氧化能力评价
FRAP、ABTS法实验结果一致显示(见图1),尖尾枫果实的乙酸乙酯萃取部位(Fr.3)的总抗氧化效果最好,总抗氧化能力分别为4.192 8(FeSO4mmol/g)、1.744 0(Trolox mmol/g)。
2.2 抗炎活性实验
2.2.1 部位抗炎活性
尖尾枫不同部位对LPS诱导的RAW 264.7细胞NO释放的影响结果如表2所示,与对照组相比,模型组的NO含量显著升高(P< 0.01);与模型组相比,浓度为25 μg/mL的粗提物及各个萃取部位均能显著抑制NO的释放(P< 0.01),表现出一定程度上的抗炎活性,在同一质量浓度下,乙酸乙酯部位(Fr.3)的活性最强。
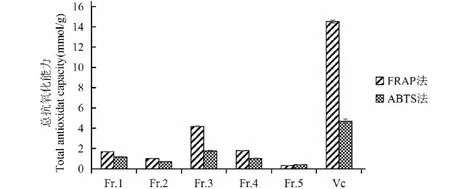
图1 尖尾枫各部位总抗氧化能力(n = 3)Fig.1 Total antioxidant capacity of C.longissima in each fraction ( n = 3)

表2 尖尾枫各部位的抗炎活性Table 2 The anti-inflammatory activity of C.longissima
2.2.2 化合物抗炎活性
从尖尾枫乙酸乙酯部位(Fr.3)分离得到的化合物1~9对LPS诱导的RAW 264.7细胞NO释放的影响结果如表3所示,与空白对照组比较,模型组的NO含量显著升高(P< 0.01);与模型组比较,浓度为25 μmol/L的化合物1~9均能显著抑制NO的释放(P< 0.01),表现出不同程度的抗炎活性,在相同浓度水平下,化合物3、4的活性强于其他化合物。
2.3 结构鉴定
化合物1黄色线状晶体;ESI-MS:m/z373.12 [M-H]-,分子式为C19H18O8;1H NMR(500 MHz,CDCl3)δ:7.71(1H,d,J= 1.5 Hz,H-2′),7.67(1H,dd,J= 8.5,1.5 Hz,H-6′),7.05(1H,d,J= 8.5Hz,H-5′),6.50(1H,s,H-8),3.98(3H,s,3′-OCH3),3.96(3H,s,7-OCH3),3.92(3H,s,6-OCH3),3.86(3H,s,3-OCH3);13C NMR(125 MHz,CDCl3)δ:156.1(C-2),138.9(C-3),179.0(C-4),152.9(C-5),132.5(C-6),158.9(C-7),90.5(C-8),152.8(C-9),106.7(C-10),122.6(C-1′),111.1(C-2′),146.6(C-3′),148.5(C-4′),114.7(C-5′),122.8(C-6′),60.3(3-OCH3),61.0(6-OCH3),56.5(7-OCH3),56.3(3′-OCH3)。上述数据与文献[12]报道基本一致,因此化合物1鉴定为猫眼草黄素。

表3 化合物1~9的抗炎活性筛选 s,n = 3)Table 3 Anti-inflammatory activity screening of compounds 1-9

图2 化合物1~9的化学结构Fig.2 Chemical structures of compounds 1-9
化合物2黄色无定形粉末;ESI-MS:m/z345.12 [M+H]+,分子式为C18H16O7;1H NMR(500 MHz,CD3OD)δ:7.73(1H,s,H-2′),7.68(1H,d,J= 8.5 Hz,H-6′),6.96(1H,d,J= 8.5 Hz,H-5′),6.64(1H,s,H-8),6.34(1H,s,H-6),3.95(3H,s,3′-OCH3),3.89(3H,s,7-OCH3),3.81(3H,s,3-OCH3);13C NMR(125 MHz,CD3OD)δ:163.3(C-2),124.7(C-3),185.0(C-4),160.1(C-5),96.2(C-6),158.7(C-7),95.5(C-8),151.4(C-9),104.4(C-10),123.5(C-1′),113.0(C-2′),149.5(C-3′),148.4(C-4′),116.2(C-5′),110.2(C-6′),51.3(3-OCH3),56.5(7-OCH3),56.1(3′-OCH3)。以上数据与文献[13]报道基本一致,故化合物2鉴定为藿香黄酮醇。
化合物3无色针状晶体;ESI-MS:m/z329.03 [M-H]-,分子式为C20H26O4;1H NMR(500 MHz,(CD3)2CO)δ:6.77(1H,s,H-14),5.43(1H,dd,J= 4.0,1.5 Hz,H-7),3.30(1H,sept,J= 6.0 Hz,H-15),2.83(1H,m,H-1b),2.54(1H,td,J= 13.5,4.0 Hz,H-1a),2.18(1H,ddd,J= 14.0,5.5,4.0 Hz,H-6a),1.94(1H,m,H-2b),1.85(1H,ddd,J= 14.0,10.5,1.5 Hz,H-6b),1.71(1H,dd,J= 10.5,5.5 Hz,H-5),1.58(1H,m,H-2a),1.49(1H,m,H-3b),1.31(1H,td,J= 13.5,3.5 Hz,H-3a),1.19(3H,d,J= 7.0 Hz,H-17),1.18(3H,d,J= 7.0 Hz,H-16),0.88(3H,s,H-18),0.87(3H,s,H-19);13C NMR(125 MHz,(CD3)2CO)δ:29.9(C-1),19.7(C-2),41.8(C-3),35.1(C-4),46.3(C-5),30.6(C-6),78.2(C-7),133.6(C-8),123.1(C-9),49.2(C-10),144.0(C-11),143.4(C-12),135.1(C-13),112.4(C-14),27.5(C-15),23.1(C-16),23.1(C-17),32.0(C-18),20.0(C-19),176.0(C-20)。以上数据与文献[14]报道基本一致,故化合物3鉴定为鼠尾草酚。
化合物4白色粉末;ESI-MS:m/z347.16 [M+H]+,分子式为C20H26O5;1H NMR(500 MHz,CD3OD)δ:6.85(1H,s,H-14),4.60(1H,d,J= 3.5 Hz,H-7),4.53(1H,d,J= 3.5 Hz,H-6),3.24(1H,sept,J= 6.5 Hz,H-15),2.82(1H,m,H-1b),2.26(1H,s,H-5),1.30(1H,m,H-3a),1.20(3H,d,J= 6.5 Hz,H-17),1.17(3H,d,J= 6.5 Hz,H-16),1.02(3H,s,H-18),0.90(3H,s,H-19);13C NMR(125 MHz,CD3OD)δ:28.6(C-1),20.1(C-2),39.4(C-3),32.5(C-4),51.6(C-5),79.9(C-6),69.1(C-7),129.4(C-8),124.9(C-9),48.3(C-10),145.3(C-11),143.3(C-12),137.4(C-13),120.4(C-14),27.9(C-15),23.0(C-16),23.2(C-17),31.7(C-18),22.3(C-19),180.9(C-20)。以上数据与文献[14]报道基本一致,故化合物4鉴定为迷迭香酚。
化合物5白色粉末;ESI-MS:m/z361.21 [M+H]+,分子式为C21H28O5;1H NMR(500 MHz,CD3OD)δ:6.76(1H,s,H-14),4.80(1H,d,J= 3.0 Hz,H-6),4.27(1H,d,J= 3.0 Hz,H-7),3.65(3H,s,7-OCH3),3.21(1H,sept,J= 6.5 Hz,H-15),2.17(1H,s,H-5),1.96(1H,td,J= 14.0,5.5 Hz,H-1a),1.60(1H,m,H-2a),1.24(1H,m,H-3a),1.21(3H,d,J= 7.0 Hz,H-17),1.19(3H,d,J= 7.0 Hz,H-16),0.92(3H,s,H-19),0.89(3H,s,H-18);13C NMR(125 MHz,CD3OD)δ:28.6(C-1),20.2(C-2),39.4(C-3),32.4(C-4),52.3(C-5),76.1(C-6),78.9(C-7),127.7(C-8),125.1(C-9),48.8(C-10),145.3(C-11),143.7(C-12),137.4(C-13),120.9(C-14),27.9(C-15),22.9(C-16),23.1(C-17),22.4(C-18),32.0(C-19),180.9(C-20),58.6(7-OCH3)。以上数据与文献[15]报道基本一致,故化合物5鉴定为7-甲氧基迷迭香酚。
化合物6无色晶体;ESI-MS:m/z397.20 [M+Na]+,分子式为C22H30O5;1H NMR(500 MHz,CDCl3)δ:6.78(1H,s,H-14),6.06(1H,s,11-OH),5.51(1H,s,12-OH),4.66(1H,d,J= 3.5 Hz,H-6),4.36(1H,d,J= 3.5 Hz,H-7),3.86(2H,m,H-21),3.18(1H,br d,J= 13.5 Hz,H-1a),3.06(1H,sept,J= 7.0 Hz,H-15),2.28(1H,s,H-5),1.99(1H,td,J= 13.5,5.5 Hz,H-1b),1.68(1H,m,H-2a),1.56(1H,m,H-2b),1.46(1H,m,H-3a),1.33(3H,t,J= 7.0 Hz,H-22),1.23(3H,d,J= 7.0 Hz,H-17),1.21(3H,d,J= 7.0 Hz,H-16),1.19(1H,m,H-3b),1.01(3H,s,H-18),0.92(3H,s,H-19);13C NMR(125 MHz,CDCl3)δ:27.4(C-1),19.0(C-2),38.0(C-3),31.4(C-4),50.9(C-5),75.3(C-6),75.8(C-7),126.8(C-8),124.4(C-9),47.0(C-10),142.3(C-11),141.7(C-12),134.6(C-13),120.7(C-14),27.5(C-15),22.2(C-16),22.4(C-17),31.4(C-18),22.1(C-19),178.9(C-20),66.3(C-21),15.8(C-22)。以上数据与文献[16]报道基本一致,故化合物6鉴定为7-乙氧基迷迭香酚。
化合物7白色粉末;ESI-MS:m/z347.31 [M+H]+,分子式为C21H30O4;1H NMR(500 MHz,CDCl3)δ:6.51(1H,s,H-14),3.73(3H,s,11-OCH3),3.53(1H,br d,J= 13.5 Hz,H-1b),3.16(1H,sept,J= 7.0 Hz,H-15),2.83(2H,m,H-7),2.28(1H,m,H-5),1.82(1H,m,H-1a),1.22(3H,d,J= 7.5 Hz,H-17),1.20(3H,d,J= 7.5 Hz,H-16),0.97(3H,s,H-18),0.86(3H,s,H-19);13C NMR(125 MHz,CDCl3)δ:32.1(C-1),20.1(C-2),41.6(C-3),34.0(C-4),61.8(C-5),20.1(C-6),34.2(C-7),134.7(C-8),125.6(C-9),47.8(C-10),142.4(C-11),139.6(C-12),118.2(C-13),26.6(C-14),24.0(C-16),23.6(C-17),32.9(C-18),18.6(C-19),181.8(C-20),54.4(11-OCH3)。以上数据与文献[17]报道基本一致,故化合物7鉴定为carnosic acid-11-methylether。
化合物8白色粉末;ESI-MS:m/z343.21 [M-H]-,分子式为C20H24O5;1H NMR(500 MHz,CDCl3)δ:9.76(1H,s,H-7),9.66(1H,s,H-6),7.40(1H,s,H-14),4.09(1H,s,H-5),3.34(1H,sept,J= 7.0 Hz,H-15),2.27(1H,td,J= 13.5,4.0 Hz,H-1a),2.10(1H,m,H-2a),1.89(1H,m,H-3a),1.70(1H,m,H-1b),1.61(1H,m,H-3b),1.56(1H,m,H-2b),1.50(3H,s,H-18),1.28(3H,s,H-19),1.28(3H,d,J= 7.0 Hz,H-17),1.27(3H,d,J= 7.0 Hz,H-16);13C NMR(125 MHz,CDCl3)δ:31.6(C-1),16.7(C-2),40.3(C-3),34.0(C-4),61.2(C-5),201.1(C-6),192.0(C-7),124.1(C-8),136.0(C-9),48.3(C-10),142.6(C-11),141.2(C-12),131.7(C-13),131.3(C-14),27.1(C-15),22.2(C-16),22.3(C-17),33.4(C-18),23.9(C-19),177.1(C-20)。以上数据与文献[18]报道基本一致,故化合物8鉴定为迷迭香双醛。
化合物9白色粉末;ESI-MS:m/z317.79 [M+H]+,分子式为C20H28O3;1H NMR(500 MHz,CD3OD)δ:6.59(1H,s,H-14),4.67(1H,dd,J= 3.5,1.5 Hz,H-7),4.32(1H,dd,J= 16.0,8.5 Hz,H-20a),3.25(1H,sept,J= 7.0 Hz,H-15),3.02(1H,dd,J= 8.5,1.5 Hz,H-20b),2.74(1H,td,J= 14.0,4.5 Hz,H-1a),1.43(1H,m,H-5),1.29(1H,m,H-3b),1.21(3H,d,J= 7.0 Hz,H-17),1.20(3H,d,J= 7.0 Hz,H-16),1.14(3H,s,H-19),0.86(3H,s,H-18);13C NMR(125 MHz,CD3OD)δ:38.9(C-1),20.1(C-2),42.5(C-3),34.9(C-4),44.7(C-5),31.4(C-6),72.7(C-7),134.8(C-8),129.7(C-9),41.1(C-10),141.9(C-11),143.5(C-12),133.9(C-13),112.9(C-14),27.9(C-15),23.4(C-16),23.3(C-17),33.5(C-18),21.6(C-19),69.9(C-20)。以上数据与文献[19]报道基本一致,故化合物9鉴定为20-去氧鼠尾草酚。化合物1~9的结构见图2。
3 讨论与结论
本实验通过多种模型筛选出尖尾枫果实抗氧化、抗炎活性的最佳部位——乙酸乙酯部位,并从中分离鉴定出一系列二萜酚成分。通过抗炎活性结果与结构关系分析发现,二萜酚类化合物中的邻二酚羟基(C-11和C-12)是其抗炎活性的关键基团;C-7上的羟基若被甲氧基或乙氧基取代(化合物5、6),抗炎活性显著降低;另外,若C-20与C-6或C-7形成含氧环,抗炎活性提高。
鼠尾草酚(3)、迷迭香酚(4)是尖尾枫乙酸乙酯部位的主要活性成分。研究表明,鼠尾草酚、迷迭香酚不仅抗氧化活性显著[20],而且可通过抑制MAPK、NF-kB、STAT3等信号通路,抑制iNOS、COX-2的表达,缓解炎症损伤[21,22]。新近,我们在抗类风湿性关节炎(RA)研究中发现,从尖尾枫枝叶中获得的鼠尾草酚、迷迭香酚具有协同增效作用,它们通过阻断TLR4/NF-kB/MAPK通路,抑制炎症反应,改善RA[23],提示鼠尾草酚、迷迭香酚抗炎活性好,具备开发治疗RA新药的潜力。因此,通过本实验,进一步阐明了尖尾枫果实抗氧化、抗炎活性部位及其物质基础,这将为尖尾枫资源综合开发利用提供科学依据。

