橡实不同极性萃取物对α-淀粉酶和α-葡萄糖苷酶抑制作用研究
于聪聪,姚玉阳,耿雪营, 苗启明,郭俊霞,张艳贞,米生权*
1北京联合大学健康与环境学院;2北京联合大学生物活性物质与功能食品(北京市)重点实验室,北京 100021
2型糖尿病(T2DM)是以餐后高血糖为特征的慢性代谢类疾病,其碳水化合物、蛋白质、脂质代谢异常,导致血糖水平失控[1]。临床研究发现α-淀粉酶和α-葡萄糖苷酶抑制剂能够抑制餐后葡萄糖峰值,延缓碳水化合物的消化,减少葡萄糖水平的吸收[2,3]。α-淀粉酶抑制剂可作为碳水化合物的阻滞剂,限制胃肠道饮食的消化率,减少碳水化合物的摄入和吸收[4]。α-葡萄糖苷酶抑制剂主要通过可逆占据酶与底物的结合位点,从而减少多糖的降解,延缓肠道对碳水化合物的吸收,最终达到降糖作用[5,6]。因此,α-淀粉酶和α-葡萄糖苷酶抑制剂被认为是高血糖预防性治疗的有效手段。然而,目前临床合成α-淀粉酶和α-葡萄糖苷酶抑制剂仅限于阿卡波糖、米格列醇和伏格列波糖,虽然这些抑制剂能够延缓葡萄糖的吸收,但其在预防治疗过程中通常都伴有一定的副作用,如腹胀、腹泻、腹痛等[7,8]。寻求具有更高功效、更少副作用影响的抑制剂成为目前的研究热点。来自植物的天然酶抑制剂因其具有较少副作用和较高活性功能而被人们重点关注。
橡实是全皮栎和麻栎的果实,广泛分布于我国辽宁、河北、陕西等地,因其含有大量鞣质而被人们广泛关注。随着研究的不断深入,发现橡实含多种生物活性物质,如蛋白质、纤维素、黄酮类物质、多酚类物质等,具有较强的抗氧化、抗炎、抑菌、抗肿瘤和抗衰老作用,能够降低心血管疾病、糖尿病和微生物感染的发病风险[9-12]。本文以全皮栎野生橡实为材料,研究其不同极性萃取物对α-淀粉酶和α-葡萄糖苷酶活性的抑制作用,通过福林酚法、HPLC法和分子对接技术追踪活性组分,推测橡实活性组分中的主要活性成分,以期为橡实降糖功能研究奠定基础。
1 材料与方法
1.1 试剂与仪器
全皮栎野生橡实;α-葡萄糖苷酶(1 kU/13.4 mg)、α-淀粉酶(3700 U/g)、(4-硝基苯基)-α-D-吡喃葡萄糖苷(PNPG)、DNS试剂、阿卡波糖(北京索莱宝科技有限公司);可溶性淀粉(MW=342.3)、无水乙醇、色谱级甲醇、乙酸(鼎国有限公司);纤维素酶(10 000 U/g,上海阿拉丁生化科技股份有限公司);鞣花酸(批号:B21073)、没食子酸(批号:B20851)、绿原酸(批号:B20782)、阿魏酸(批号:B20007)、原儿茶酸(批号:B21614)、(+)-儿茶素(批号:B21722)(纯度均为HPLC≥98%,上海源叶生物科技有限公司)。
Y1-050ST型超声清洗机(河北德科机械科技有限公司);UV-2550型紫外分光光度计(日本岛津公司);DHG-9070A型电热恒温鼓风干燥箱(上海浦东荣丰科技仪器有限公司),RE52CS型旋转蒸发仪(上海亚荣生化仪器厂);高速万能粉碎机(天津市泰斯特仪器有限公司);HW-SY11-K型电热恒温水浴锅(北京市长风仪器仪表公司);Agilent Technologies 1200 Series高效液相色谱仪、Diamonsil C18色谱柱(250 mm × 4.6mm × 5 μm,美国安捷伦公司)。
1.2 橡实不同极性萃取物的制备
将新鲜的橡实用清水洗净,用电热鼓风干燥机于45 ℃干燥48 h,去壳、去皮,粉碎过80目筛。
纤维素酶-超声辅助提取:准确称取5.0 g橡实粉末于三角瓶中,与40%乙醇溶液按料液比1∶20 g/mL混合,加入纤维素酶(4 mg/mL),pH调至5,置于超声波清洗仪中。超声条件为270 W和30 min。超声结束后在100 ℃,水浴5 min,使酶灭活。旋转蒸发浓缩,最后用真空冷冻干燥机于-50 ℃干燥24 h直至变成粉末状,密封4 ℃下冷藏保存备用,即获得橡实粗提物。
不同极性萃取物的制备:将上述粗提物用蒸馏水溶解,按1∶1的比例用石油醚萃取3次,得到石油醚相和水相一。水相一继续按以1∶1的比例用乙酸乙酯萃取3次,得到乙酸乙酯相和萃余水相。旋转蒸发浓缩各萃取相,最后用真空冷冻干燥机于-50 ℃干燥24 h直至变成粉末状,密封4 ℃下冷藏保存备用,即获得石油醚相、乙酸乙酯相、萃余水相。
1.3 不同极性组分对α-淀粉酶活性的影响
在96孔板中加入50 μL不同浓度的样品或阿卡波糖(1、2、3、4、5、6、7、8和9 mg/mL),再加入50 μL的1.5%(W/V)淀粉溶液,37 ℃水浴10 min;再加入10 μL含α-淀粉酶溶液(0.5 mg/mL)的0.02 mol/L PBS缓冲溶液(pH=6.9),37 ℃水浴10 min;最后加入20 μL DNS试剂,95 ℃水浴8 min,冷却后用酶标仪在540 nm下测吸光度。用缓冲液代替酶溶液作为空白,用缓冲液代替样液作为对照。按公式(1)计算酶活抑制率及IC50值。
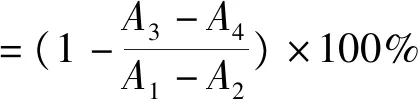
(1)
式中:A1为不含样品含有酶的吸光度,A2为不含样品不含酶的吸光度,A3为含有样品含有酶的吸光度,A4为含有样品不含酶的吸光度。
1.4 不同极性组分对α-葡萄糖苷酶活性的影响
在96孔板中加入50 μL PBS缓冲液(pH=6.9)、20 μL样品或阿卡波糖(0、1、2、4、6、8、10、20、30、40、50 μg/mL)、20 μL 4-硝基苯基-α-D-吡喃葡萄糖苷(5 mmol/L),在37 ℃反应10 min,加入10 μLα-葡萄糖苷酶(0.1 U/mL),37 ℃再反应10 min,加入10 μL 0.02 mol/L Na2CO3溶液终止反应,用酶标仪在405 nm下测吸光度。用PBS缓冲液(pH=6.9)代替酶溶液作为空白,用PBS缓冲液(pH=6.9)代替样液作为对照。按公式(1)计算酶活抑制率及IC50值。
1.5 多酚含量的测定
利用Folin-酚试剂比色法测定总多酚含量。标准曲线的制作:以没食子酸作为标准样品,配制0.1 mg/mL的没食子酸标准母液。取6只10 mL容量瓶,精密吸取0(空白)、0.2、0.4、0.6、0.8、1.0 mL没食子酸标准母液于10 mL容量瓶中,分别加入20%福林酚试剂1.0 mL,混匀,加入15% Na2CO3溶液2.0 mL,混匀,加水定容、摇匀。反应静置60 min后测定765 nm处吸光度值。以标准溶液浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。得线性回归方程为:Y=6.104 3X+0.008 3(r2=0.995 9)。没食子酸在0~10 mg/mL范围内与吸光度有良好的线性关系。
样品中多酚含量测定。取0.2 mL样品试液于10 mL容量瓶中,加入20%福林酚试剂1.0 mL,加5 mL蒸馏水,混匀;加入15% Na2CO3溶液2.0 mL,混匀,加水定容,摇匀。反应静置60 min后测定765 nm处吸光度值。按公式(2)计算橡实各极性组分中的总多酚含量。
(2)
Y:提取物中多酚的含量,mg/g;C:标准曲线查得的样品质量浓度,μg/mL;V:样品溶液测定时的体积,mL;n:样品稀释倍数;W:测定样品质量,g。
1.8 HPLC分析条件
Diamonsil-C18色谱柱(250 mm × 4.6 mm,5.0 μm);进样量10 μL;流速1 mL/min;柱温30 ℃;DAD检测波长:280 nm;流动相:B相为0.1%乙酸水溶液,A相为甲醇。梯度洗脱条件:0~10 min,86%B;10~42 min,86%B;42~56 min,60%B;56~70 min,50%B;70~80 min,30%B;80~85 min,86%B。
1.7 分子对接虚拟筛选
准备好靶点蛋白(α-淀粉酶和α-葡萄糖苷酶)、小分子(没食子酸、原儿茶酸、(+)-儿茶素、绿原酸、阿魏酸、鞣花酸)和AutoDockTools.1.5.6软件。靶点蛋白从PDB数据库(https://www.rcsb.org/)中搜索相应的靶点并选取蛋白保存为PDB格式,小分子从PubChem平台(https://www.ncbi.nlm.nih.gov/)查找,下载SDF格式。将小分子化合物运用Open Babel软件将SDF格式转化为PDB格式。运行AutoDockTools.1.5.6软件进行加氢、计算电荷等操作,并保存为PDBQT格式,导入Pymol软件进行分子对接。
1.8 数据处理
2 结果
2.1 不同极性组分对α-淀粉酶和α-葡萄糖苷酶活性的影响
橡实不同极性组分和阿卡波糖阳性对照组对α-淀粉酶和α-葡萄糖苷酶活性的影响结果见图1。

图1 不同极性组分对α-淀粉酶(A)和α-葡萄糖苷酶(B)活性的影响Fig.1 Effect of different polar components on the-amylase (A) and-glucosidase (B) activities
随着样品浓度的增加,粗提物、乙酸乙酯相、萃余水相、石油醚相对α-淀粉酶和α-葡萄糖苷酶活性抑制率不断增加。当乙酸乙酯相浓度大于4 mg/mL时,α-淀粉酶完全被抑制;当乙酸乙酯相浓度大于0.015 mg/mL时,α-葡萄糖苷酶的抑制作用趋于稳定。
通过曲线拟合后得出各极性组分对α-淀粉酶和α-葡萄糖苷酶的半数抑制浓度IC50值如表1所示。

表1 不同极性组分对α-淀粉酶和α-葡萄糖苷酶的IC50值Table 1 IC50 values of different polar components for α-amylase and α-glucosidase
各极性组分对α-淀粉酶和α-葡萄糖苷酶活性抑制强度依次为乙酸乙酯相>粗提物>阿卡波糖>萃余水相>石油醚相。与阿卡波糖相比,乙酸乙酯相和粗提物对α-淀粉酶和α-葡萄糖苷酶的抑制能力较强,说明橡实中的有效活性成分被富集在了乙酸乙酯相,且其具有较强的α-淀粉酶和α-葡萄糖苷酶酶活性抑制效果。
2.2 总酚含量测定结果
利用Folin-酚试剂比色法测得各极性组分总酚含量如表2所示。
结果显示,多酚类物质在乙酸乙酯相中具有较好的富集效果,且多酚含量与酶抑制活性成正比。可推测橡实提取物抑制α-淀粉酶和α-葡萄糖苷酶的活性成分很有可能是多酚类物质。
2.3 HPLC含量测定结果
6种标准品的HPLC色谱图见图2,回归方程见表3。依次建立HPLC方法测定各极性组分中的活性成分,测定结果见表4。乙酸乙酯相的HPLC结果和6种多酚类物质在各极性组分含量比较见图3。

表2 橡实不同极性萃取物的总酚含量Table 2 Total phenolic content in acorn with different polar extracts
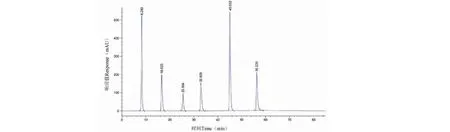
图2 混合标准溶液HPLC图Fig.2 HPLC map of mixed standard solution注:从左到右:没食子酸、原儿茶酸、(+)-儿茶素、绿原酸、阿魏酸、鞣花酸。Note:From left to right:gallic acid,procatechin acid,(+) -catechin,chlorogenic acid,ferulic acid,ellagic acid.

表3 6种酚类标准品的回归方程及线性范围Table 3 The regression equations and linear ranges of 6 phenolic standards
表4 各极性组分中6种多酚化合物的含量测定结果Table 4 Results of six polyphenolic compounds in each polar component
由以上数据可知,各极性组分中均含有这6种化合物,可能是由于液液萃取不彻底,导致6种化合物存在于各极性组分。另外,乙酸乙酯相中的活性成分含量最高,其对没食子酸、绿原酸和鞣花酸的富集效果最好,含量分别为10.61±0.58、12.84±2.74和500.75± 6.93 mg/g。鞣花酸在各极性组分中的含量最高,是粗提物的10.79倍、石油醚相的21.77倍、萃余水相的50.58倍。乙酸乙酯相中鞣花酸的响应值可达1 000 mAU以上,而其余各成分响应值均小于300 mAU。因此,可推测鞣花酸是乙酸乙酯相中的主要活性成分,且此HPLC方法能够很好地检测鞣花酸的含量。
2.4 分子对接虚拟筛选结果
根据上述实验测定结果可知,乙酸乙酯相中活性成分含量最高,且活性最好。因此,将“2.3”中发现的乙酸乙酯相富集效果最好的3种化合物作为对接对象,分别与α-淀粉酶和α-葡萄糖苷酶进行对接打分。结果发现鞣花酸具有最低结合能,且通过TCMSP数据库虚拟筛选发现只有鞣花酸满足口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18(见表5)。因此可以认为鞣花酸与α-淀粉酶和α-葡萄糖苷酶有较强的结合作用,是橡实中有效的活性成分。鞣花酸分别与α-淀粉酶和α-葡萄糖苷酶的对接结果图见图4。结果表明,鞣花酸与α-淀粉酶中的ARG-20、GLU-78、THR-114氨基酸残基形成氢键,与α-葡萄糖苷酶中的HIS-382、GLN-380、ALA-417、ASP-27氨基酸残基形成氢键,结合效果好,结构稳定。因此,进一步确定鞣花酸在橡实提取物活性研究中占有主导地位。
3 讨论与结论
目前,对植物提取物的药理活性研究主要集中在抑菌、抗氧化和抗肿瘤等方面。Ayele等[13]收集了6个不同地点的巴豆植物根,研究发现其提取物具有较强的抗氧化活性,其对肺炎葡萄球菌、大肠杆菌和肺炎克雷伯菌的抑制作用与阳性抗生素具有同等效力。Nakamura等[14]使用HPLC在芍药叶中鉴定出没食子酸甲酯、五没食子酰葡萄糖和芍药苷,发现其均具有抑制口腔鳞状癌细胞的增殖、凋亡和细胞周期,表明芍药叶提取物具有潜在的抗肿瘤作用。除此之外,植物提取物还具有降糖、降脂等功能。橡树最早在欧洲被人们研究,法国橡实提取物已被申请专利,作为一种特效药在市场流通[15]。但我国橡树鲜少受到人们的关注。已有的研究发现我国橡实提取物具有抑菌、抗氧化和抗肿瘤活性,但其对降糖作用的研究较少,降糖机制及降糖成分研究不够深入[16]。本研究发现橡实不同极性萃取物均对α-淀粉酶和α-葡萄糖苷酶有抑制作用,且乙酸乙酯相抑制效果远远高于阳性对照阿卡波糖组。其对α-淀粉酶和α-葡萄糖苷酶的IC50分别为1.590±0.073 mg/g、3.927±0.019(×10-3mg/g)。另外,研究获得橡实粗提物、乙酸乙酯相、石油醚相、萃余水相中总酚含量分别为402.13±11.79、753.23±32.18、121.62±3.20、252.44±4.00 mg/g,表明橡实乙酸乙酯相的酶抑制率与多酚含量成正比。这与Pan等[17]的研究结果一致。
在证实橡实乙酸乙酯相中多酚含量最高,且其对α-淀粉酶和α-葡萄糖苷酶的抑制效果最佳的基础上,本实验进一步检测橡实乙酸乙酯相多酚类单体物质,通过HPLC分析证明乙酸乙酯相中所测6种多酚化合物含量均高于其他极性组分,且乙酸乙酯相中的鞣花酸含量为500.75±6.93 mg/g,高于其他组分10~50倍,表明乙酸乙酯对鞣花酸具有较好的富集效果,橡实乙酸乙酯相中的主要活性成分依然是多酚类物质,推测其酶活性抑制与鞣花酸有关。这与Ding等的研究结果一致[18]。最后,本实验首次通过分子对接虚拟筛选,发现只有鞣花酸与α-淀粉酶和α-葡萄糖苷酶具有良好的结合活性,进一步验证鞣花酸对α-淀粉酶和α-葡萄糖苷酶具有较强的抑制作用。
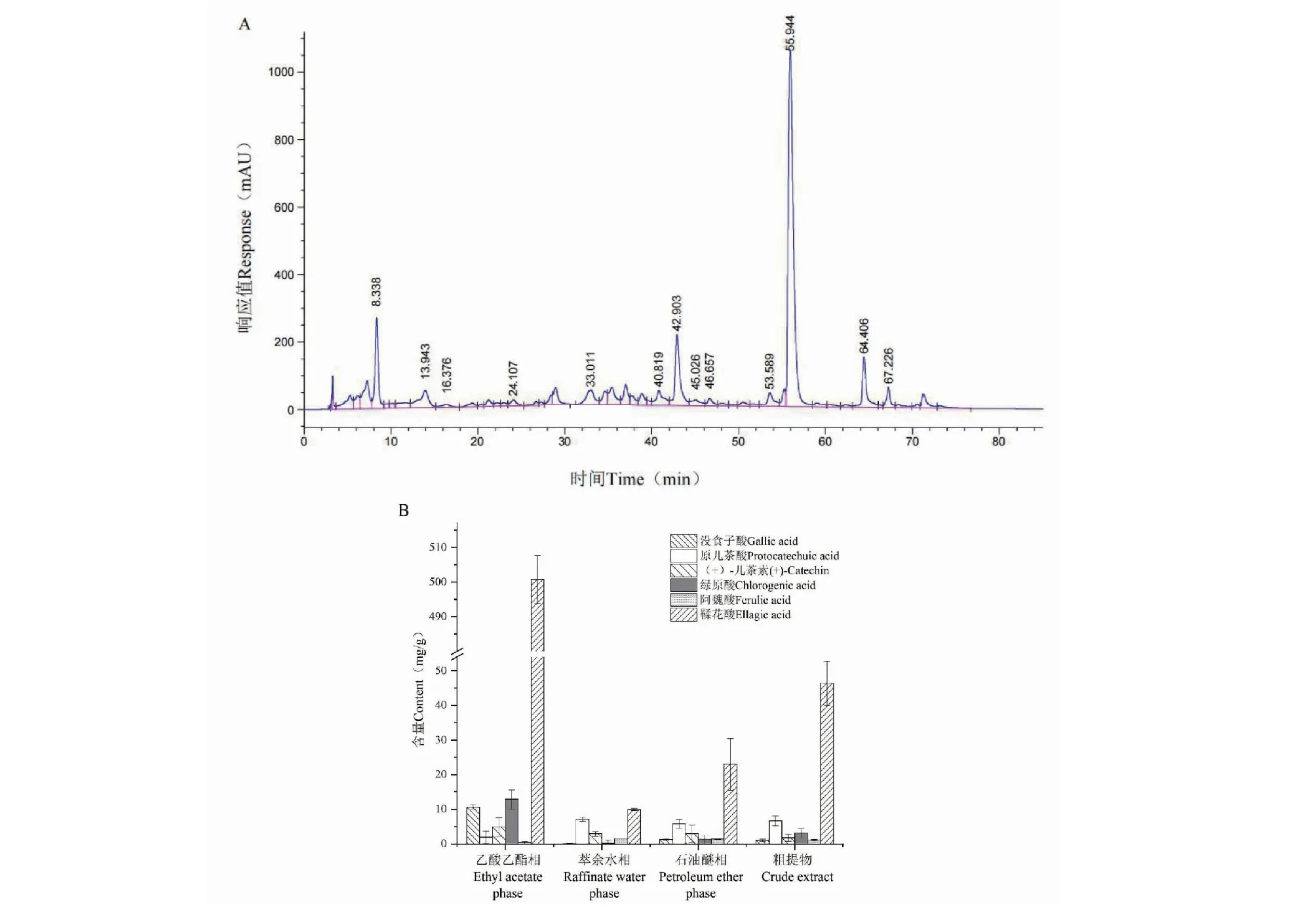
图3 橡实不同极性萃取物中6种多酚化合物的含量Fig.3 Contents of six polyphenolic compounds in different polar extracts of acorn注:A:乙酸乙酯相的色谱图;B:不同组分中6种多酚化合物的含量比较。Note:A:Chromatogram of ethyl acetate phase;B:Content comparison of six polyphenolic compounds in different components.
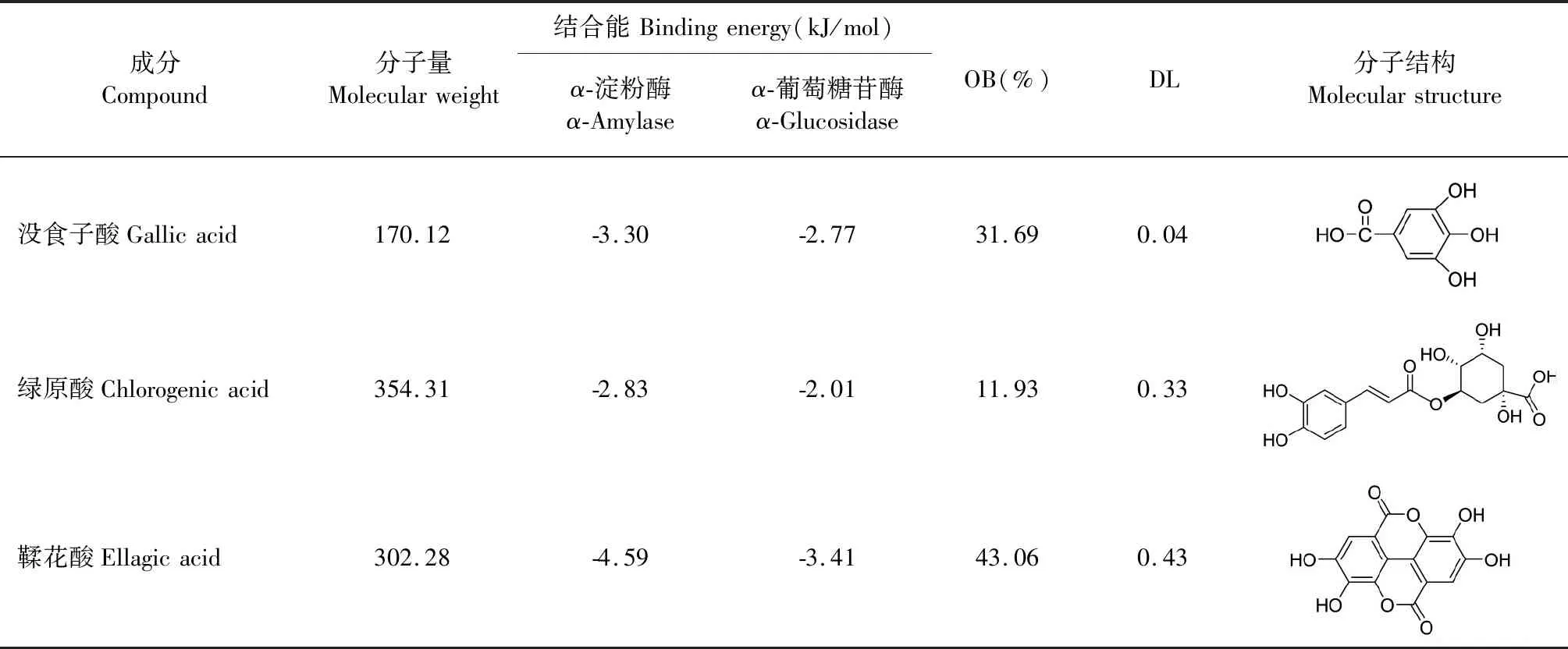
表5 橡实活性成分与α-淀粉酶和α-葡萄糖苷酶对接打分结果Table 5 Scoring results for docking of acorn active components with α-amylase and α-glucosidase

图4 鞣花酸与α-淀粉酶(A)和α-葡萄糖苷酶(B)对接结果Fig.4 Docking results of ellagoic acid with α-amylase (A) and α-glucosidase (B)
鞣花酸是一种具有生物活性的多酚化合物,存在于多种植物类群。在结构上,鞣花酸是六羟基联苯酸的二内酯,被认为是二聚没食子酸衍生物[19]。主要通过鞣花单宁水解产生,鞣花单宁是一种广泛分布的植物次生代谢物。鞣花酸因其具有抗氧化、抗炎、抑菌、抗肿瘤、降糖、降脂等生物活性而被广泛关注。目前,研究表明鞣花酸能够在小肠中吸收,未吸收分子被大肠微生物代谢形成尿石素。尿石素可被吸收到血液中并参与全身循环,最终随尿液排出,或尿石素在肠细胞和肝细胞中进行生物转化,形成尿石素代谢物[20]。因此,鞣花酸在医药领域具有重要的研究意义和开发前景。在降糖方面,植物提取物较合成降糖药物具有活性高、成本低、副作用少、节能环保等优点[21]。如本研究发现乙酸乙酯相对α-淀粉酶和α-葡萄糖苷酶的抑制效果远远大于阿卡波糖,与Alqahtani等[22]的研究一致。但也有人持相反观点,如Hbika等[23]研究表明苦艾乙酸乙酯提取物在大鼠体内对肠道α-葡萄糖苷酶没有抑制活性。这可能与不同植物种类和提取成分之间存在协同作用相关。不同活性物质之间具有未知的相互作用,这就需要我们不断研究,不断探索。目前,在不影响治疗效果的情况下减少合成药物对机体的副作用是治疗各种慢性病的挑战,探索阿卡波糖替代物或与阿卡波糖共同作用物是降糖药物研究的新方向。因此本研究有望为寻找合成药物的替代物或共作物奠定基础。
综上所述,橡实乙酸乙酯萃取相具有潜在的降糖作用。其鞣花酸含量丰富,由于鞣花酸含量可间接量化植物性食物中存在的鞣花单宁,因此本研究表明橡实材料可作为鞣花单宁的主要来源。另外,推测其降糖作用受鞣花酸含量影响,鞣花酸具有作为阿卡波糖替代物或共作物的潜力。

