RIN1表达上调对肾透明细胞癌诊断及预后的影响
刘 宇,王涌泉,李丹滨
(哈尔滨医科大学附属第一医院泌尿外科,黑龙江哈尔滨 150001)
肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是常见的泌尿生殖系统恶性肿瘤之一,全世界每年约有超过140 000人死于ccRCC[1]。ccRCC的发病率呈逐年上升趋势,因其对化疗药物不敏感,临床上常见的治疗方法主要为手术治疗及免疫治疗[2-4]。
Ras和Rab相互作用因子1(Ras and Rab interactor 1,RIN1)位于染色体11q13.2处,为Ras效应蛋白,且该基因的蛋白质产物与激活的H-Ras具有高亲和力和高度特异性[5]。最近的研究证明了RIN1在介导信号转导中具有重要作用。除了活化Ras蛋白外,还可激活Rab5、ABL酪氨酸激酶以及表皮生长因子受体(epithelial growth factor receptor,EGFR),从而调节信号转导和细胞迁移[6]。已有研究证实RIN1在多种肿瘤中异常表达并与肿瘤患者的预后相关,可能成为肿瘤诊断和治疗的标记物[7]。本文分析了RIN1的表达与ccRCC患者发生、发展的关系。此外,利用基因富集分析(gene set enrichment analysis,GSEA)从功能角度探讨了RIN1差异与ccRCC不良预后的潜在机制。
1 材料与方法
1.1 TCGA数据下载TCGA-KIRC数据从TCGA官方网站下载(https://cancergenome.nih.gov/),包括mRNA表达数据和临床资料。共获得72例正常肾脏组织和539例ccRCC组织,并整合ccRCC患者的临床数据,包括年龄、性别、生存状态、总生存期、分级、TNM分期、肿瘤大小、淋巴结状态和远处转移。
1.2 RIN1的蛋白表达分析UALCAN数据库(http://ualcan.path.uab.edu)整合了来自CPTAC数据库的蛋白表达数据[8],使用UALCAN数据库查询并分析RIN1蛋白在正常肾脏组织和ccRCC组织中的相对表达。人蛋白图谱数据库(https://www.proteinatlas.org/,HPA)包含正常肾脏组织和肿瘤组织的免疫组化信息[9],利用本数据库查询RIN1在正常肾脏组织和ccRCC组织的免疫组化染色结果。
1.3 GSEA分析为了研究RIN1在ccRCC中的潜在功能,根据RIN1表达中位数分为高低两组,针对两组的差异基因依据表达情况对基因进行排序,然后利用c2.cp.kegg.v7.1.symbols.gmt数据集对两组进行富集。每次分析的基因集排列数设为1 000,表型标记为RIN1的表达水平。P<0.05和FDRq<0.05的基因集被视为显著富集。
1.4 统计学分析所有统计分析均采用R软件(3.6.3)进行。采用非参数检验(Wilcoxon test)对正常肾脏组织和ccRCC组织进行差异表达分析。为了检验RIN1的表达与相关临床特征的关系,使用Mann-WhitneyU检验进行两组比较,采用Kruskal Wallis秩和检验和Bonferroni校正检验进行多组比较。用Kaplan-Meier生存分析和log-rank检验比较RIN1高表达组和低表达组的总体生存率。采用单因素和多因素Cox回归分析评价RIN1的表达在ccRCC中的独立预后价值。P<0.05为差异有统计学意义。
2 结 果
2.1 RIN1在ccRCC中表达上调并与ccRCC的发生、发展相关与72例正常肾脏组织相比,539例ccRCC组织中RIN1表达显著上调(P<0.001,图 1A)。其中在72例ccRCC配对样本组织中RIN1的表达也显著高于正常组织(P<0.001,图1B)。RIN1上调对ccRCC的诊断价值也通过受试者操作特征曲线(receiver operating characteristic curve,ROC)曲线得到证实,曲线下面积(area under curve,AUC)为0.916,P<0.001(图1C)。Kaplan-Meier曲线显示RIN1高表达的ccRCC患者的预后比RIN1低表达的ccRCC患者差(图1D)。
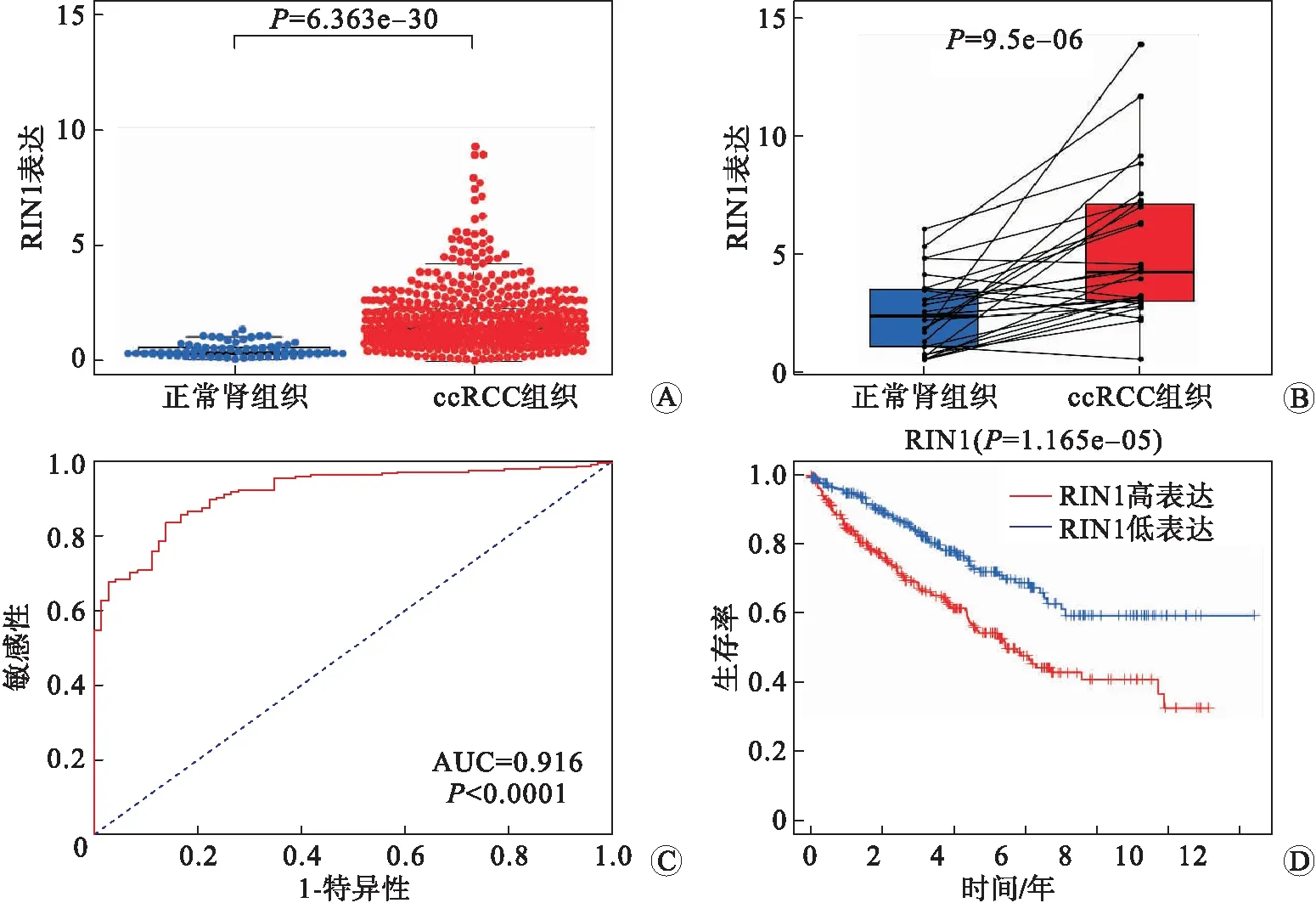
A: RIN1在ccRCC和正常肾脏组织的表达情况;B: 在72对配对组织中,ccRCC组织RIN1表达显著上调;C:RIN1上调对ccRCC诊断价值的ROC曲线;D:RIN1高表达与低表达的ccRCC患者预后的Kaplan-Meier曲线。
2.2 RIN1蛋白在ccRCC组织中表达上调分析UALCAN数据库显示ccRCC组织中RIN1蛋白表达显著高于正常组织(P<0.001,图 2A)。此外,从HPA数据库中检索免疫组化染色数据,研究RIN1在蛋白质水平上的表达,结果显示正常肾脏组织中肾小管细胞和肾小球细胞抗体染色程度均为低水平,而ccRCC组织中呈中等水平(图 2B)。由此进一步证实,在ccRCC组织中RIN1蛋白表达上调。
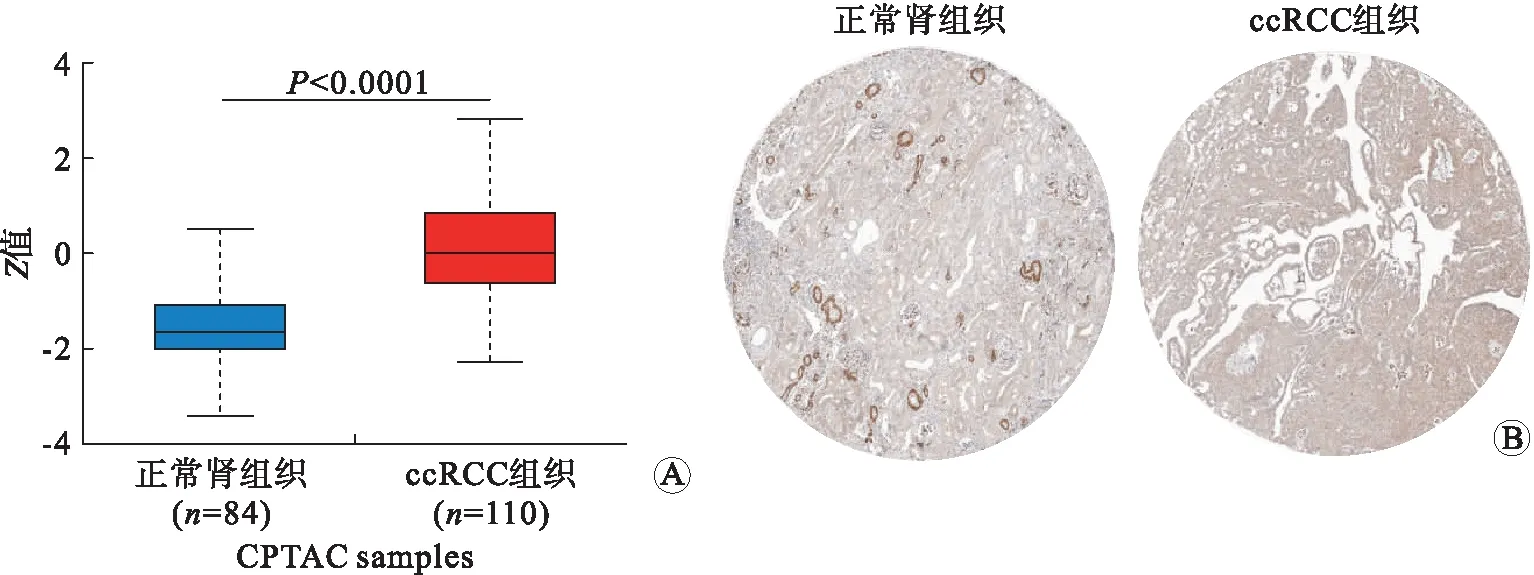
A:UALCAN数据库中RIN1蛋白的表达情况;B:HPA数据库中RIN1的免疫组化情况。
2.3 RIN1表达与ccRCC患者临床特征的关系对TCGA-KIRC的临床特征进行了整合并统计TNM分期、肿瘤大小、淋巴结状态和远处转移(表1)。对TCGA数据库的ccRCC患者进行了RIN1表达与临床特征相关性分析。如图3A~E所示,RIN1表达上调与临床分级(P<0.001)、TNM分期(P<0.001)、肿瘤大小(P<0.001)、淋巴结状态(P<0.001)和远处转移(P<0.001)显著相关。
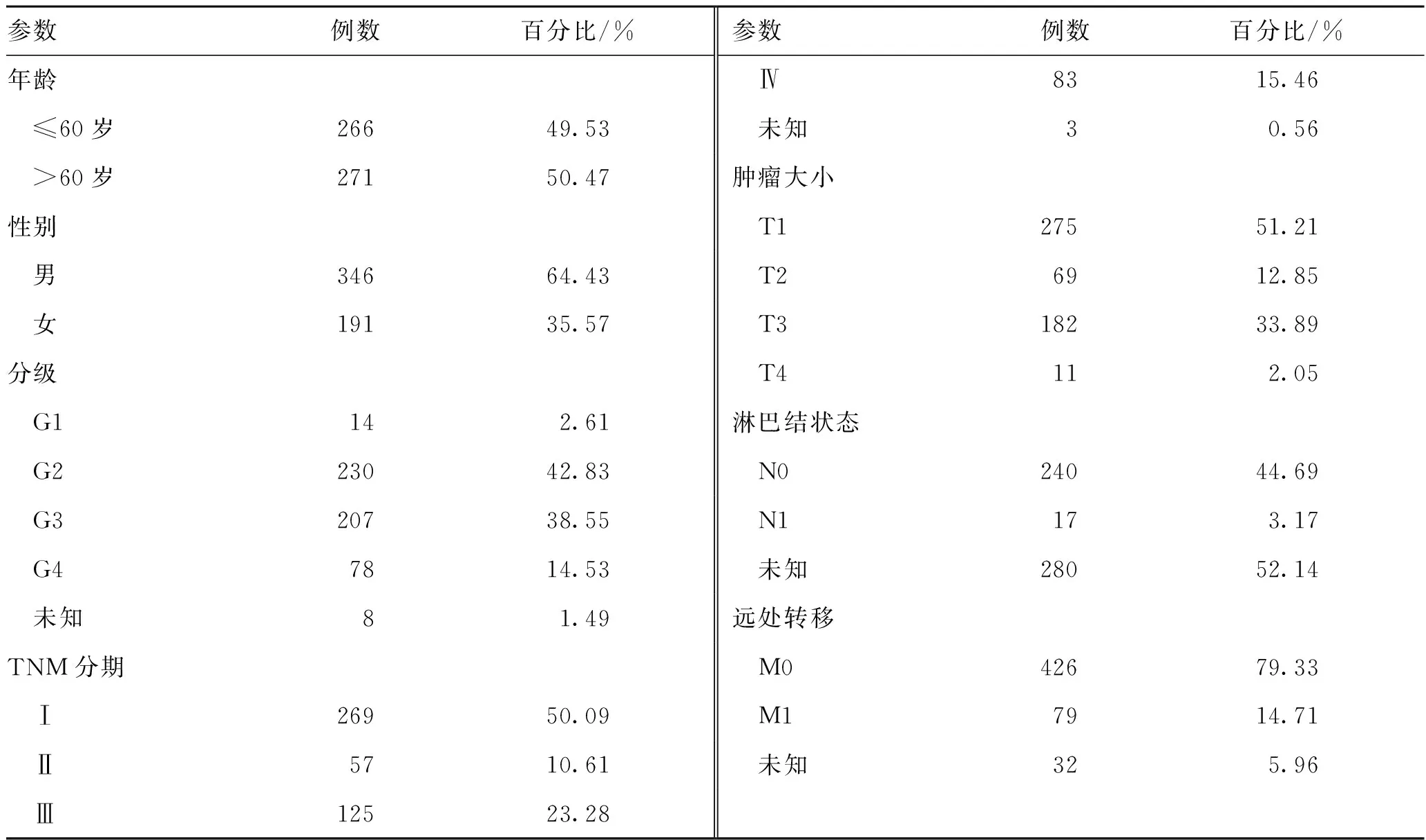
表1 来自TCGA中肾透明细胞肾癌患者的临床特征
2.4 RIN1表达是ccRCC患者的独立预后因子以RIN1表达中位数为准进行高、低表达分组,Kaplan-Meier生存分析表明,高表达RIN1的ccRCC患者总生存率较低表达RIN1的ccRCC患者差(P<0.001,图1D)。单因素Cox回归分析显示RIN1的表达上调及年龄、分级、TNM分期、肿瘤大小、淋巴结状态、远处转移等临床特征均与ccRCC预后不良密切相关。此外,多因素Cox回归分析显示RIN1表达上调、年龄与ccRCC预后不良独立密切相关(表2),因此RIN1可能作为ccRCC患者的独立预后标志物。
2.5 RIN1在影响ccRCC预后中的作用机制鉴于RIN1可能作为ccRCC的独立预后标志物,我们依据RIN1表达进行高低风险分组,组间差异分析获得差异基因,采用GSEA方法进行KEGG功能富集分析,结果显示高表达RIN1组主要富集并上调了DNA复制、细胞外基质受体相互作用、NOTCH信号通路和P53信号通路等相关途径(图4),这为揭示ccRCC患者预后不良的潜在机制提供了有效的研究途径。

A:分级;B:TNM分期;C: 肿瘤大小;D:淋巴结状态;E:远处转移。

表2 使用单因素及多因素Cox回归分析TCGA数据库中ccRCC患者总生存率相关的临床特征

图4 GSEA显示的KEGG通路富集图
3 讨 论
RIN1为蛋白质编码基因,作为Ras效应蛋白在不同水平影响Ras信号。首先,可通过与RAF1蛋白竞争结合激活的Ras。第二,通过增强来自ABL酪氨酸激酶1和酪氨酸激酶2的信号来调节细胞骨架重塑。第三,通过激活Rab5A,充当Rab5A的鸟嘌呤核苷酸交换因子,将结合的GDP交换为游离的GTP,并促进Ras激活受体胞吞作用[10]。研究表明,RIN1可与Rab25(关键GTP酶)相互作用,激活ccRCC中的EGFR信号传导,从而促进肿瘤的生长和转移[11]。本研究发现RIN1的mRNA水平在ccRCC中表达显著上调,且UALCAN和HPA在线数据库验证RIN1在蛋白水平的表达方面也显著上调。RIN1的表达上调与肿瘤分级、TNM分期、肿瘤大小、淋巴结状态、远处转移以及总生存率均显著相关。单因素和多因素回归分析也验证了其可作为ccRCC患者的独立预后因素。本研究利用高通量、多组学数据,探讨研究了RIN1在ccRCC组织中的表达和预后关系,经生物信息学精准分析表明RIN1可以作为ccRCC新的诊断、预后标记物。
最后利用GSEA分析,预测RIN1与ccRCC发生、发展及预后中起重要作用的途径。结果表明RIN1参与了多种与肿瘤进展相关的途径,如DNA复制、细胞外基质受体相互作用、NOTCH信号通路和P53信号通路。已有研究证实以上信号通路与ccRCC的生物学行为密切相关,特别是NOTCH信号通路在ccRCC中广泛激活,并介导肿瘤细胞的恶性增殖,抑制NOTCH信号通路激活可能成为ccRCC的治疗靶点[12]。DNA复制、细胞外基质受体相互作用和P53信号通路也与ccRCC的发生、增殖与转移密切相关[13-14],但RIN1是如何通过以上信号通路影响ccRCC的生物学行为需要深入研究。
综上所述,我们发现RIN1在ccRCC中表达上调与临床特征密切相关,并能够独立预测预后不良,这表明RIN1有望成为ccRCC的诊断标志物和潜在的治疗靶点。然而,具体的机制研究有待进一步开展。