CDH13基因在肾透明细胞癌中的高表达及其临床意义
邵 渊,吴 波,张 琳,陈勇全,王东文,3
(1.山西医科大学第一临床医学院,山西太原 030001;2.山西医科大学第一医院泌尿外科,山西太原 030001;3.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院肿瘤医院深圳医院泌尿外科,广东深圳 518116)
肾细胞癌(renal cell carcinoma, RCC)是泌尿系统常见的恶性肿瘤之一[1-2]。其中,肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是RCC的主要病理类型[3]。近年来,我国肾癌的发病率逐年上升[2,4]。由于肾癌侵袭性强且对放化疗不敏感,手术治疗仍是局限性肾癌及局部进展性肾癌的主要治疗方法,但高达20%~30%的患者术后会出现肿瘤的复发及转移,预后较差[5-6]。因此,为了改善肾癌患者的预后,迫切需要探索肾癌的发病机制,并寻找可用于肾细胞癌诊断、治疗和预后的潜在分子标志物与治疗靶点。
CDH13是钙离子依赖性钙黏蛋白家族的特殊成员[7-8]。先前的研究证明,CDH13编码的蛋白质完整分布在细胞表面,这种特殊的结构与分布提示CDH13可能参与细胞信号通路的调节,进而发挥重要作用[9-11]。随着研究的不断深入,目前的研究证实CDH13的异常表达与多种恶性肿瘤的发生发展、患者临床病理参数以及预后密切相关[12-18]。然而,CDH13基因在ccRCC中的表达水平及预后价值尚未阐明。因此,本研究利用生物信息学方法全面分析并研究CDH13基因在ccRCC中的表达水平及预后价值。同时基于临床标本验证生物信息学分析结果,以期全面且深入探讨该基因在ccRCC中潜在的临床价值及分子机制。
1 资料与方法
1.1 基于TCGA和GEO数据库分析CDH13基因的mRNA表达水平基于TCGA数据库中的533个ccRCC组织和72个正常肾组织的基因表达谱数据分析CDH13基因在ccRCC组织和正常肾组织中的mRNA表达水平。此外,基于GEO数据库中72对和101对ccRCC及其癌旁组织的基因表达数据(GSE53757和GSE40435)进一步验证来自TCGA数据库的分析结果。
1.2 基于CPTAC和HPA数据库分析CDH13基因的蛋白质表达水平利用CPTAC数据库[19](https://proteomics.cancer.gov/programs/cptac)获得并分析CDH13基因的蛋白质表达水平;利用HPA数据库[20](http://www.proteinatlas.org)提取并分析CDH13基因蛋白质表达的免疫组化图像。此外,基于AlphaFold数据库(https://alphafold.ebi.ac.uk/)预测CDH13基因编码蛋白的3D结构。
1.3 基于UALCAN和CPTAC数据库分析CDH13基因的表达与ccRCC患者临床病理特征的关系UALCAN数据库[21](http://ualcan.path.uab.edu)用于获得并分析CDH13基因在不同临床分期、病理分级等临床病理特征中的mRNA表达情况。此外,基于CPTAC数据库获得并分析CDH13基因在不同肿瘤分期、病理分级中的蛋白质表达水平。
1.4 基于TCGA数据库分析评估CDH13基因的预后价值Kaplan-Meier生存曲线和Log-Rank检验用以评估CDH13基因在患者中的预后价值。主要终点为总体生存率(overall survival, OS)和无进展生存率(progression free survival, PFS)。使用风险比(hazard ratio, HR)和95%置信区间(confidence interval, CI)作为效应量。此外,进行单因素和多因素Cox回归分析,以进一步评估和确定ccRCC患者OS和PFS的独立预测因素。
1.5 基于cBioPortal数据库分析CDH13的基因组变异情况cBioPortal数据库[22](http://www.cbioportal.org)用于分析并研究CDH13的基因组变异情况。此外,基于该数据库分析CDH13基因组变异对ccRCC患者预后的影响。
1.6 基于TCGA和Metascape数据库分析CDH13基因的相关基因及通路富集基于TCGA数据库分析CDH13相关基因,并基于Metascape数据库[23](http://metascape.org)进行通路富集分析。
1.7 基于临床样本分析CDH13基因的表达水平
1.7.1纳入排除标准及患者临床资料 纳入标准:2021年1月-2021年6月于山西医科大学第一医院泌尿外科行根治性肾切除术并经术后病理学检查确诊为ccRCC的患者。排除标准:术前接受过化疗、放疗或分子靶向治疗等抗肿瘤治疗;未签署知情同意书;无完整临床及病理资料。最终共有40对ccRCC组织及癌旁组织标本纳入本次研究。所选取标本的患者年龄为49~83岁,男性26例,女性14例;左肾肿瘤16例,右肾肿瘤24例;AJCC分期:Ⅰ+Ⅱ期26例、Ⅲ+Ⅳ期14例;WHO/ISUP分级:Ⅰ+Ⅱ级28例、Ⅲ+Ⅳ级12例。
1.7.2实时荧光定量聚合酶链式反应(quantitativereal-timepolymerasechainreaction,qRT-PCR) 利用Trizol法提取临床标本中总RNA并反转录成cDNA。以cDNA为模板,使用实时荧光定量试剂(AQ601,TransGen Biotech,China)及实时荧光定量PCR仪进行qRT-PCR并检测。
引物序列:CDH13正向引物5’-TGTCCCAAGACAAAAGAGGTCC-3’,反向5’-ACTATCGACTACCTTGCCAACAT-3’。GAPDH正向引物5’-GTCCACCACCCTGTTGCTGTA-3’,反向5’-ACCCACTCCTCCACCTTTGA-3’。每组实验重复3次,使用GAPDH作为内参。
1.7.3蛋白质免疫印迹(Westernblot) 临床标本使用RIPA裂解液进行裂解,使用BCA试剂盒获取蛋白质并定量。使用SDS-PAGE凝胶分离蛋白质并转移至PVDF膜上。将转有目的蛋白的PVDF膜封闭2 h后与抗CDH13抗体(ab167407,Abcam,1∶1 000)和抗GAPDH抗体(ab181602,Abcam,1∶1 000)在4 ℃条件下孵育过夜。TBST溶液洗膜3次后将膜移至二抗孵育液中室温孵育2 h。再次洗涤后,使用化学发光系统检测信号并进行分析。每组实验重复3次,以GAPDH为内参。
1.7.4免疫组织化学染色法 临床收集的ccRCC组织和癌旁组织经历石蜡包埋、组织切片、脱蜡、水化、抗原修复和阻断内源性过氧化物酶后,使用抗CDH13抗体(A1761,Abclonal Technology,1∶100)和二抗对组织进行免疫组织化学染色,随后将组织切片用二氨基联苯胺(diaminobenzidine,DAB)显色并用苏木精复染以检测CDH13基因的蛋白表达。
1.8 统计学方法采用SPSS 26.0和R 3.6.1进行统计分析。t检验用于分析比较ccRCC组织与癌旁组织间CDH13基因的表达差异。单因素方差分析、Wilcoxon秩和检验用于分析患者临床病理特征与CDH13基因表达的关系。以P<0.05为差异有统计学意义。
2 结 果
2.1 CDH13基因在ccRCC组织和正常组织中mRNA的表达水平基于TCGA的分析结果显示,ccRCC组织中CDH13基因的mRNA表达水平显著高于正常组织(P<0.05,图1A、B)。此外,基于GEO数据库的分析结果与TCGA数据库一致,进一步验证了CDH13基因在ccRCC中mRNA的高表达水平(图1C、D)。

A:TCGA数据库(TCGA-KIRC);B:TCGA数据库中配对样本;C、D:GEO数据库(GSE53757和GSE40435)。
2.2 CDH13基因在ccRCC组织和正常组织中蛋白质的表达水平CPTAC数据库分析结果显示,与正常组织相比,ccRCC组织中基因CDH13的蛋白质表达水平较高(P<0.05,图2A)。基于HPA数据库的免疫组化图像显示,CDH13基因编码的蛋白在ccRCC组织中观察到较高水平的表达(图2C、D)。这提示CDH13基因的蛋白表达水平和mRNA表达水平在ccRCC中保持一致。图2B展示了AlphaFold数据库预测的CDH13编码蛋白的3D结构。

A:基于CPTAC数据库的ccRCC组织和正常组织中的CDH13基因蛋白质表达水平(***P<0.001);B:基于AlphaFold数据库预测的T-Cadherin 3D结构;C、D:基于HPA数据库的ccRCC组织和正常组织中的CDH13基因表达的免疫组织化学染色图像。
2.3 CDH13基因的表达与ccRCC患者临床病理特征的关系分析结果显示,CDH13的表达与ccRCC患者的肿瘤分期、病理分级显著相关(图3)。在肿瘤组织中CDH13的表达高于正常组织,并且CDH13的表达随着肿瘤分期、病理分级增高有表达降低的趋势,肿瘤分期4期、病理分级4级的ccRCC患者CDH13基因的表达水平较低。

A、B:CDH13 基因mRNA表达水平(A)与ccRCC患者肿瘤分期和病理分级的关系(B);C、D:CDH13 基因在不同肿瘤分期中蛋白质表达水平(C)与ccRCC患者肿瘤分期和病理分级的关系(D)。
2.4 CDH13基因的表达在ccRCC患者中的预后价值生存分析结果显示,CDH13基因的表达与ccRCC患者的OS、PFS相关。CDH13基因高表达的患者预后较好,而低表达的患者生存时间显著降低,预后较差(P< 0.05,图4)。此外,单因素及多因素Cox回归分析结果显示CDH13的表达水平是ccRCC患者OS及PFS的独立预测因子(表1、2)。

A:总体生存率(OS);B:无进展生存率(PFS)。

表1 ccRCC患者总体生存率影响因素的单因素及多因素Cox回归分析(TCGA数据库)

表2 ccRCC患者无进展生存率影响因素的单因素及多因素Cox回归分析(TCGA数据库)
2.5 CDH13基因在ccRCC中的基因组变异水平cBioPortal数据库分析结果显示,CDH13基因在512例ccRCC患者中基因组变异率为4%。其中,高mRNA突变占比最高,为2.54%,深度缺失为0.78%,扩增为0.39%。生存分析结果显示,CDH13基因组变异与ccRCC患者的总体生存率(P<0.05,图5A)和癌症特异性生存率显著相关(P<0.05,图5B)。
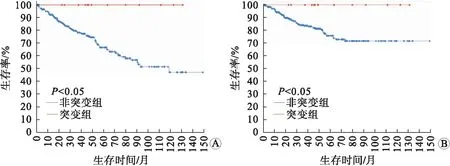
A:总体生存率;B:癌症特异性生存分析。
2.6 CDH13基因的相关基因及通路富集分析相关性分析结果显示,与CDH13相关性最强的前5个基因分别为CDH5、CXORF36、CD34、S1PR1和ELTD1。基于Metascape数据库的富集分析结果显示CDH13及其相关基因主要涉及的通路包括血管发育、内皮发育、细胞迁移及细胞粘附等生物过程。
2.7 临床样本中CDH13基因的表达水平本研究进一步在临床样本中验证了CDH13基因的表达水平。qRT-PCR结果显示,与癌旁组织相比,ccRCC组织中的CDH13基因mRNA 表达显著升高(图6A)。同样,Western blot结果也表明CDH13基因在ccRCC组织中的蛋白质表达水平高于癌旁组织(图6B)。此外,免疫组织化学染色结果显示,与ccRCC组织相比,CDH13基因在癌旁肾组织中的表达水平显著降低(图6C)。与高级别的ccRCC组织相比,低级别ccRCC组织中CDH13的表达水平显著升高(图6C)。

A:CDH13基因在ccRCC组织和癌旁组织中的mRNA表达水平;B:CDH13基因在ccRCC组织和癌旁组织中的蛋白质表达水平;C:CDH13基因在ccRCC组织和癌旁组织中的免疫组织化学染色图像(左图为×100,右图为×400)。
3 讨 论
CDH13是钙黏蛋白家族的非典型成员,在维持细胞结构、调节细胞生长、血管生成以及细胞间信号传导等众多方面发挥着重要作用[9-11]。已有研究证实,CDH13基因在多种恶性肿瘤中表达异常,并且与肿瘤患者的临床病理特征及预后密切相关。LIN等[24]利用免疫组织化学染色的方法检测113例膀胱癌标本和37例正常组织标本中CDH13的表达。结果显示膀胱癌组织中CDH13表达水平低于正常组织,并且与膀胱肿瘤的分期、分级以及肿瘤复发等临床病理因素密切相关,可作为膀胱癌恶性程度的潜在预测标志物。此外,WANG等[25]研究发现CDH13在口腔鳞癌组织中的表达水平显著低于正常组织,并且与患者的临床病理因素及预后显著相关。进一步的机制研究显示CDH13基因可能通过PI3K/AKT/mTOR信号通路影响细胞的增殖。在胰腺癌的研究中发现,CDH13基因在胰腺癌组织及细胞系中显著下调。进一步的深入研究表明CDH13基因的过表达抑制了Wnt/β-catenin信号通路的激活,通过参与调节上皮-间充质转化从而抑制胰腺癌细胞的增殖、迁移和侵袭的能力[9]。
随着研究的深入,不断有研究报道CDH13基因与血管生成密切相关。在一项体外研究中,WANG等[12]报道CDH13启动子区域的甲基化可以恢复肿瘤的血管生成、侵袭和迁移能力。此外,使用组蛋白去乙酰化酶抑制剂或去甲基化制剂处理癌细胞系可以重新激活CDH13的表达并导致肿瘤转移。其原因可能与内皮细胞中CDH13的过表达刺激内皮细胞的迁移,并在病理条件下通过血管内皮生长因子刺激血管生成有关[26]。在体内研究中,HEBBARD等[27]学者在小鼠癌症模型中发现CDH13基因促进肿瘤血管生成,T-Cadherin的缺乏通过限制肿瘤的血管生成从而减少肿瘤的生长。总而言之,CDH13基因可以通过多种通路及途径在肿瘤的发生发展过程中发挥着重要作用。然而,CDH13在ccRCC中的作用与价值仍有待阐明。因此,本研究全面且深入探讨了CDH13基因在ccRCC中的表达水平、预后价值、基因组变异和功能富集分析。
本研究发现ccRCC组织中CDH13的mRNA和蛋白质表达水平均显著高于正常肾组织。但CDH13的表达随着ccRCC患者肿瘤分期和病理分级的升高而逐渐降低,提示该基因在ccRCC中表达的特异性。肿瘤病理分级极其复杂,随着肿瘤恶性程度以及临床分期病理分级的增高,肿瘤异质性也更加凸显,其肿瘤组织和肿瘤内环境可以发生巨大的变化。对于同一类肿瘤在同一病理分期分级下也可能存在不同的分子亚型。在ccRCC进展的不同阶段,其内在的基因变化极其复杂,尚未有研究深入挖掘CDH13基因在ccRCC中表达的特异性与异质性。因此,仍需要更多的研究全面探讨CDH13基因在ccRCC发生发展中的分子机制。此外,在此基础上,本研究生存分析结果显示CDH13基因和ccRCC患者的OS及PFS显著相关,并且该基因的低表达是预后不良的独立危险因素。因此,CDH13与肿瘤分期、病理分级、淋巴结转移等预后指标相结合将有助于更加精确地预测ccRCC患者的临床结局。另一方面,cBioPortal数据库结果显示在ccRCC患者中存在一定水平的CDH13基因组变异发生率,并且与野生型CDH13相比基因突变的患者预后明显较好。这项研究结果提示ccRCC患者的生存率不仅受到CDH13表达水平的影响,还与其基因组是否变异有关。此外,本研究对CDH13及相关基因进行通路富集分析深入挖掘其潜在的作用机制,这些通路和生物过程均和肿瘤的发生、发展密切相关,也提示CDH13基因可能通过这些通路调控ccRCC的进展。最后,基于临床样本同样证实CDH13在ccRCC组织中表达明显高于癌旁组织。总之,以上研究结果提示CDH13基因可能在ccRCC发生和发展过程中也发挥着重要作用,并且有望成为肾透明细胞癌的预后标志物以及治疗靶点。
尽管如此,本项研究也存在如下局限性。首先,本研究未能深入探索CDH13基因参与ccRCC的确切分子机制,仍需相关研究进一步阐明。其次,本研究仅为回顾性研究,仍需更多前瞻性、大样本的研究结果相互支持。
综上所述,本研究证明CDH13基因在ccRCC组织中呈现高表达,并且该基因的高水平表达与ccRCC患者的临床病理特征及预后良好显著相关。这些新的发现不仅揭示了ccRCC中潜在的分子变化,也为该领域的进一步研究奠定了基础。