施加硒肥条件下的印度梨形孢接种对香榧幼苗根系发育、气体交换及其叶片硒累积的影响
李爱华,许秀环,李金柱,蒲 尧,吴 楚*
施加硒肥条件下的印度梨形孢接种对香榧幼苗根系发育、气体交换及其叶片硒累积的影响
李爱华1,许秀环1,李金柱1,蒲 尧2,吴 楚2*
(1. 湖北省林业科学研究院,武汉 430075;2. 长江大学园艺园林学院,荆州 434025)
近些年来香榧果实在干果市场非常受到人们的喜爱,如何提高其果实产量,促进其果实品质尤其微量元素的强化是当前香榧栽培上需要解决的问题。微量元素硒是硒蛋白必需的元素,它与多种人体疾病有关。采用盆栽的方式,施加矿物硒粉,并对香榧幼苗接种根内生真菌印度梨形孢。结果表明,印度梨形孢可以侵染香榧幼苗的根系(侵染率为22.34%),并使其总根长、总根表面积和总根体积以及二级根上一级根的数量,分别增加12.69%、16.26%、20.81%和10.93%,但对其特定根长和根组织密度没有显著影响。香榧幼苗接种印度梨形孢可显著提高净光合速率、气孔导度、胞间二氧化碳浓度以及蒸腾速率,分别增加92.92%、6.16倍、47.67%和2.36倍,同时显著提高光能利用效率(88.62%)而降低水分利用效率(84.28%)。接种显著地促进了香榧幼苗总生物量的累积(36.94%)以及叶片总硒含量(1.68倍)。基于印度梨形孢可促进植物营养吸收的特性,该根内生真菌可以用香榧硒的生物强化,以提高香榧果实的品质。
硒;香榧;印度梨形孢;生物强化
硒(Se)是维持人体健康的重要微量元素,因为它是一些重要蛋白(即硒蛋白)的组成成分,如谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX1)、碘化甲腺氨酸脱碘酶1 (iodothyronine deiodinase 1)、硫氧还原蛋白还原酶(thioredoxin reductase),这些含有硒元素的蛋白统称为硒蛋白。在人体中,硒蛋白具有多种功能[1]。因此,硒的摄入不足将引起多种人体疾病。在我国,最著名的硒摄入不足引起的疾病就是克山病。克山病的发生与GPX1的活性较低有关[2],另一种与硒摄入不足有关的疾病是卡斯钦-贝克病(Kaschin–Beck disease)[3-4]。在我国,卡斯钦-贝克病的地理分布与硒摄入不足的分布带密切吻合,该分布带包括西藏、青海以及四川一部分[5]。硒的摄入不足还与其他人体疾病有关,如癌症[6-7]、关节炎[8]、肌肉疾病[9]和心血管病[10]。因此,硒的充足摄入和实行食品的硒强化对于维持人体健康至关重要[11]。
硒的生物强化可通过在食品原料生产过程中硒的富集而实现,如土壤中施加硒肥和叶面喷施硒肥。通过这些方式,可以生产出富硒的谷物[12]、水果[13- 14]、蔬菜[15-16]、茶叶[17-18]以及蘑菇[19-20]。坚果为人们常食用的休闲食品,也可以作为烘焙食品的原料,通过坚果的硒生物强化无疑可以增加硒的摄入量。然而,目前人们对坚果的硒生物强化研究得很少,仅对巴西坚果()内的硒分布进行过分析[21]。近些年来,香榧()果实作为休闲食品在我国越来越受到人们的青睐,对新品种选育及其产量研究尤受重视[22-24],其果实的硒生物强化可以提高其品质,然而,人们对此尚未予以特别的关注。
有益微生物,如丛枝菌根真菌、根内生真菌、深色有隔真菌等,与植物根系共生,可以为植物提供多种利益,如促进营养吸收与生长、提高抗逆性、促进次生代谢物的合成。其促进植物营养吸收的特性正好可以用来加强植物对硒的吸收,以实现硒的生物强化[25]。印度梨形孢()为一种根内生真菌,可以实现非活体营养繁殖[26]。它能与很多植物共生,可加强植物对营养吸收,促进植物生长[26-28]。通过促进基因的表达而增加拟南芥的冰冻耐性及其融化后的恢复[29]。拟南芥接种印度梨形孢后,其开花会提前,这主要是通过调节其光周期和赤霉素的生物合成途径而实现的[30]。此外,印度梨形孢可以提高宿主的抗旱能力[31]与耐盐性[32],减少砷从西红柿的根部向果实转移[33]。印度梨形孢与小麦共生可以增强对其病原菌的抗性[34]。为了充分利用印度梨形孢的这些特性来加强香榧对硒的富集,本研究对其共生的效果及其在香榧叶片硒富集的促进作用进行研究,以期印度梨形孢可在香榧果实的生产上得以应用。
1 材料与方法
1.1 供试材料
年龄为7个月的香榧(cv. “Merrillii”)小苗从湖北林宝香榧产业开发股份有限公司(湖北省通山县)获得,栽植于自制的有机玻璃盒(30 cm× 20 cm× 10 cm),栽培基质为园艺育苗基质(每盒2 kg)。栽培基质事先在高压灭菌锅中进行灭菌(20 min)。每个有机玻璃盒栽植3棵幼苗,共计60盆。然后将幼苗在温室中培养(25 ℃,相对湿度85%,光照为自然光)。根据栽培基质的水分含量进行水分管理。待小苗移栽成活后(15 d),在每个有机玻璃盒的中央施加硒矿粉5 g(购自湖北硒金农业科技有限公司,其硒含量为0.13%,其粒度为800目)。一周后,在30个有机玻璃盒中各施入10 mL印度梨形孢(, 以下简称为Piin)菌丝悬浮液(10 g·L-1)。该菌种由德国耶拿大学R. Oelmuller教授提供,接种后的管理同上。
1.2 印度梨形孢侵染检测
根据以往对印度梨形孢侵染植物根系进程的观察,在印度梨形孢接种后18 d即可侵染根系。在本研究中,我们在印度梨形孢菌丝悬浮液施入20 d,随机取5株香榧小苗的根系进行印度梨形孢侵染检测,按照Vahabi等[35]的方法采用台酚蓝(trypan blue, 0.01 mg·mL-1)进行。
1.3 气体交换的测定
在植株收获之前进行气体交换测定。在每种处理随机选取5盆材料,选取植株相同部位的健康叶片进行气体交换参数的测量。采用Li-6400便携式光合光合仪(Li-Cor公司,USA),选择在晴朗而阳光充足的上午9: 00—12: 00开始测定。测定前1 h,将植株置于在阳光下使其叶片充分活化。测定的光源采用Li-6400-02B 红蓝光光源(PPFD设置为 1 200 μmol∙m-2∙s-1),测定指标主要包括净光合速率(n)、蒸腾速率(r)、气孔导度(Cond)以及胞间二氧化碳浓度(i)等相关参数。每组处理各记录40组数据。光能利用效率计算为n/PPFD,水分利用效率计算为n/r。
1.4 植物收获与生物量测定
在印度梨形孢悬浮液接种10个月后,将香榧幼苗从容器中取出来,其根系用自来水清洗干净后拿回实验室。每组处理随机取3株,其叶片用于测定叶绿素含量,剩余的植株用于测定生物量。测定生物量前,植株在60 ℃下烘干24 h,然后每株分成根、茎、叶3个部分,再采用分析天平称重。
1.5 香榧幼苗根系的扫描
将各组所有洗净的香榧幼苗根系采用WinRhizo根系扫描系统(Regent Instruments公司,加拿大魁北克)进行扫描以获得总根系长度、总根系表面积、总根系体积等参数。
1.6 二级根上的一级根数量及其特定根长与根组 织密度分析
按照Pregitzer 等[36]的方法对根系进行分级,从每组处理中随机取15根二级根。然后采用WinRhizo根系扫描系统进行根系扫描,以获得其根长和体积。对二级根上一级根的数量直接点数。之后在60 ℃下烘干24 h,再称重。特定根长(specific root length)=根系长度/根重;根组织密度(root tissue density)= 根重/根体积。
1.7 叶绿素含量测定
叶绿素的含量和类胡萝卜素含量采用乙醇法测定[37]。
1.8 硒含量测定
采用上述烘干后的香榧叶片测定硒含量。将干样用高速电动粉碎机粉碎后备用,用于后期测定总硒(食品安全国家标准,GB 5009.93—2017)和有机硒的含量,有机硒的含量测定采用的方法是氢化物原子荧光光谱法(DB36/T 1243—2020)[38],采用的仪器为原子荧光光谱仪,产自中国北京吉田仪器公司,型号为AFS-8220。
1.9 数据处理与统计分析
所有获得的数据采用SPSS软件(v. 21)分析处理。所有数据经过ANOVA分析,其统计分析结果表达为mean ± SE。为了判断两个处理之间各个参数的差异是否显著,用LSD进行检验(< 0.05)。
2 结果与分析
2.1 印度梨形孢在香榧根系中的定殖
从图1中可以看出,印度梨形孢的孢子出现在根系皮层组织中,表明印度梨形孢可以侵染香榧的根系。其侵染率为22.34%。
2.2 在施加硒矿粉条件下印度梨形孢侵染对香榧幼苗根系的影响
在施加硒矿粉条件下,印度梨形孢在香榧幼苗根系的定殖对其根系的发育产生了一定影响(图2 和表1)。印度梨形孢在香榧幼苗根系的定殖增加了幼苗根系的总根长度、总根表面积和总根体积,分别增加12.69%、16.26%和20.81%,但增加的幅度并不显著(表1,> 0.05)。同时,其定殖使香榧幼苗根系的特定根长和根组织密度分别减少2.55%和0.22%,而使二级根上的一级根的数量增加10.93%,但减少和增加均不显著(表1,> 0.05)。
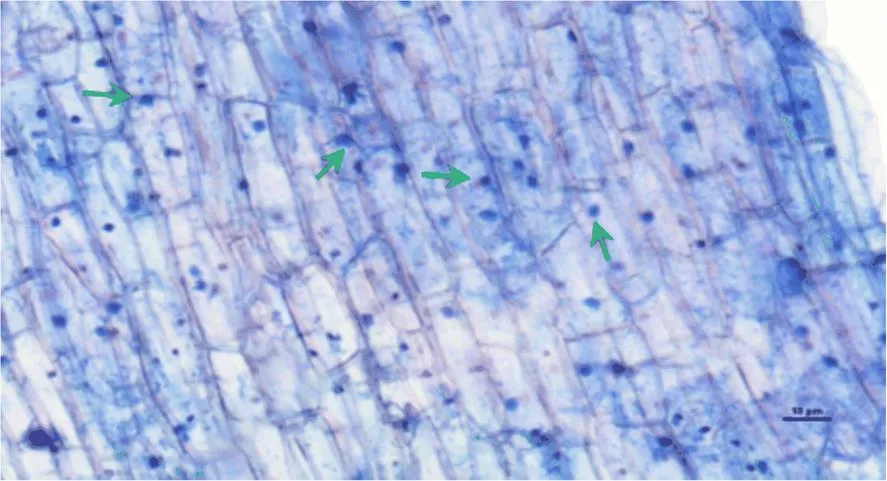
箭头所指为印度梨形孢的孢子(Bar =10 μm)。
Figure 1 Infection ofin the roots of

A. 印度梨形孢接种的根系;B. 无印度梨形孢接种的根系。图片来自WinRhizo根系扫描仪,并使用Image Pro Plus (v. 6.0)处理。
Figure 2 Effect ofinoculation on root systems ofseedlings supplied with selenium fertilizer
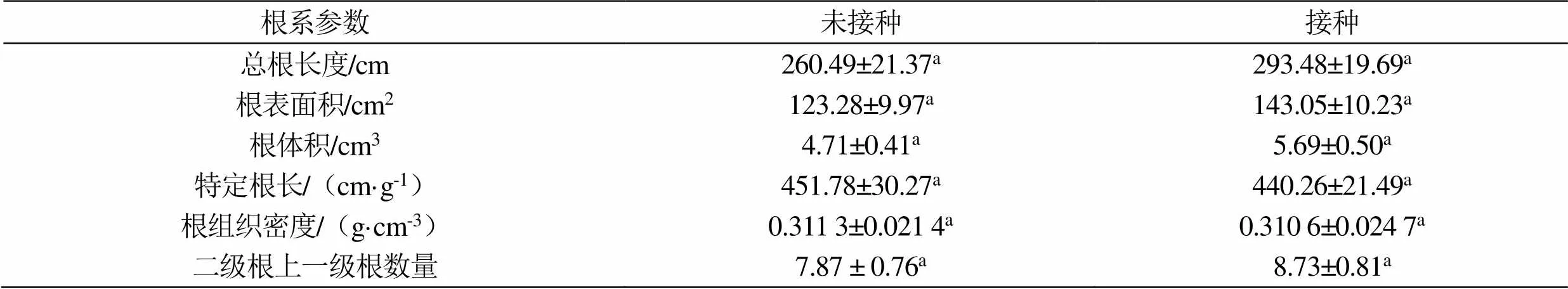
表1 印度梨形孢接种对香榧幼苗根系构型的影响
注:同一行中相同的英文小写字母表示差异不显著(> 0.05)。

图3 施加硒肥条件下印度梨形孢侵染对香榧光合色素含量的影响
Figure 3 Effects ofinoculation on concentrations of photosynthesis pigments ofseedlings supplied with a selenium fertilizer
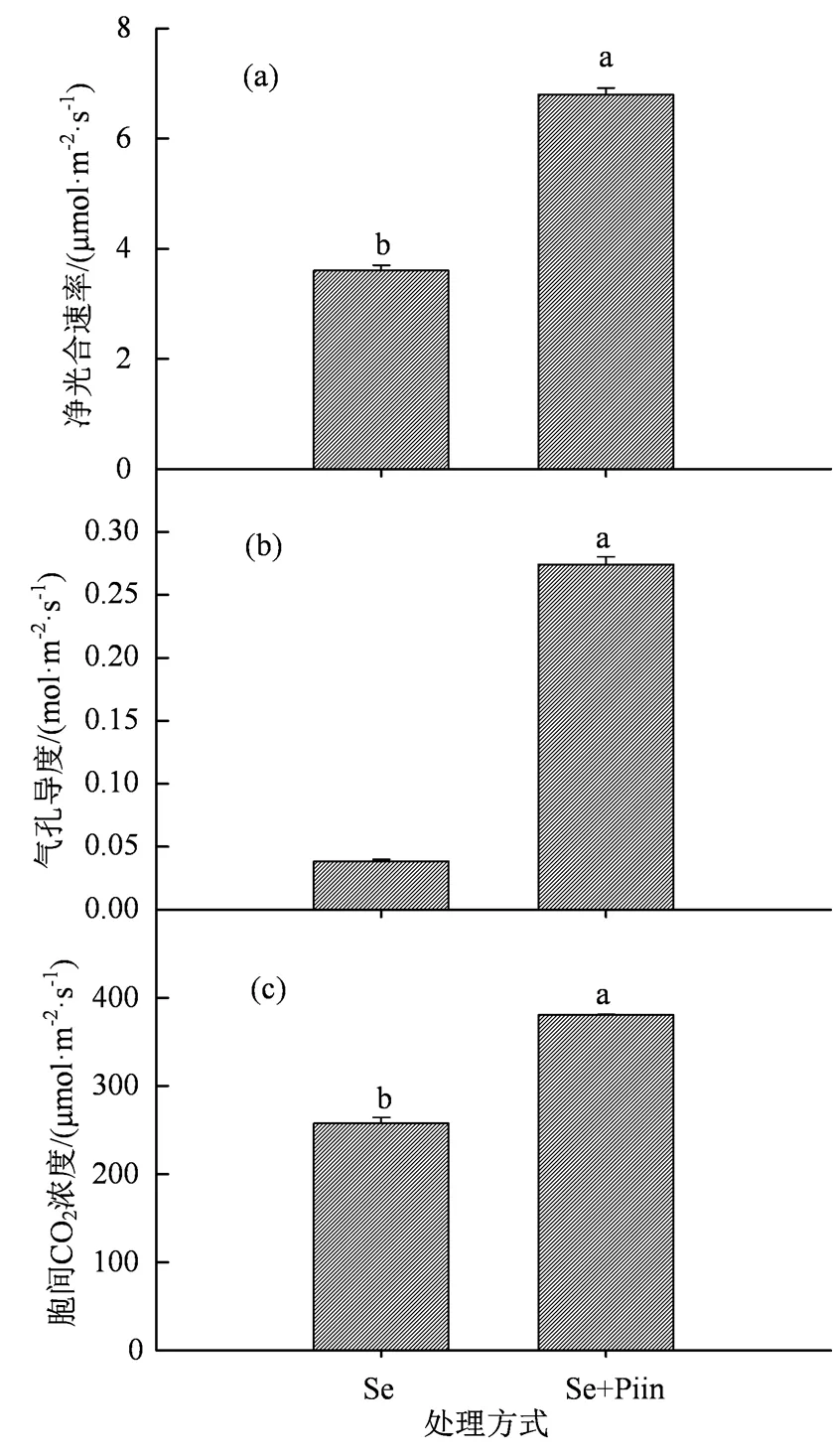
图4 施加硒肥条件下印度梨形孢侵染对香榧幼苗净光合速率(a)、气孔导度(b)和胞间CO2浓度(c)的影响
Figure 4 Effects ofinoculation on net photosynthetic rates (a), stomatal conductance (b) and intercellular CO2concentrations (c) ofseedlings supplied with selenium fertilizer
Figure 5 Effects ofinoculation on transpiration rates (a), light use efficiency (b) and water use efficiency (c) ofseedlings supplied with selenium fertilizer

图6 施加硒肥条件下印度梨形孢侵染对香榧生物量累积的影响
Figure 6 Effects ofinoculation on biomass accumulation ofseedlings supplied with selenium fertilizer

图7 施加硒肥条件下印度梨形孢侵染对香榧叶片总硒含量的影响
Figure 7 Effect ofinoculation on total selenium concentrations in leaves ofseedlings supplied with selenium fertilizer
2.3 在施加硒矿粉的条件下印度梨形孢的孵育对气体交换与生物量累积的影响
在施加硒矿粉的条件下,印度梨形孢的孵育对叶绿素含量和类胡萝卜素含量以及总叶绿素含量均没有显著的影响(图3,> 0.05)。印度梨形孢侵染香榧幼苗根系使其净光合速率增加92.92%,气孔导度增加6.16倍,胞间CO2浓度增加47.67%,且均呈现显著差异(图4,< 0.05)。同时也显著增加了其蒸腾速率(2.36倍)和光能利用效率(88.62%)(图5(a)和(b),< 0.05),但水分利用效率降低84.28%,且其差异显著(图5(c),< 0.05)。其侵染则显著增加香榧幼苗根茎叶和总生物量(图6,< 0.05),总生物量增加36.94%。
2.4 在施加硒矿粉的条件下印度梨形孢侵染对香榧叶片硒累积的影响
印度梨形孢对香榧的侵染引起了硒累积的变化。如图7所示,接种印度梨形孢的香榧叶片中总硒含量显著高于未接种香榧(< 0.05),增加1.68倍。
3 讨论
印度梨形孢可以侵染很多植物[39-42],它也可以侵染香榧根系(图1)。这种侵染增加了香榧幼苗根系的总长度、总表面积与总体积(表1),进而改变了植物根系构型(图2)。这些试验结果与印度梨形孢侵染对柏木幼苗根系的影响一致,但没有象柏木那样显著[28]。此外,印度梨形孢侵染增加了香榧幼苗二级根上的一级根的数量(表1)。据此可以推测,随着香榧幼苗的生长,接种印度梨形孢的香榧的根系构型将比未接种的香榧根系构型更复杂,这样的根系统对土壤营养(如硒)的吸收更强。然而,印度梨形孢侵染对香榧幼苗根系的特定根长与根组织密度几乎没有任何影响(表1)。这些研究结果表明印度梨形孢侵染对香榧幼苗根系的组织结构没有产生影响,香榧幼苗不需改变其碳的分配格局。
在磷缺乏条件下,印度梨形孢侵染杉木幼苗根系,可以促进杉木幼苗根系对氮磷钾的吸收,并改变其在根茎叶中的分配格局[27]。印度梨形孢侵染香榧也应促进其对营养的吸收并增强氮磷钾在叶片中的分配,进而促进香榧幼苗的净光合速率(图4(a)),增加其生物量的累积(图6)。印度梨形孢侵染香榧幼苗根系并没有相助其叶片光合色素的含量(图3),而其净光合速率显著增加(图4(a)),这可能来源于两个方面的原因。其一是印度梨形孢接种显著增加了香榧幼苗叶片的胞间二氧化碳浓度(图4(c))。胞间二氧化碳浓度的增加可以促进二氧化碳在碳酸酐酶的作用下进入叶绿体,进而增加叶绿体内可被利用的二氧化碳的浓度。其二,印度梨形孢可以改善植物光合作用过程的机制。印度梨形孢侵染接种柏木可以提高几个叶绿素荧光参数,如v/m、P和L[28]。此外,印度梨形孢侵染香榧幼苗显著增加了其光能利用效率(图5(b)),显著降低了其水分利用效率(图5(c))。这两个试验结果与印度梨形孢侵染杉木幼苗造成的影响不同。印度梨形孢侵染杉木幼苗根系时,显著提高其光能利用效率,但对水分利用效率没有影响[27]。印度梨形孢侵染香榧会增大其水分的消耗(图5(a)),因此在实际生产上,如果要进行香榧接种印度梨形孢,应加强水分的管理,尤其在干旱时期。
如前所述,很多有益微生物可用来进行农作物的营养强化。这种强化作用是基于有益微生物可促进植物对营养的吸收与利用。印度梨形孢侵染树木会促进养分吸收[27]。因而,印度梨形孢可以用来进行香榧对硒的生物强化。这种想法得到了证实,即香榧幼苗接种印度梨形孢可以显著促进其叶片总硒的累积(图7)。这一结果与茶树(cv. “Chuyeqi”)接种细菌sp. WT00C所取得的结果一致[18]。目前人们对有益微生物强化微量元素累积的机理还不十分清楚。初步研究表明,小白菜接种印度梨形孢可改变小白菜有关硒累积的转录组变化(蒲尧等未发表的数据)。在香榧接种印度梨形孢后,其硒累积的机理尚需进一步研究。蛋白组和代谢组的研究可以很好地揭示印度梨形孢接种对香榧硒吸收和累积的影响,后期我们将对此进行深入研究。
总之,印度梨形孢接种香榧幼苗可以增大其净光合速率,促进生物量累积,也促进总硒在其叶片中的累积,因此,根内生真菌印度梨形孢可以用于香榧果实硒的生物强化。
[1] RUGGERI R M, D'ASCOLA A, VICCHIO T M, et al. Selenium exerts protective effects against oxidative stress and cell damage in human thyrocytes and fibroblasts[J]. Endocrine, 2020, 68(1): 151-162.
[2] LEI C, NIU X L, MA X K, et al. Is selenium deficiency really the cause of Keshan disease? [J]. Environ Geochem Health, 2011, 33(2): 183-188.
[3] JIANG Y F, XU G L. The relativity between some epidemiological characteristics of kaschin-beck disease and selenium deficiency[C]//Selenium Biol Med. 1989: 263-269.
[4] ZHAO Z J, LI Q, YANG P Z, et al. Selenium: a protective factor for kaschin-beck disease in Qing-Tibet plateau[J]. Biol Trace Elem Res, 2013, 153(1/2/3): 1-4.
[5] ZHANG B J, YANG L S, WANG W Y, et al. Environmental selenium in the kaschin-beck disease area, Tibetan Plateau, China[J]. Environ Geochem Heal, 2011, 33(5): 495-501.
[6] ALI W, BENEDETTI R, HANDZLIK J, et al. The innovative potential of selenium-containing agents for fighting cancer and viral infections[J]. Drug Discov Today, 2021, 26(1): 256-263.
[7] ZHU X P, PAN D, WANG N N, et al. Relationship between selenium in human tissues and breast cancer: a meta-analysis based on case-control studies[J]. Biol Trace Elem Res, 2021, 199(12): 4439-4446.
[8] TURRUBIATES-HERNÁNDEZ F J, MÁRQUEZ- SANDOVAL Y F, GONZÁLEZ-ESTEVEZ G, et al. The relevance of selenium status in rheumatoid arthritis[J]. Nutrients, 2020, 12(10): 3007.
[9] LESCURE A, BALTZINGER M, ZITO E. Uncovering the importance of selenium in muscle disease[M]// Molecular and Integrative Toxicology. Cham: Springer International Publishing, 2018: 345-362.
[10] GAĆ P, CZERWIŃSKA K, MACEK P, et al. The importance of selenium and zinc deficiency in cardiovascular disorders[J]. Environ Toxicol Pharmacol, 2021, 82: 103553.
[11] SCHIAVON M, NARDI S, VECCHIA F D, et al. Selenium biofortification in the 21stcentury: status and challenges for healthy human nutrition[J]. Plant Soil, 2020, 453(1/2): 245-270.
[12] FAROOQ M U, TANG Z C, ZENG R, et al. Accumulation, mobilization, and transformation of selenium in rice grain provided with foliar sodium selenite[J]. J Sci Food Agric, 2019, 99(6): 2892-2900.
[13] BABALAR M, MOHEBBI S, ZAMANI Z, et al. Effect of foliar application with sodium selenate on selenium biofortification and fruit quality maintenance of ‘Starking Delicious’ apple during storage[J]. J Sci Food Agric, 2019, 99(11): 5149-5156.
[14] REN G X, RAN X L, ZENG R Y, et al. Effects of sodium selenite spray on apple production, quality, and sucrose metabolism-related enzyme activity[J]. Food Chem, 2021, 339: 127883.
[15] SMOLEŃ S, BARANSKI R, LEDWOŻYW-SMOLEŃ I, et al. Combined biofortification of carrot with iodine and selenium[J]. Food Chem, 2019, 300: 125202.
[16] PUCCINELLI M, PEZZAROSSA B, ROSELLINI I, et al. Selenium enrichment enhances the quality and shelf life of basil leaves[J]. Plants (Basel), 2020, 9(6): 801.
[17] HU Q H, XU J, PAN G X. Effect of selenium spraying on green tea quality[J]. J Sci Food Agric, 2001, 81(14): 1387-1390.
[18] XU X, CHENG W, LIU X, et al. Selenate reduction and selenium enrichment of tea by the endophyticsp. strain WT00C[J]. Curr Microbiol, 2020, 77(4): 588-601.
[19] HU T, HUI G F, LI H F, et al. Selenium biofortification in(lion's mane mushroom) and itsbioaccessibility[J]. Food Chem, 2020, 331: 127287.
[20] DONG Z, XIAO Y Q, WU H. Selenium accumulation, speciation, and its effect on nutritive value of(Golden needle mushroom)[J]. Food Chem, 2021, 350: 128667.
[21] MANFIO D, RODRIGUES M N F, SAVI G D, et al. Brazil nut (H. B. K.) selenium distribution and physical chemical characteristics of shell, brown skin and edible part from two Amazon regions [J]. Asian J Agri Rural Dev, 2012, 2(2): 287-293.
[22] 陈红星, 陈素贞, 张迟, 等. 香榧新品种‘玉山果榧’的选育[J]. 中国果树, 2021(8): 79-80, 109.
[23] 胡文翠, 张迟, 厉锋, 等. 香榧良种‘朱岩榧’的选育[J]. 果树学报, 2021, 38(3): 455-458.
[24] 任少华, 龙成昌, 王陈, 等. 香榧及其优质高产栽培技术探讨[J]. 现代园艺, 2021, 44(19): 72-74.
[25] YE Y M, QU J W, PU Y, et al. Selenium biofortification of crop food by beneficial microorganisms[J]. J Fungi (Basel), 2020, 6(2): 59.
[26] VARMA A, KOST G, OELMÜLLER R.[M]. Berlin, Heidelberg: Springer Berlin Heidelberg, 2013.
[27] WU C, LI B C, WEI Q, et al. Endophytic fungusincreased nutrition absorption and biomass accumulation inseedlings under low phosphate[J]. Acta Ecol Sin, 2019, 39(1): 21-29.
[28] WU C, WEI Q, DENG J, et al. Changes in gas exchange, root growth, and biomass accumulation ofseedlings colonized by[J]. J For Res, 2019, 30(4): 1199-1207.
[29] JIANG W, PAN R, WU C, et al.enhances freezing tolerance and post-thaw recovery inby stimulating the expression of CBF genes[J]. Plant Signal Behav, 2020, 15(4): 1745472.
[30] PAN R, XU L, WEI Q, et al.promotes early flowering inthrough regulation of the photoperiod and gibberellin pathways[J]. PLoS One, 2017, 12(12): e0189791.
[31] LIU B H, JING D W, LIU F C, et al.alleviates drought stress responses in walnut (L.) seedlings by stimulating osmotic adjustment and antioxidant defense system[J]. Appl Microbiol Biotechnol, 2021, 105(23): 8951-8968.
[32] SEPEHRI M, GHAFFARI M R, KHAYAM NEKOUI M, et al. Root endophytic fungusmodulates barley leaf blade proteome by increasing the abundance of photosynthetic proteins in response to salinity[J]. J Appl Microbiol, 2021, 131(4): 1870-1889.
[33] SHUKLA J, MOHD S, KUSHWAHA A S, et al. Endophytic fungusreduces arsenic mobilization from root to fruit in colonized tomato plant[J]. Environ Pollut, 2022, 298: 118830.
[34] JAVAD A, KAMRAN R, VALIOLLAH B, et al. Induction of wheat resistance to STB by the endophytic fungusand[J]. Iran J Biotechnol, 2021, 19(2): e2762.
[35] VAHABI K, JOHNSON J M, DRZEWIECKI C, et al. Fungal staining tools to study the interaction between the beneficial endophytewithroots [J]. J Endocyto Cell Res, 2011: 77-88.
[36] PREGITZER K S, DEFOREST J L, BURTON A J, et al. Fine root architecture of nine North American trees[J]. Ecol Monogr, 2002, 72(2): 293-309.
[37] KUMAR M, LEE S C, KIM J Y, et al. Over-expression of dehydrin gene, OsDhn1, improves drought and salt stress tolerance through scavenging of reactive oxygen species in rice (L.)[J]. J Plant Biol, 2014, 57(6): 383-393.
[38] CHEN Y W, ZHOU M D, TONG J, et al. Application of photochemical reactions of Se in natural waters by hydride generation atomic fluorescence spectrometry[J]. Anal Chimica Acta, 2005, 545(2): 142-148.
[39] DAS A, TRIPATHI S, VARMA A. In vitro plant development and root colonization ofby[J]. World J Microbiol Biotechnol, 2014, 30(3): 1075-1084.
[40] SHAH S, THAPA B B, CHAND K, et al.promotes the growth of the in-vitro-raisedplantlet and their acclimatization[J]. Plant Signal Behav, 2019, 14(6): 1596716.
[41] DEL BARRIO-DUQUE A, LEY J, SAMAD A, et al. Beneficial endophytic bacteria-interaction for crop enhancement and resistance to phytopathogens[J]. Front Microbiol, 2019, 10: 2888.
[42] RAHMAN S U, KHALID M, KAYANI S I, et al. The ameliorative effects of exogenous inoculation ofon molecular, biochemical and physiological parameters ofL. under arsenic stress condition[J]. Ecotoxicol Environ Saf, 2020, 206: 111202.
Effects ofinoculation on root development, growth and selenium accumulation in leaves ofseedlings supplied with selenium fertilizer
LI Aihua1, XU Xiuhuan1, LI Jinzhu1, PU Yao2, WU Chu2
(1. Hubei Institute of Forestry, Wuhan 430075; 2. College of Horticulture & Gardening, Yangtze University, Jingzhou 434025)
In recent years, fruits ofenjoy great popularity, now, how to increase fruit yield and improve fruit quality, especially the concentrations of micronutrients in fruits are essential forcultivation. Selenium is the essential element for the biosynthesis of selenoproteins, and lack of it is related to some human diseases. In the present study,seedlings were planted in plastic pots, powder of selenium rock was applied in the cultivation substrate, and root endophytic funguswas inoculated withseedlings. The results showed the fungus could infect the roots ofseedlings, and the inoculation increased the total root length, surface areas, root volumes and the numbers of the first-order roots on the second-order roots by 12.69%, 16.26%, 20.81% and 10.93%, respectively. However, the inoculation did not affect the specific root length and root tissue densities ofseedling roots. The inoculation significantly increased the net photosynthesis rates, stomatal conductance, intercellular CO2concentrations and transpiration rates by 92.92%, 6.16 times, 47.67% and 2.36 times, respectively. And the inoculation significantly increased the light use efficiency (88.62%) and reduced the water use efficiency (84.28%). Compared with non-inoculated seedlings, inoculated seedlings showed significantly higher total biomass accumulation and total selenium concentrations in the leaves by 36.94% and 1.68 times, correspondingly. The result suggested that the root endophytic fungusmight be used in cultivation offor selenium biofortification in the fruits.
selenium;;; biofortification
S791.53
A
1672-352X (2022)05-0735-06
10.13610/j.cnki.1672-352x.20221111.020
2022-11-14 11:09:15
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20221111.1118.040.html
2021-12-15
湖北省林业科技支撑重点项目 (2016-LYKJ01)资助。
李爱华,研究员。E-mail:935284663@qq.com
吴 楚,博士,教授。E-mail:wuchu08@yangtzeu.edu.cn

