光质对杉木幼苗叶片光合作用的影响
汪星星,陈 钢,左晓东 ,范福金,曹光球,曹世江*
光质对杉木幼苗叶片光合作用的影响
汪星星1, 2, 4,陈 钢3,左晓东1, 2, 4,范福金5,曹光球1, 2 , 4,曹世江1, 2, 4*
(1.福建农林大学林学院,福州 350002;2.国家林业和草原局杉木工程技术研究中心,福州 350002;3. 湖南省江永县自然资源局,永州 425000;4. 林木逆境生理生态及分子生物学福建省高校重点实验室,福州 350002;5. 福建省洋口国有林场,南平 353200)
为探明4种光质处理对杉木幼苗的光合参数的影响,以1年生的优良无性系020扦插苗为试验材料,设置4种光质,8个梯度的光强;通过室内光质培育,研究杉木幼苗的光合速率(n)、气孔导度(s)、胞间CO2浓度(i)、蒸腾速率(r)、水分利用效率(WUE)等参数,并对各种光质与光强数据进行拟合分析,建立拟合模型。结果表明,在弱光环境下,蓝光和红:蓝(1:1)对杉木幼苗的光合参数的影响显著,而在强光下,红光的作用显著。红光处理下的杉木幼苗的光合速率(n)、气孔导度(s)、水分利用效率(WUE)等方面与其他光质处理有差异,而在胞间CO2浓度(i)、蒸腾速率(r)方面虽然略低于蓝光,但蓝光、红光和红:蓝(1:1)3种光质处理结果的差异性不显著。在光强与光质的拟合方面,气孔导度(s)、胞间CO2浓度(i)和蒸腾速率(r)的拟合性较好。因此,一定程度上的红:蓝(1:1)光对杉木的光合参数有促进作用。
杉木;光质;光强;光响应
外界环境会对植物的生长发育产生重要影响,而外界环境又以自然光为重要影响因子[1],自然光中,光质对植物的生长发育有着重要作用,也会对植物的光合过程产生影响,还可以调节植物的气孔运动,控制水汽的输送[2],从而影响植物的光合作用和蒸腾作用,因此逐渐成为研究热点。太阳辐射同样作为外界环境因子之一,也是植物生长发育过程中不可缺少的因素。而植物所吸收太阳辐射基本上都是集中于蓝光区(425 ~ 490 nm )和红光区(600 ~ 700 nm )[3]。目前,杉木光合作用的各方面相关研究已逐渐展开。Ramalho等[4]研究认为叶片中的叶绿体可以感受到所接受到光质的不同,从而对植物叶片的气孔进行调节[1, 5]。有研究报道,蓝光可以引起气孔的开放,提高叶片的气孔密度,増加了胞间CO2浓度,而Talbott[6]和Kinoshita[7]等研究得出在绿光转换成蓝光的过程中,蚕豆表面的气孔逐渐增大,而红光对植物气孔的调节不同于蓝光[8]。植物在不同光质处理下,其反应不一致。有研究表明[9],蓝光对植物的生长以及生理生化特征产生重要影响,相较于其他光质而言,蓝光和红光易被植物吸收。大量研究发现[10],红光、蓝光和红:蓝(1:1)混合光均可对植物的生长产生作用。有研究发现,红光对植物的光合作用产生促进作用,具体表现在红光有利于植物体内叶绿素的形成,同时也有利于叶片表皮气孔的打开[11]。对植物来说,光照度即光合量子通量密度,通常认为是光照强度,是影响植光环境调控对植物生长发育的影响物光合作用的重要参数之一。吴晓颖等[12]研究发现:随着光强降低,叶长、叶宽、叶面积及比叶面积显著增加,单叶干重和比叶重显著降低,植株干物质积累量显著降低。随光强降低,最大净光合速率(n)、光饱和点(LSP)、光补偿点(LCP)和暗呼吸速率(a)降低。低光照强度的叶片叶绿素含量低于中、高光照强度处理。龚洪恩等[13]针对不同LED光强对油茶苗的生理生化现象进行研究,得出与其他处理相比,250 μmol·m-2·s-1处理更利于提高长林4号油茶苗各项生理生化指标,是培育油茶苗较为理想的光强。
光响应曲线是植物在不同光强下光合作用的集中体现,利用植物的光响应曲线可以得出光补偿点LCP)、光饱和点(LSP)、最大净光合速率(nmax)和暗呼吸速率(d)等参数[14],利用这些参数可以研究植物的生长。目前对光响应曲线的影响主要集中在越橘[15]、辣椒[16]、烟草[17]等植物,虽然汪凤林等[18]对杉木幼苗的光响应做出研究,但是只对单色光下杉木的光合作用进行分析,并未涉及混合光,也未对不同光质下杉木幼苗光合参数的变化进行拟合,因此需要进一步研究光质对光响应曲线的拟合曲线。杉木树种是目前遍布于我国南方地区的主要速生乔木树种之一,在我国森林自然环境系统中占据了重要的战略地位,杉木因为具有生长快、材料优等的特点,在南方16个省市中广泛栽培[19]。光质对杉木影响的研究逐渐成熟,但是由于试验条件和试验材料的不一致,试验结果难以统一,甚至相反。光强对于杉木幼苗的光合特征只是基础研究,还缺少对光强对光合参数的影响进行拟合。本研究以白光(W)为对照,通过测定白、红、蓝和红/蓝(1/1) 4种光质下1年生杉木幼苗在不同光强梯度下的光合特征等参数,研究不同光质处理下杉木幼苗的光合特征,并进行拟合,以期为室内育苗提供理论指导。
1 材料与方法
1.1 试验材料及设计
试验于2020年3月开始进行,以1年生的优良无性系020扦插苗为试验材料,杉木幼苗由福建省洋口国有林场提供。去掉杉木的分枝,然后将幼苗移植到直径36 cm,高25 cm,四周涂成红色的塑料桶内(= 6 L),培养的基质包含以泥炭、松树皮为主的有机质和以珍珠岩、砂等为主的无机质,基本理化性质为:容重,0.27 g·cm-3;总孔隙度,20%;含水率,35.2%;pH 4.95;全N,14.8 g·kg-1;有效磷,102.2 mg·kg-1;速效钾,136.6 mg·kg-1。每桶定植1株。在移栽后将所有植株放入福建农林大学田间试验基地温室内。地处东经120°23′,北纬27°30′,属亚热带季风气候,年平均气温在20 ~ 25 ℃,年平均降雨在1 000 ~2 000 mm之间,期间对苗木进行精细化管理,保持土壤的湿度,每天傍晚7:00进行人工降水处理,期间防止杉木幼苗受到病虫害影响。

表1 试验设计
杉木幼苗培育4周后,挑选健壮且差异较小的植株进行不同的密闭空间处理,将杉木幼苗放入钢制培养架上,光源位于顶部,培养架外层用黑色遮光布遮挡,能够有效避免散射光。试验采用不同比例的红(400 ~ 450 nm)、蓝(600 ~ 650 nm)单色LED灯数量的组合,共有白光(W)、红光(R)、蓝光(B)、红:蓝=1:1(1R1B)4个光质处理(参考表1),其中将白光(W)作为对照处理,光照时长昼夜等长(昼:夜=12 h/12 h),环境条件控制在光强保持100 ~ 110 μmol·m-2·s-1,温度保持在28 ℃左右,湿度保持在65%左右。每个处理共有3盆植株,共计3次重复,合计12盆植株。试验时间在2020年4月至10月。
1.2 测定方法
1.2.1 光合气体交换参数的测定 当杉木进行光质处理30 d时,自上而下选择植物的第一片成熟叶子,采用Li6400-XT便携式光合测定仪,将光质设置为白、红、蓝和红:蓝(1:1) 4种处理,在光强为2 000、1 500、1 000、500、200、150、120和100 μmol·m-2·s-18个不同梯度里测光合速率(n),蒸腾速率(r),气孔导度(s),胞间CO2浓度(i)指标,并计算水分利用效率(CWUE),每隔5 s测量1次,重复测量3次,并做好记录。
1.2.2 光合色素的测定 挑选同一采样时间,选取12株健康的杉木,将新叶上的灰尘擦洗干净,每3株新叶为一个光质处理,每个处理共3个重复。测定杉木叶片的叶绿素a、叶绿素b、类胡萝卜素等。用酶标仪分别测定663、645 和470 nm 下的吸光度值并根据公式分别计算出叶绿素a、叶绿素b、类胡萝卜素值。
1.3 数据处理
水分利用效率(WUE)采用WUE=n/r计算,研究数据利用SPSS26.0软件进行整合和处理,并利用Origin9.0进行作图。
2 结果与分析
2.1 光合速率的光响应曲线
由图1可知,随着光强的增强,不同的光质对于杉木幼苗的n会产生不同影响,8个光强梯度下的杉木幼苗的n的反应并不相同,除红:蓝(1:1)光外,其他单质光处理均在一定的光强下呈现下降趋势。
当光强小于200 μmol·m-2·s-1时,4种光质处理下的杉木幼苗n呈现出上升趋势,且上升速度较快,而在光强大于200 μmol·m-2·s-1时,呈现出稳定态势。在弱光强环境下,蓝光和红:蓝(1:1)光对杉木幼苗的n的提高具有显著的促进作用,随着光强的持续增强,红光和红:蓝(1:1)光的作用持续上升,而白光和蓝光处理下的杉木幼苗n达到了光饱和,没有表现出明显的增长趋势,且与红光和红:蓝(1:1)光的差异性显著(< 0.05)。总体而言,弱光环境下,杉木幼苗n的规律呈现出“红:蓝(1:1)>蓝光>白光>红光”,而在强光环境下,杉木幼苗n的规律呈现出“红光>红:蓝(1:1)>蓝光>白光”的规律。
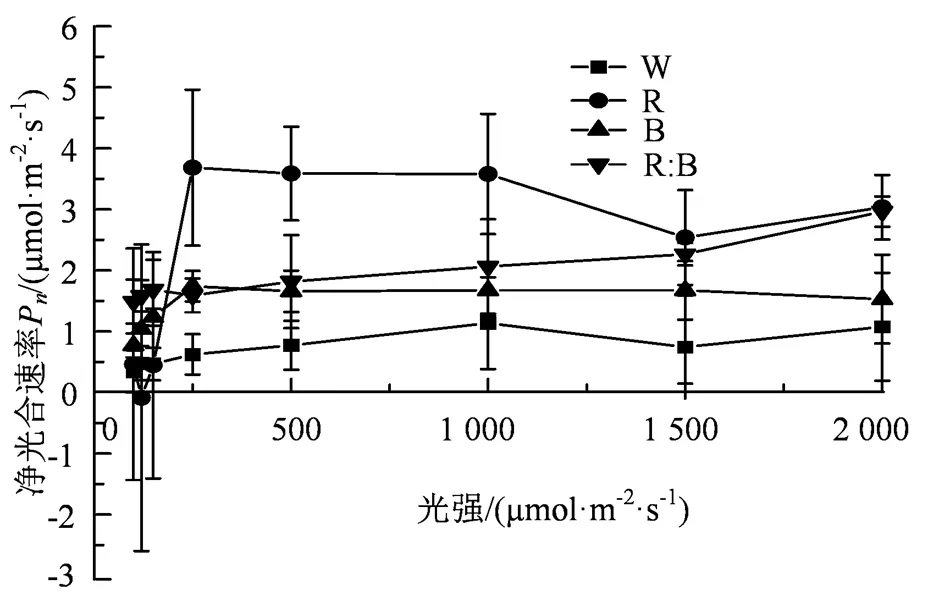
图1 不同光质光合速率的光响应曲线
Figure 1 The light response curves of the photosynthesis rates under different light quality conditions
由表2可知,4种光质处理下的杉木幼苗的n(净光合速率)与光强的数据进行拟合后,其杉木幼苗的n(净光合速率)与光强满足方程n=b0+b1+ b22+ b33(其中,b0、b1、b2和b3为常数)函数关系,特别是白光和红:蓝(1:1)的R> 0.80。结果表明4种光质处理下的杉木幼苗的n(净光合速率)与光强的相关性较强,其中白光和红:蓝(1:1)的拟合程度优于其他光质。
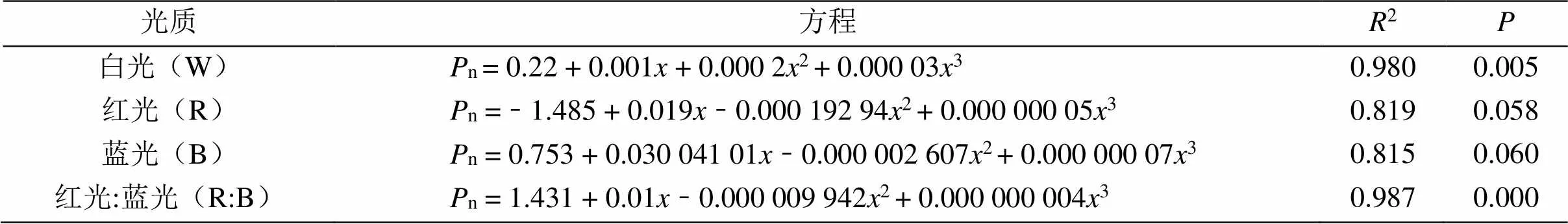
表2 不同光质处理的净光合速率与光强的回归方程
2.2 气孔导度的光响应曲线
植物叶片的气孔是光合作用和蒸腾作用的物质输送渠道,不同强度的光质和光强会对植物叶片的气孔产生影响。由图2可知,8个光强梯度下的杉木幼苗G的反应与杉木幼苗P的变化并不一致。无论是在强光强环境下或者弱光强环境下,杉木幼苗G均表现为红光处理下最强,白光处理下最弱,具体规律为“红光>红:蓝(1:1)>蓝光>白光”,且白光与其他光质处理的差异性较为显著(< 0.05)。随着光强的不断增强,除红光和白光处理外,其他光质处理下的杉木幼苗s均保持持续增长。总体而言,4种光质处理下的杉木幼苗s都呈现不同程度的增长趋势。
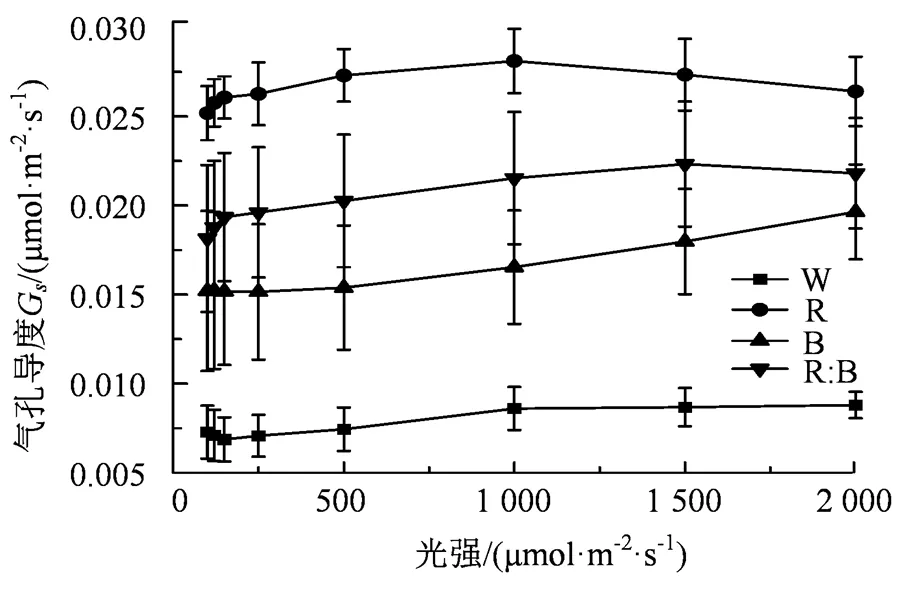
图2 不同光质气孔导度的光响应曲线
Figure 2 The light response curves of the pore conductivity under different light quality conditions
表3显示,4种光质处理下的杉木幼苗的s(气孔导度)与光强的数据进行拟合后,其杉木幼苗的s(气孔导度)与光强满足方程s= b0+ b1+ b22+ b33(其中b0、b1、b2和b3为常数)函数关系,且2> 0.90。结果表明4种光质处理下的杉木幼苗的s(气孔导度)与光强的相关性较强。
2.3 胞间CO2浓度的光响应曲线
总体而言,随着光强增强,各种光质处理对杉木幼苗的i也会产生不同的反应,即使在同一种光质处理下,i反应也并不一致。由图3可知,当光强小于200 μmol·m-2·s-1,光质与杉木幼苗的i呈现明显的负相关关系,具体规律为:红:蓝(1:1)>蓝光>白光>红光。当光强为500 μmol·m-2·s-1时,混合光质对与杉木幼苗的i相较于其他光质而言,处于较高水平,但差异并不显著。当光强达到峰值时,各种光质处理下杉木幼苗的i具体规律为“红光>白光>红:蓝(1:1)>蓝光”。当光强处于中等光强范围内,光质对杉木幼苗的i的变化并不明显,蓝光对杉木幼苗i的影响呈现波动变化,而红:蓝(1:1)则呈现下降趋势。
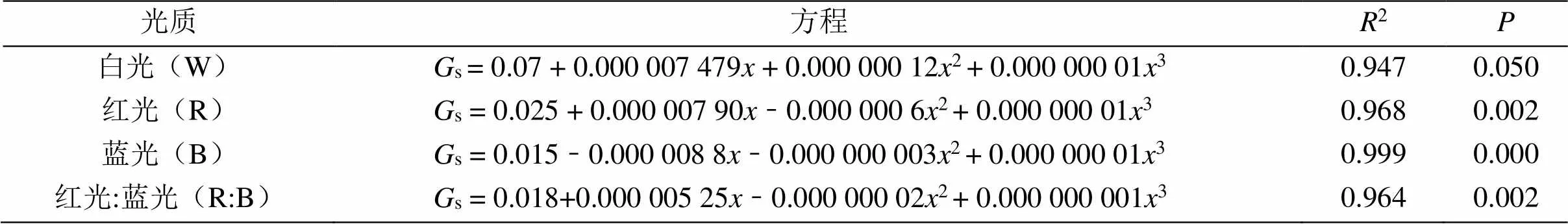
表3 不同光质处理的气孔导度与光强的回归方程
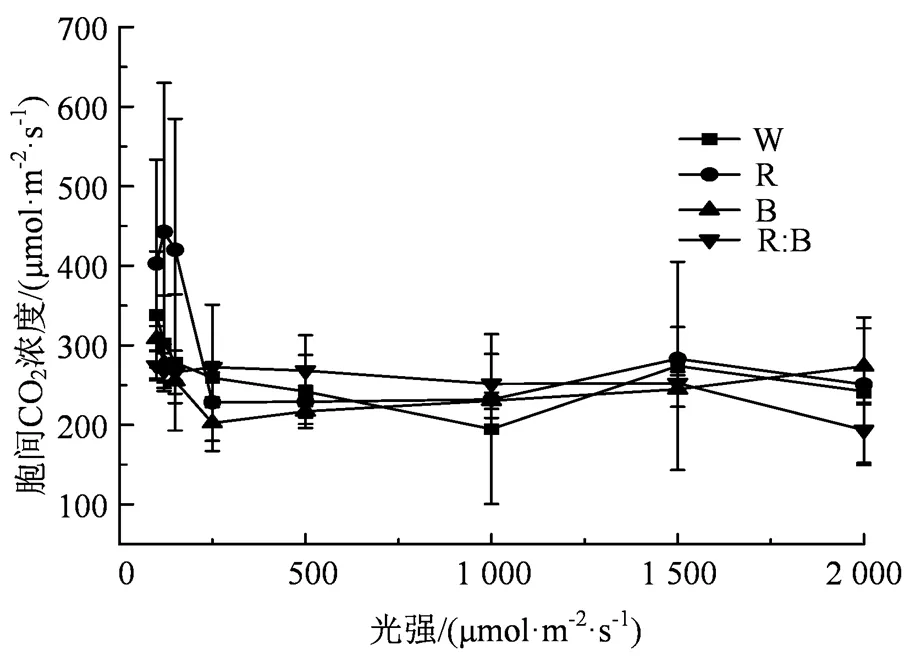
图3 不同光质的胞间CO2浓度光响应曲线
Figure 3 The CO2concentration light response curves be- tween cells with different light quality treatments
根据表4得知,4种光质处理下的杉木幼苗的i(胞间CO2浓度)与光强的数据进行拟合后,其杉木幼苗的C(胞间CO2浓度)与光强满足方程i= b0+ b1+ b22+ b33(其中b0、b1、b2和b3为常数)函数关系,且R> 0.90,结果表明4种光质处理下的杉木幼苗的i(胞间CO2浓度)与光强的相关性较强。
2.4 蒸腾速率的光响应曲线
由图4可知,无论是同一光质不同光强、同一光强不同光质,杉木幼苗的r反应均不一致,当光强小于200 μmol·m-2·s-1,光质与杉木幼苗的r呈现出正相关关系,随着光强的增强,各个光质处理下杉木幼苗的r的上升速度较快,相较于CK而言,蓝光、红:蓝(1:1)上升趋势较大,红光的上升速度较为平缓,红光处理与其他光质处理呈现出显著性差异,r的规律具体表现为蓝光>红:蓝(1:1)>白光>红光。随着光强的不断增强,4种光质处理下的杉木幼苗的r呈现出增长的趋势,但增长幅度并不一致。当光强达到最大时,r呈现出“红:蓝(1:1)>蓝光>红光>白光”的规律,红:蓝(1:1)处理下杉木幼苗的r上升幅度最大。除红光外,其余3种光质处理下杉木幼苗的r的差异性不显著。当光强处于中等光强范围内,光质对杉木幼苗的r具有促进作用。其中白光、红光在整个光强中均保持上升,而蓝光在1 000 μmol·m-2·s-1时出现下降,红:蓝(1:1)在1 500 μmol·m-2·s-1时出现下降,在此期间,红光下的杉木幼苗叶片的r一直保持较低的水平。
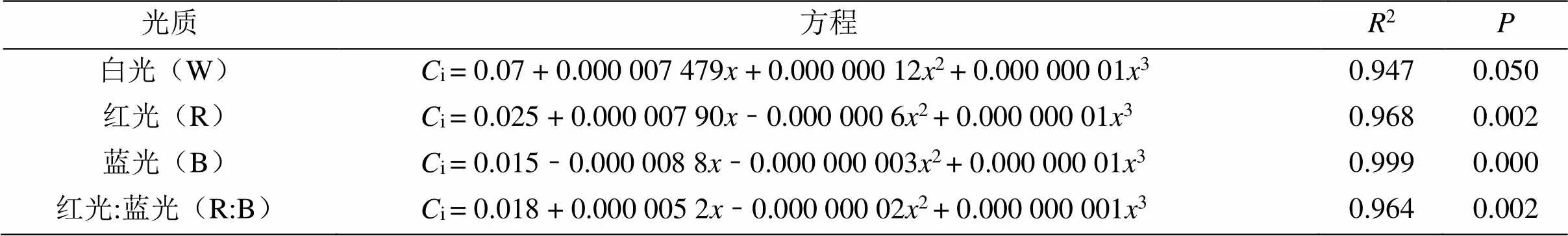
表4 不同光质处理的胞间CO2浓度与光强的回归方程
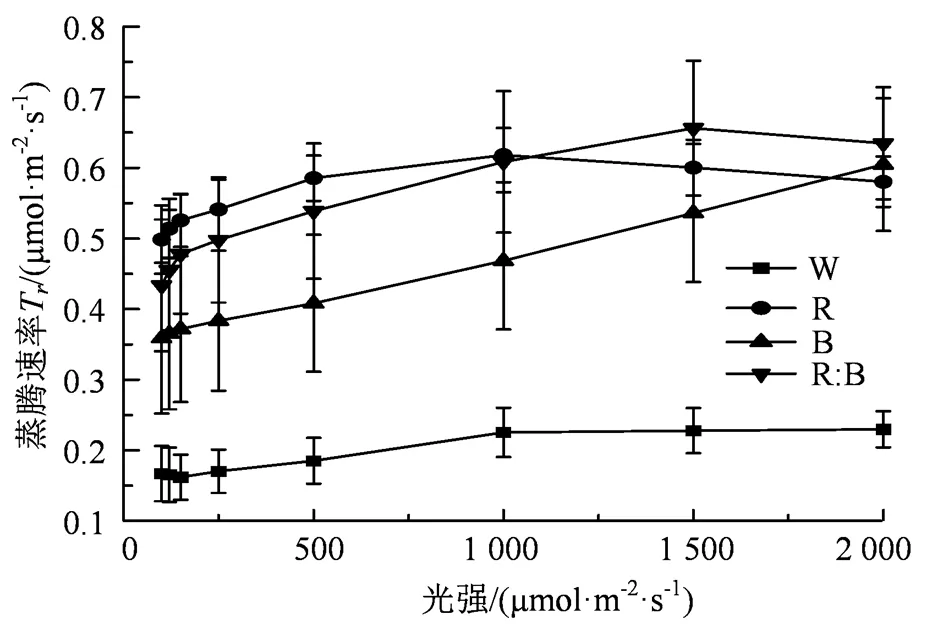
图4 不同光质蒸腾速率的光响应曲线
Figure 4 The vapor rate light response curves for different light quality treatments
根据表5得知,4种光质处理下的杉木幼苗的r(蒸腾速率)与光强的数据进行拟合后,其杉木幼苗的r(蒸腾速率)与光强满足方程r= b0+ b1+ b22+ b33(其中b0、b1、b2和b3为常数)函数关系,且R> 0.90,结果表明4种光质处理下的杉木幼苗的r(蒸腾速率)与光强的相关性较强。
2.5 水分利用效率的光响应曲线
光质对杉木幼苗的n、r产生影响,进而对杉木幼苗的水分利用效率(WUE)产生作用。总体而言,随着光强的增大,杉木幼苗的WUE上升趋势逐渐稳定,但在同一光强下,各种光质处理下的杉木幼苗的WUE的反应并不一致。当光强小于200 μmol·m-2·s-1,白光、红:蓝(1:1)都保持上升的趋势,但红光、蓝光下的幼苗WUE并不稳定。当光强大于1 500 μmol·m-2·s-1,光质下对杉木幼苗的WUE呈现出正相关关系,蓝光的促进作用最大,CK与红光的促进作用最小。当光强达到峰值时,红光对杉木幼苗的WUE作用相较于其他光质而言较小。当光强处于中等范围内,除蓝光外,其他光质对杉木幼苗的WUE具有稳定作用,呈现出蓝光>CK>红:蓝(1:1)>红光的规律(图5)。
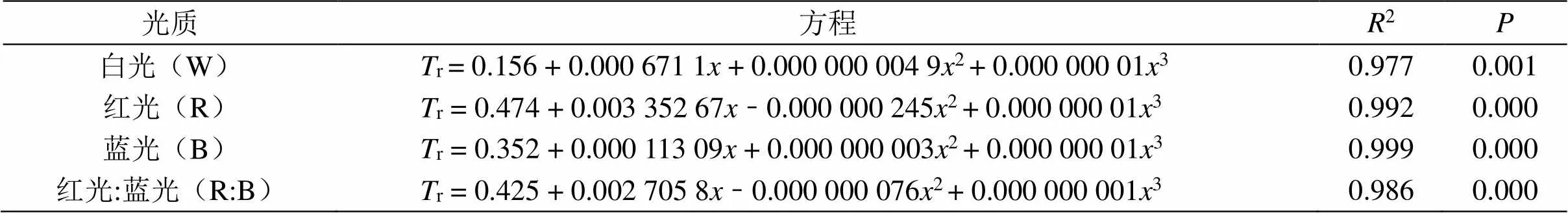
表5 不同光质处理的蒸腾速率与光强的回归方程
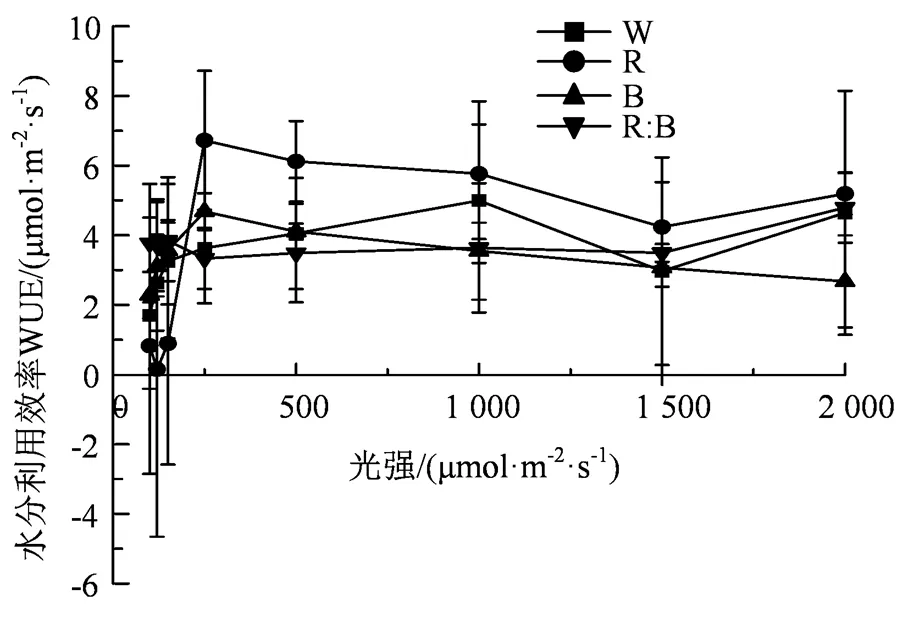
图5 不同光质水分利用效率的光响应曲线
Figure 5 Light response curvesof water use efficiency under different light quality conditions
根据表6得知,4种光质处理下的杉木幼苗的WUE与光强的数据进行拟合后,其杉木幼苗的WUE(水分利用效率)与光强满足方程WUE= b0+ b1+ b22+ b33(其中b0、b1、b2和b3为常数)函数关系,且R> 0.75,结果表明4种光质处理下的杉木幼苗的WUE与光强的相关性较强,其中红光和红:蓝(1:1)的拟合程度优于其他光质处理。
2.6 不同光质对杉木幼苗光合色素的影响
叶绿体是植物进行光合作用的主要场所,研究植物的光合色素,可以对植物的捕光能力进行判断,从而了解植物的光合作用。由图6可知,光质处理对杉木叶片叶绿素和类胡萝卜素的影响并不显著。R处理下的叶绿素a、叶绿素b、叶绿素a/b、叶绿素和类胡萝卜素相较于CK而言,分别增长了8.31%、3.01%、5.36%、4.7%和6.46%。B处理和R:B处理下的杉木幼苗叶片的叶绿素和类胡萝卜素,与CK相比,均没有显著的差异性(< 0.05)。其中,两种处理下的叶绿素a、叶绿素b、叶绿素和类胡萝卜素与CK相比,分别增长了11.39%、17.86%、13.65%、7.77%和1.15%、5.42%、2.64%、3.74%。但是在叶绿素a/b方面,B处理和R:B处理下的叶绿素a/b呈现出下降趋势,相较于CK而言,分别降低了4.65%和4.47%。虽然光质处理对杉木幼苗的叶绿素和类胡萝卜素都有不同程度的影响,但是差异未达到显著性水平(> 0.05)。
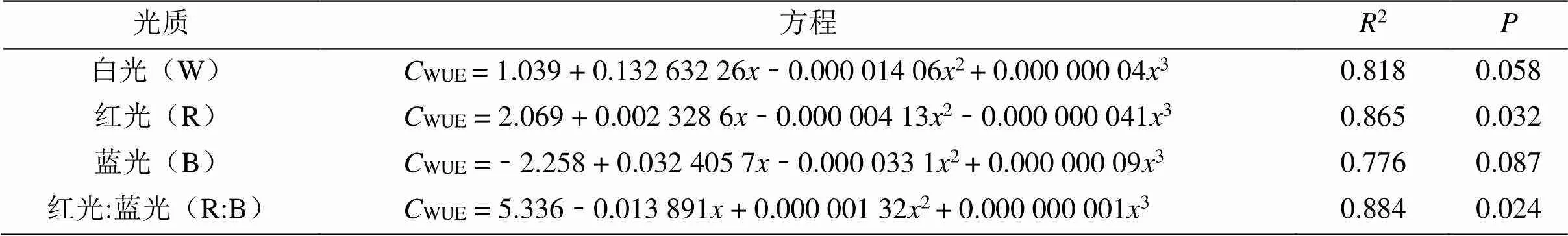
表6 不同光质处理的水分利用效率与光强的回归方程
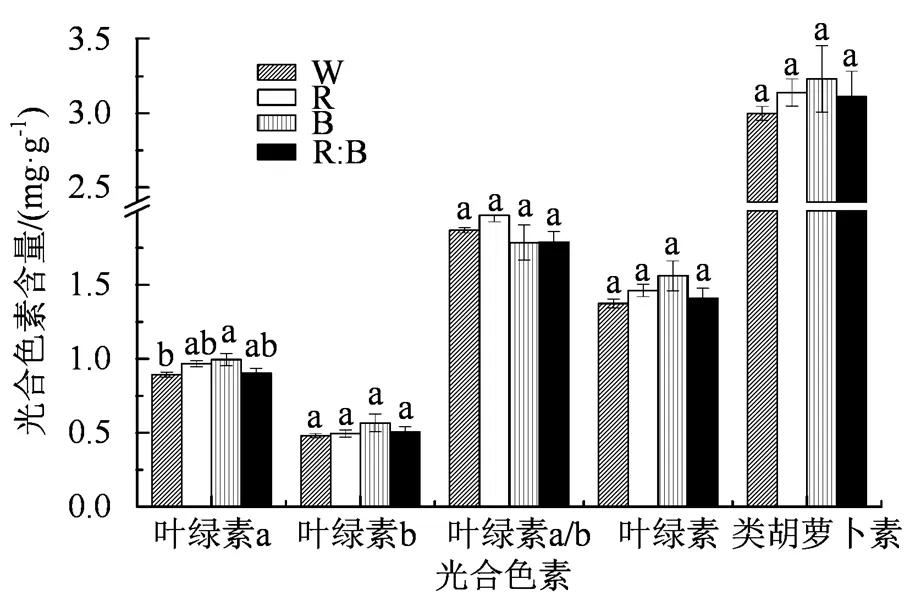
图6 不同光质处理下杉木幼苗光合色素的变化
Figure 6 Changes of photosynthetic pigments of Chinese fir seedlings under different light quality conditions
3 讨论与结论
n与植物的光合作用密切联系,n越大,植物拥有越多的营养物质[20]。本研究结果为杉木幼苗的n、s和WUE三者与光强呈现正相关关系,此结果与 Wu等[21]研究结果一致。而杉木幼苗的i在不同光强下总体呈现出下降的趋势,表明光质对杉木幼苗的i一定程度上起到抑制作用。研究发现,不同光照强度对杉木幼苗叶片的n产生不同影响,光照强度增强,光合速率上升,植物合成的营养物质增加。针对光质对杉木幼苗n的影响可以得出,当光强≤ 200 μmol·m-2·s-1,杉木幼苗的n呈现正相关关系,红:蓝(1:1)处理下杉木幼苗的n在低光强中处于较高位置,说明在低光强下,红:蓝(1:1)度杉木光合作用具有促进作用。此结果与周锦业[22]对杉木的组培的研究结论不相同,可见不同研究对象光强处理的n含量的反应有较大差异,这可能与光质的实现条件不同有关。当光处于强光范围内,单质光对于杉木幼苗的n具有稳定作用,可能是在红光和白光两种光质影响下,随着光强的增强,杉木幼苗出现光抑制[23]。而蓝光、红:蓝(1:1)下杉木幼苗叶片的n处于较高的含量,即在强光强下,蓝光、混合光能够促进杉木光合作用的进行,有助于杉木营养物质的积累。但此文的结果与刘晓英[24]研究结果不一致,故蓝光处理对于杉木幼苗的影响还未形成统一结论,需要进一步研究。当光强处于中等光强之间,红:蓝(1:1)处理杉木幼苗的n与其他光质处理具有显著性差异,表明红:蓝(1:1)对杉木幼苗叶片光合作用具有促进作用。s是植物气孔张开的指标,表示单位面积的叶片在单位时间内所蒸发的水汽含量[25],植物的s影响植物的蒸腾作用和光合作用。植物的s与光质、光强有密切联系。Frechilla等[26]研究表明蓝光对植物气孔的舒张程度具有促进作用,当光强小于200 μmol·m-2·s-1,光质对杉木幼苗的s具有抑制作用,无论是单质光,还是混合光,弱光强下杉木幼苗的s持续下降,而光强处于其他范围时,杉木幼苗的s趋于稳定,即气体交换稳定,有利于植物光合作用的进行。其中蓝、白光下的处于相对较高水平,与刘晓英[24]的研究结果一致。有研究表明,当光强上升时,空气中的相对湿度较低,此时引起叶片温度和蒸腾速率的上升,与本研究结果一致,但是由于温度过高,植物叶片受到了水分胁迫,诱导植物叶片气孔关闭[27]。而在此文中,杉木幼苗的s随着光强的增强保持稳定的趋势,原因有可能是因为前者是以厚叶木莲为试验材料,而此文是以杉木幼苗为试验对象,两种试验材料的差异性所导致试验结果存在不一致。
光强增加,i降低,表明光强增加可以显著刺激CO2的吸收,光强降低导致植株对CO2的吸收也减少,此结果与李勇等[28]的研究结果相同。CO2是植物进行光合作用的首要因素,杉木幼苗的i也可以影响n的大小,两者之间具有正向关系[17]。本研究中,红光、蓝光、红:蓝(1:1)在弱光强下(≤200 μmol·m-2·s-1)下与CK存在显著差异,前者对杉木幼苗的i具有促进作用,而CK却抑制杉木幼苗的i,这与Zhang等[29]的研究差异较大,原因可能是因为叶片的i受到其他环境因子的影响,所以针对光质影响杉木幼苗的i的研究结果还有待商榷。蒸腾速率是指植物在一定时间内单位叶面积蒸腾的水量,对植物的光合作用具有重要的作用。樊小雪等[30]研究发现蓝光对植物的蒸腾速率具有促进作用,在弱光强下(≤ 200 μmol·m-2·s-1),4种光质处理下的杉木幼苗的r呈现出增长的趋势,且增长幅度较快。在强光强下(≥ 1 500 μmol·m-2·s-1),除白光外,其他光质下的杉木幼苗的r增长速度放缓,表明随着s的稳定,植物的r也随之趋于稳定。当光强处于中等范围时,蓝光、白光、红:蓝(1:1)下r均与红光下杉木幼苗的r有显著性差异,表明红光对植物光合作用产生作用较小。植物的蒸腾速率(r)、气孔导度(s)和光合速率(n)有着密切联系,此结果与张丽[31]的研究结果相同,表明植物的蒸腾速率(r)随着光强的增加而上升。
WUE作为外界环境适应性指标之一,是植物适应能力的表现。WUE越高,植物对外界环境的适应力越强。本研究结果表明,当光强处于弱光程度时,红光处理下杉木幼苗的WUE相较于其他光质而言,处于较高水平,证明在弱光情况下,红光能提高杉木幼苗的适应能力,此结果与周锦业[22]对杉木组培研究结果相同,但是与曹刚等[32]针对黄瓜幼苗的研究结果有较大差异,原因可能是试验中设置的光强不一致。本研究发现红光对杉木幼苗的WUE在各个光强中处于较高位置,特别是在强光强下,杉木幼苗的WUE与n具有正相关关系,说明两者具有相互促进的作用。有研究表明,植物的WUE不同程度上也与i、s有关,本研究中光质对杉木幼苗在8个梯度的光强下的光合参数存在不同的影响效果,为以后室内育苗提供良好的理论基础,一定程度上的红:蓝(1:1)光对杉木的光合参数有促进作用。
杉木利用光能,使二氧化碳和水合成有机物并释放氧气,绝大多数生物依靠光合作用所提供的物质和能量而生存。在可见光中,红光和橙光最容易被植物吸收,而绿光则最不容易被吸收。植物体内的叶绿素和类胡萝卜素在光合作用过程中发挥了重要作用,一般认为蓝紫光对于植物体内叶绿素含量具有促进作用,而植物受红光的影响较小。本研究中红光和红蓝光处理下的叶绿素含量较低的原因可能是杉木受到红光的抑制。叶绿素和类胡萝卜素在光合作用过程中主要承担吸收和传递光能的作用[33]。有研究发现,黄瓜幼苗在红光、蓝光处理下的叶绿素与其他光质处理的结果有显著差异,而类胡萝卜素主要受到蓝紫光的影响[34];通过对菊花[35]和“夏黑”葡萄[36]叶片中的叶绿素含量进行分析,得出红光能提高植物体内叶绿素含量[37],与本文结果一致。张瑞华[38]以生姜作为试验对象,将生姜进行不同光质处理,得出蓝光处理下的叶绿素高于红光处理。本研究中,白光处理使得杉木光合色素的含量最高,红/蓝(1/1)处理最低的结论相反,原因可能是因为试验材料不同,导致试验材料的反应也不一致。
[1] 郑洁, 胡美君, 郭延平. 光质对植物光合作用的调控及其机理[J]. 应用生态学报, 2008, 19(7): 1619-1624.
[2] 刘庆, 连海峰, 刘世琦, 等. 不同光质LED光源对草莓光合特性、产量及品质的影响[J]. 应用生态学报, 2015, 26(6): 1743-1750.
[3] 刘丽, 费裕翀, 路锦, 等. 不同供镁水平对杉木幼苗叶片抗氧化酶活性和叶绿素含量的影响[J]. 江西农业大学学报, 2020, 42(3): 578-586.
[4] RAMALHO J C, MARQUES N C, SEMEDO J N, et al. Photosynthetic performance and pigment composition of leaves from two tropical species is determined by light quality[J]. Plant Biol, 2002, 4(1): 112 -120.
[5] KHATTAK A M, PEARSON S. Spectral filters and temperature effects on the growth and development of chrysanthemums under low light integral[J]. Plant Growth Regul, 2006, 49(1): 61-68.
[6] TALBOTT L D, HAMMAD J W, HARN L C, et al. Reversal by green light of blue light-stimulated stomatal opening in intact, attached leaves of Arabidopsis operates only in the potassium-dependent, morning phase of movement[J]. Plant Cell Physiol, 2006, 47(3): 332-339.
[7] KINOSHITA T, SHIMAZAKI KI. Blue light activates the plasma membrane H(+)-ATPase by phosphorylation of the C-Terminus in stomatal guard cells[J]. EMBO J, 1999, 18(20): 5548-5558.
[8] ROELFSEMA M R, HEDRICH R. In the light of stomatal opening: new insights into ‘the Watergate’[J]. New Phytol, 2005, 167(3): 665-691.
[9] STUEFER J F, HUBER H. Differential effects of light quantity and spectral light quality on growth, morphology and development of two stoloniferousspecies[J]. Oecologia, 1998, 117(1/2): 1-8.
[10] 刘敏玲, 苏明华, 潘东明, 等. 不同LED光质对金线莲生长的影响[J]. 亚热带植物科学, 2013, 42(1): 46-48.
[11] 何蔚. 不同光周期和光质配比对番茄和辣椒苗生长的影响[D]. 杨凌: 西北农林科技大学, 2017.
[12] 吴晓颖, 高华军, 王晓琳, 等. 光照强度对雪茄烟叶片组织结构及内源激素含量的影响[J]. 中国烟草科学, 2021, 42(2): 37-42.
[13] 龚洪恩, 姚小华, 吴鹏飞, 等. LED不同光强对油茶苗生理生化特性的影响[J]. 广西植物, 2019, 39(12): 1599-1604.
[14] 许建民, 史和娣, 史培华, 等. 不同光质条件下马铃薯光响应曲线拟合模型的比较[J]. 浙江农业学报, 2020, 32(5): 753-761.
[15] 白瑞雯, 陈丽, 汤海昆, 等. 不同颜色薄膜覆盖对越橘光合特性的影响[J]. 东北农业大学学报, 2019, 50(4): 37-44.
[16] 钱胜艳, 刘世琦, 刘颖颖, 等. 不同LED光源对辣椒光合特性的影响[J]. 山东农业科学, 2016, 48(9): 54-59.
[17] 柯学, 李军营, 李向阳, 等. 不同光质对烟草叶片生长及光合作用的影响[J]. 植物生理学报, 2011, 47(5): 512-520.
[18] 汪凤林, 林思祖, 叶义全, 等. 杉木幼苗不同光质光响应曲线的模型拟合及光合特性比较[J]. 亚热带农业研究, 2017, 13(3): 165-170.
[19] 郄亚栋, 蒋腊梅, 吕光辉, 等. 温带荒漠植物叶片功能性状对土壤水盐的响应[J]. 生态环境学报, 2018, 27(11): 2000-2010.
[20] 王少先, 李再军, 王雪云, 等. 不同烟草品种光合特性比较研究初报[J]. 中国农学通报, 2005, 21(5): 245-247, 252.
[21] WU Y Y, LIU C Q, LI P P, et al. Photosynthetic characteristics involved in adaptability to Karst soil and alien invasion of paper mulberry ((L.) Vent.) in comparison with mulberry (L.)[J]. Photosynthetica, 2009, 47(1): 155-160.
[22] 周锦业. 基于LED光源的杉木组培快繁技术研究[D]. 福州: 福建农林大学, 2013.
[23] 周娜娜, 冯素萍, 高新生, 等. 植物光合作用的光抑制研究进展[J]. 中国农学通报, 2019, 35(15): 116-123.
[24] 刘晓英. LED光源对樱桃番茄生育和光合作用影响的研究[D]. 南京: 南京农业大学, 2010.
[25] 司建华, 常宗强, 苏永红, 等. 胡杨叶片气孔导度特征及其对环境因子的响应[J]. 西北植物学报, 2008, 28(1): 125-130.
[26] FRECHILLA S, TALBOTT L D, BOGOMOLNI R A, et al. Reversal of blue light-stimulated stomatal opening by green light[J]. Plant Cell Physiol, 2000, 41(2): 171-176.
[27] 孙谷畴, 赵平, 曾小平, 等. 不同光强下生长的厚叶木莲()光合作用光响应的变化[J]. 应用与环境生物学报, 2001, 7(3): 213-218.
[28] 李勇, 于翠, 胡兴明, 等. 桑树与红薯套作模式的群体光合特性研究[J]. 蚕业科学, 2013, 39(6): 1049-1055.
[29] ZHANG D Y, WANG X H, CHEN Y, et al. Determinant of photosynthetic capacity in rice leaves under ambient air conditions[J]. Photosynthetica, 2005, 43(2): 273-276.
[30] 樊小雪, 高文瑞, 孙艳军, 等. 不同光质对小白菜叶片发育和光合作用的影响[J]. 信阳师范学院学报(自然科学版), 2018, 31(4): 562-567.
[31] 张丽. 海南坡垒种群特征及不同光强对其幼苗生长的影响研究[D]. 海口: 海南大学, 2019.
[32] 曹刚, 张帆, 任静, 等. 不同光质LED光源对黄瓜幼苗光合参数、水分利用效率和叶绿体超微结构的影响[J]. 中国沙漠, 2013, 33(3): 765-771.
[33] TONG Z, ZHAO Y J, WANG T, et al.Photoreceptors and light regulated development in plants [J]. Acta Bot Sin, 2000, 42(2): 111-115.
[34] PU G B, LIU S Q, LIU L, et al. Effects of different light qualities on growth and physiological characteristics of tomato seedlings[J]. Acta Horticulturae Sinica, 2005, 32(3): 420-425.
[35] 邸秀茹, 焦学磊, 崔瑾, 等. 新型光源LED辐射的不同光质配比光对菊花组培苗生长的影响[J]. 植物生理学通讯, 2008, 44(4): 661-664.
[36] 余阳, 刘帅, 李春霞, 等. LED光质对‘夏黑’葡萄光合特性和生理指标的影响[J]. 果树学报, 2015, 32(5): 879-884.
[37] ZHANG H, XU Z G, CUI J , et al.Effects of light quality on the growth and chloroplast ultrastructure of tomato and lettuce seedlings[J]. Chinese J Appl Ecol, 2010, 21(4): 959-965.
[38] 张瑞华. 光质与生姜生长发育及光能利用特性的关系[D]. 泰安: 山东农业大学, 2008.
Optical response of photosynthesis of fir seedlings under different light quality conditions
WANG Xingxing1, 2, 4, CHEN Gang3, ZUO Xiaodong1, 2, 4, FAN Fujin5, CAO Guangqiu1, 2, 4, CAO Shijiang1, 2, 4
(1. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002; 2. State Forestry Administration Chinese Fir Engineering Technology Research Center, Fuzhou 350002; 3. Department of Natural Resources of Jiangyong County in Hunan Province, Yongzhou 425000; 4. University Key Laboratory of Forest Stress Physiology, Ecology and Molecular Biology of Fujian Province, Fuzhou 350002; 5. Yangkou State-owned Forest Farm in Fujian Province, Nanping 353200)
In order to explore the effects of 4 light quality treatments on the photosynthetic parameters of Chinese fir seedlings, one-year-old superior clone 020 cutting seedlings were used as experimental materials, 4 light qualities, 8 gradient light intensities were set; through the indoor light quality cultivation, the photosynthetic rate (n), stomatal conductance (s), intercellular CO2concentration (i), transpiration rate (r), water use efficiency (WUE) and other parameters of Chinese fir seedlings were studied, and fitting analysis on light-intensity data was performed to establish a fitting model. The results showed that: under low light conditions, blue light and red: blue (1:1) had significant effects on photosynthetic parameters of Chinese fir seedlings, while under strong light, red light had a significant effect. The photosynthetic rate (n), stomatal conductance (s) and water use efficiency (WUE) of Chinese fir seedlings under red light treatment were different from other light quality treatments, but the intercellular CO2concentration (i) and transpiration rate (r) were slightly lower than those under the blue light, and the difference among the three light quality conditions: blue light, red light and red: blue (1:1) was not significant. In terms of the fit between light intensity and light quality, stomatal conductance (s), intercellular CO2concentration (i), and transpiration rate (r) fitted better. Therefore, to a certain extent, red: blue (1:1) light can promote the photosynthetic parameters of Chinese fir.
lamb.Hook; light quality; light strength; light response
S791.27
A
1672-352X (2022)05-0716-08
10.13610/j.cnki.1672-352x.20221111.022
2022-11-14 11:18:04
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20221111.1118.044.html
2021-10-09
福建农林大学高峰学科项目(71201800739)和“十四五”国家重点研发项目(2021YFD2201302)共同资助。
汪星星,硕士研究生。E-mail:13355632751@163.com
曹世江,讲师。E-mail:csjiang1123@126.com
——记嘉荫县红光乡燎原村党支部

