高温水氨解快速提取人发角蛋白
郭克兵,田浈桢,付艳红,严琬莹,季金苟
(重庆大学 化学化工学院,重庆 401331)
人发、羊毛、兔毛、鸡毛等角蛋白含量丰富,是开发严重不足的蛋白质来源之一。近年来,随着对角蛋白在生物医学领域的研究深入,人们发现不同种属动物来源的角蛋白由于组分的区别,可以产生不同的生物学效应[1]。其中,人发角蛋白由于其是人源性的,具有免疫学方面的优势[2],在植入材料方面具有极大的应用潜力,受到了越来越多的关注。
将人发、羊毛等天然角蛋白材料解聚为线性角蛋白大分子,是制备再生角蛋白材料的前提[3]。人发中的角蛋白是以α-螺旋为主要结构的α-角蛋白,是由氢键、离子键、疏水键、范德华力和二硫键来稳定结构的水不溶性大分子[4-6],难以提取,如何从人发中高效提取并纯化角蛋白是当前学者们普遍关注的问题。目前从人发中提取角蛋白的方法有两种,一种是“Shindai法”,另一种是“还原法”[7-8]。这两种方法均使用有毒的β-巯基乙醇,且提取时间较长。房启海等[9]用熔融尿素法对羊毛角蛋白进行了提取,提取时间在50 min左右,作者认为熔融尿素法之所以可以较快地对羊毛角蛋白进行提取,是高温下尿素分解产生氨气,进入角蛋白结晶区,破坏羊毛角蛋白之间的氢键。
高温水通常是指温度在100 ℃到临界点附近,以及超临界状态时的压缩水。随着温度升高,高温水密度减小,氢键变弱,物质的溶解度增大,这有利于反应物处于同一反应相中,降低反应活化能,提高反应速率[10-11]。因此,本文拟利用高温水能增大物质的溶解度,且氨气有助于破坏角蛋白之间的氢键等原理提取人发角蛋白,以期得到一种提取时间短、对蛋白质破坏小的提取方法。
1 材料与方法
1.1 试剂与仪器
人发,搜集于理发店;聚氧乙烯辛基苯酚醚-10(OP-10),成都科龙化工试剂厂;氢氧化钠、23%氨水、丙烯酰胺、三羟甲基氨基甲烷(Tris),重庆川东化工有限公司;碳酸氢钠,成都市科隆化学品有限公司;十二烷基硫酸钠(SDS),美国Sigma公司;考马斯亮蓝R250、过硫酸铵,上海生工生物工程股份有限公司;醋酸,国药集团化学试剂有限公司。以上所有试剂均为分析纯。蛋白上样缓冲液、彩色预染Marker(11~180 kD),生物试剂,上海源叶生物科技有限公司。实验用水为实验室自制去离子水。
GFK-10-200型水热合成反应釜,上海贝伦仪器设备有限公司;DHG-9033A型电热恒温鼓风干燥箱,沙鹰科学仪器有限公司;MD1444(8 000~14 000 Da)型透析袋,上海源叶生物科技有限公司;GL-21M型高速离心机,湖南湘仪实验室仪器开发有限公司;FD-IA-50型冷冻干燥机,北京博医康实验仪器;Nicolet iS50型傅立叶变换红外光谱仪,美国Thermo Fisher公司;1658001型电泳仪设备,美国Bio-Rad公司;PANalytical X’Pert Powder X射线衍射仪,Spectris公司。
1.2 实验方法
1.2.1 人发预处理
按文献[6,12]的方法,称取一定量人发,剪至0.5~1.0 cm,按1∶2∶2(g∶mL∶mL)的比例向烧杯中依次加入人发、4% OP-10和5% NaOH,使人发浸没于溶液中,室温下搅拌2 h。用去离子水冲洗6次,将其置于60 ℃烘箱过夜干燥,保存待用。
1.2.2 高温水氨解
称取2.0 g已预处理的人发,置于200 mL水热合成反应釜内胆,加入氨水,搅拌均匀,将反应釜放入烘箱,在一定温度下反应一段时间。高温水氨解结束后,在人发反应液中加入50 mL去离子水,室温下搅拌1.5 h,用四号筛网过滤,收集滤液,滤渣干燥称重。按照式(1)计算人发角蛋白溶解率(S):
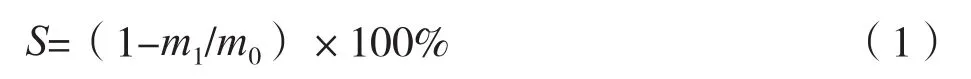
式中,m0为反应前的人发重量,g;m1为水提取后的干燥滤渣重量,g。
单因素条件优化设置如下。(1)温度:氨水用量10 mL,反应时间30 min,反应温度分别设置为175 ℃、180 ℃、185 ℃和190 ℃。(2)氨水用量:反应温度185 ℃,反应时间30 min,选择氨水添加量分别为6 mL、8 mL、10 mL和12 mL。(3)时间:反应温度185℃,氨水用量8 mL,考察反应27 min、30 min、33 min和36 min对实验结果的影响。
1.2.3 透析
将收集的滤液调至pH=7.4,静置后在4 ℃下12 000×g离心20 min,合并上清液。上清液调pH至4.0~4.2,在4 ℃下6 000×g离心20 min。取角蛋白沉淀分散于1 mol/L碳酸氢钠中,放入透析袋(截留分子量3 500 Da)中透析36 h,透析外液为去离子水,每12 h更换一次透析外液。冷冻干燥,得浅黄色粉末。按照式(2)计算人发角蛋白产率(P):

式中,m0为反应前的人发重量,g;m2为冻干后角蛋白粉末的重量,g。
1.2.4 聚丙烯酰胺凝胶电泳(SDS-PAGE)
参照RAMYA等[13]方法并稍作修改。配置12%的分离胶:1.6 mL去离子水、2 mL丙烯酰胺溶液(30%)、1.3 mL的 Tris(pH 8.8,1.5 mol/L)、0.05 mL的SDS溶液(10%)、0.05 mL过硫酸铵(10%)和0.002 mL四甲基乙二胺。5%浓缩胶:2.1 mL去离子水、0.5 mL丙烯酰胺混合溶液(30%)、0.38 mL的Tris(pH 6.8,1.0 mol/L)、0.03 mL的SDS溶液(10%)、0.03 mL过硫酸铵(10%)和0.003 mL四甲基乙二胺。
取20 μL角蛋白样品(15 mg/mL)加入5×上样缓冲液,煮沸10 min。取煮沸冷却后的样品10 μL和Marker 5 μL,上样。80 V电压下进行电泳,待Marker条带出现后,增大电压至110 V,直至电泳分离结束。考马斯亮蓝R250染色,乙醇-醋酸脱色至无背景色。
1.2.5 傅里叶红外光谱(FT-IR)
将溴化钾在红外灯下于研钵中研磨成均匀粉末,再将角蛋白样品与溴化钾以1∶100的比例混合均匀后,研磨成粉。压片机20 MPa压制1~2 min成透明薄片,用FT-IR在4 000~400 cm-1扫描。
1.2.6 粉末X射线衍射(XRD)
取适量角蛋白样品,研磨成细粉,过200目筛,进行粉末X射线衍射测试。
1.3 数据处理
使用GraphPad软件(Insight Science公司)进行统计分析。显著性水平设为α=0.05;用最小显著性差异法检验数据间的差异显著性,用P<0.05表示。
2 结果与分析
2.1 高温水氨解条件的优化
2.1.1 温度
从图1可以看出,温度从175 ℃升高到185 ℃,角蛋白溶解率和产率均逐渐增加;温度升高到190 ℃时溶解率继续增大,但产率反而减少。正常人的毛发主要由表皮层、皮质层和髓质层组成[14]。表皮存在6~12层毛鳞片,像鱼鳞一样硬质透明;皮质层由蛋白细胞和色素细胞组成,占头发的80%左右,是头发的主体。当温度较低时,毛鳞片对抗氨解能力较强,所以在175 ℃时,角蛋白溶解率和产率都较小,升高温度使角蛋白溶解率和产率增大,但当温度超过185 ℃时,角蛋白被进一步降解成小分子量蛋白,从而穿过透析袋进入透析外液,使产率降低。
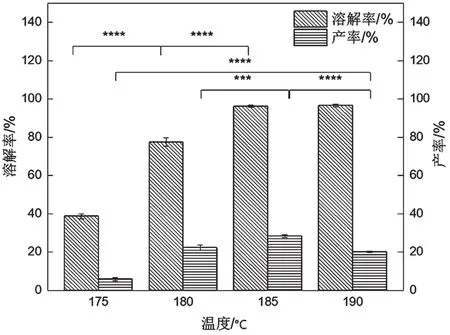
图1 温度对溶解率和产率的影响
从图2可以看出,175~185 ℃时分子量主要分布在25 kDa以下、35~48 kDa、75~135 kDa;190 ℃时凝胶色带不明显。可见在高温氨解体系中,温度控制在185 ℃较为适宜。

图2 温度对分子量分布影响
2.1.2 氨水用量
从图3可以看出,氨水用量为8 mL时产率相对最大。角蛋白产率先增加后下降,是由于随着氨水用量增加,反应釜内压力增加,氨气和高温水的各种理化性质均发生了相应的改变,有利于角蛋白提取率增加,但压力过大可能使角蛋白的分子链降解速率加快,使角蛋白的提取率下降,故氨水用量控制在8 mL比较适宜。从图4可以看出,分子量主要分布于25 kDa以下、35~48 kDa、75~135 kDa。
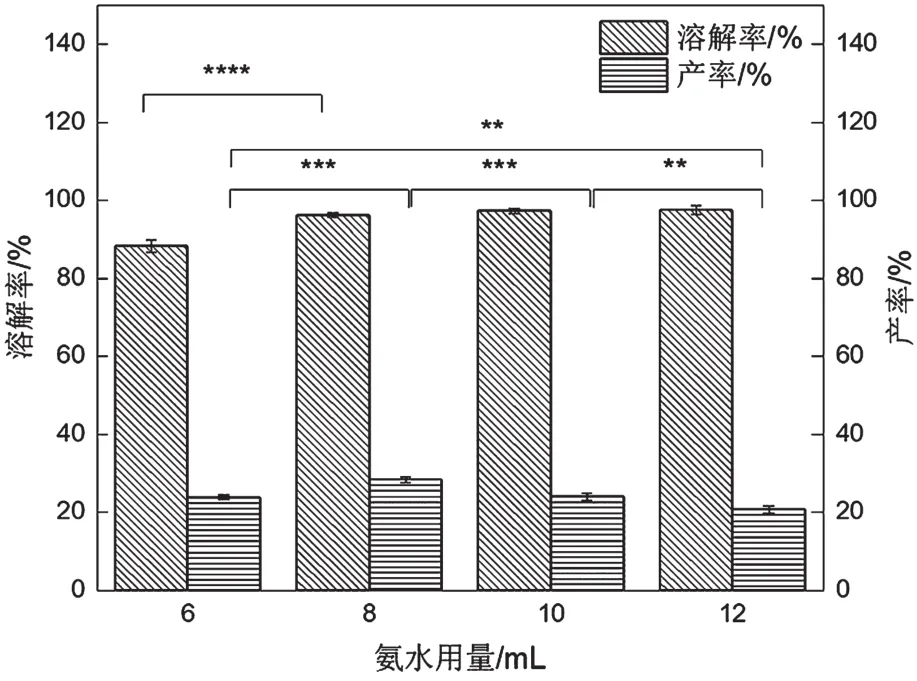
图3 氨水用量对溶解率和产率的影响
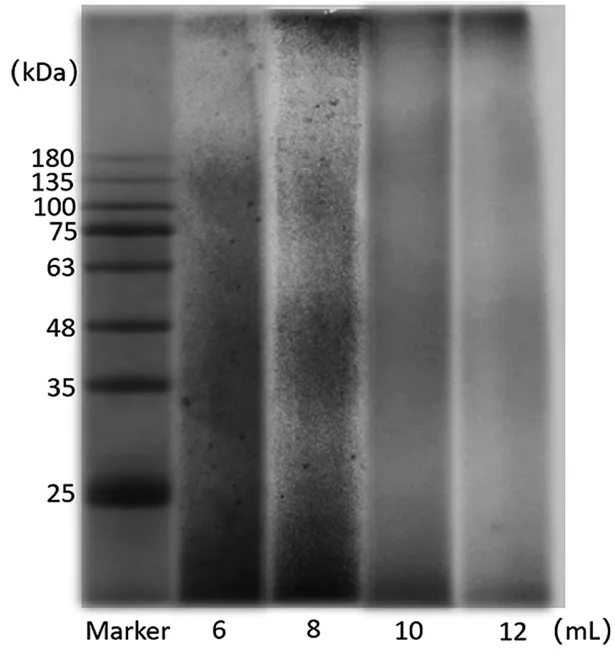
图4 氨水用量对分子量分布影响
2.1.3 时间
从图5可以看出,随着时间的增加,溶解率逐渐增加,产率先增加后下降,至33 min时产率最高,可能是时间过长导致降解过度。从图6可以看出,尽管降解33 min时产率最高,但其分子量主要分布在25 kDa以下,角蛋白的结构被破坏较大,降解30 min时,角蛋白分子量主要分布在25 kDa以下、35~48 kDa、75~135 kDa,产率为28.33%。一般认为高分子量的角蛋白在制备现代生物材料过程中具有显著优势[3],因此氨解30 min较适宜。
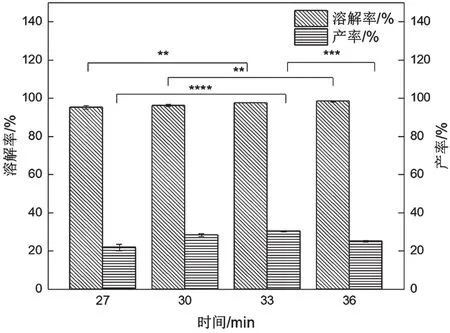
图5 时间对溶解率和产率的影响
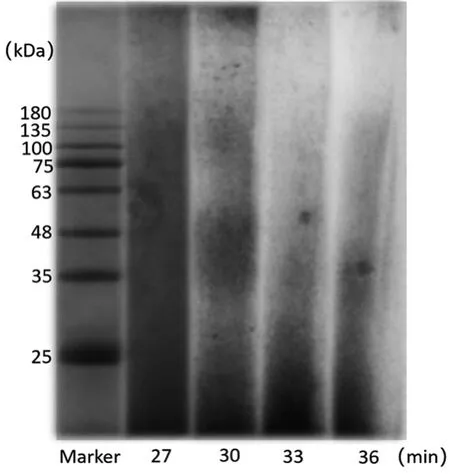
图6 时间对分子量分布影响
2.2 角蛋白的FT-IR分析
从图7可以看出,天然人发纤维与提取的人发角蛋白均具有3 200~3 400 cm-1肽键酰胺A带,1 638~1 657 cm-1的酰胺I带,1 534~1 545 cm-1的酰胺Ⅱ带和1 240~1 245 cm-1的酰胺Ⅲ带,说明两者均具有典型的蛋白质结构[15-16],提取所得角蛋白与天然人发纤维分子结构相同。
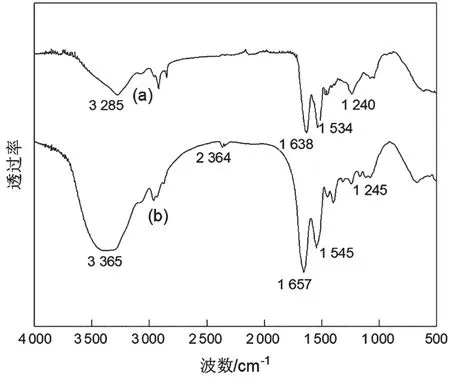
图7 人发纤维(a)与角蛋白提取物(b)的红外谱图
人发纤维在2 364 cm-1左右没有明显的巯基吸收峰,而在提取的人发角蛋白出现此吸收峰,表示反应后巯基增多;和天然人发纤维相比,提取的人发角蛋白中酰胺A带从3 285 cm-1红移到3 365 cm-1,且吸收程度增大、谱带变宽,推测是高温产生的氨气进入角蛋白结晶区,破坏酰胺氢键所致[9];另外,高温和氨水的碱性也易使二硫键、酰胺氢键等断裂或减弱,使A带吸收程度增大、谱带变宽。在提取的人发角蛋白中,酰胺I带和酰胺Ⅱ带的吸收强度相差较大,根据峰的归属可知,酰胺I带为νC=O伸缩振动,酰胺Ⅱ带为νN-H伸缩振动及δN-H弯曲振动,因为C=O键和N-H键都受角蛋白中的酰胺氢键严重影响,可见,高温氨解对νC=O伸缩振动的吸收程度影响更大。反应前后的峰图中没有明显杂峰,可初步判断提取过程中基本未引入杂质。
2.3 角蛋白的XRD分析
图8为角蛋白提取物和人发纤维的XRD图谱。角蛋白在9°和20°左右存在两个特征峰,9°的峰(结晶Ⅰ区)归属于α-螺旋和β-折叠,20°左右的峰(结晶Ⅱ区)则归属于β-折叠[17]。与人发纤维相比,角蛋白提取物9°的峰不明显,20°左右对应的峰弱化,表明晶体化程度降低,提取过程破坏了角蛋白二级结构中部分α-螺旋和β-折叠。
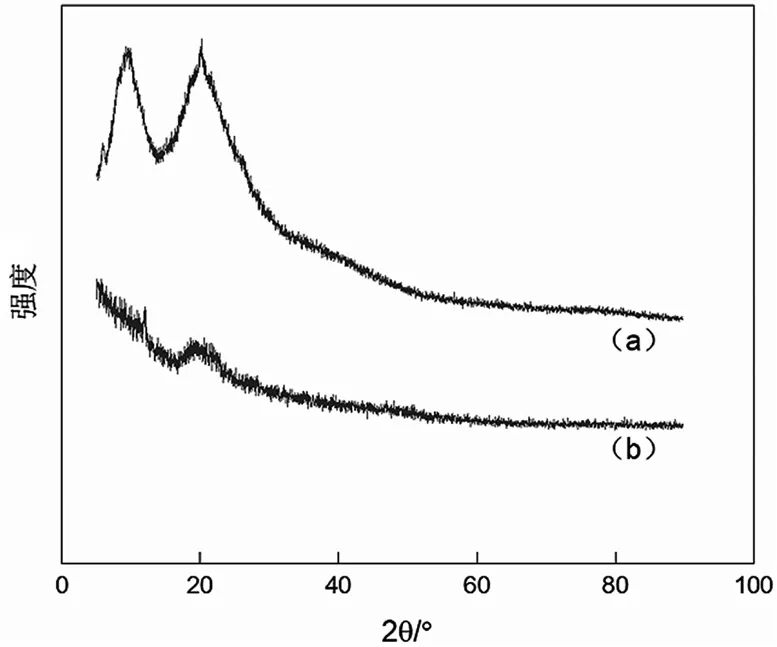
图8 人发纤维(a)与角蛋白提取物(b)的X射线衍射图
3 结论
本文采用高温水氨解的方法对人发角蛋白进行了提取,结果表明,在185 ℃、8 mL氨水、降解30 min条件下,可获得分子量分布在25 kDa以下、35~48 kDa和75~135 kDa的角蛋白,分子量破坏较小。XRD显示,所得角蛋白晶体化程度降低,提取过程破坏了人发角蛋白二级结构中的α-螺旋和β-折叠;FT-IR可以看出,提取所得角蛋白具有典型的蛋白质结构,且与天然人发纤维分子结构相同,提取时氨气进入角蛋白结晶区,破坏酰胺氢键,二硫键断裂或减弱,使提取时间大大加快。研究表明,高温水氨解是一种快速提取人发角蛋白的较好方法。

