高效液相色谱法同时测定首乌叶中3个黄酮苷的含量
吴静,曹明原,2,曾金国, 谢传奇,顾震,吴磊,2*,徐敢珍
(1.江西省科学院应用化学研究所,江西南昌 330096;2.江西农业大学 食品科学与工程学院,江西南昌 330045;3.江西新世嘉农业科技有限公司,江西宜春 336000)
何首乌(Polygonum multiflorumThunb.),又称多花蓼、夜交藤,其叶也称为首乌叶,为蓼科(Polygonaceae)何首乌属(Fallopia Adans.)藤本植物[1],生长于山间林下,在我国河南、广东、江西、广西、四川以及贵州等地均有广泛的种植,是民间的一种常用补益中药。何首乌性甘、平;归心、肝经,具有养血安神、延年益寿、强筋健骨的功效[2]。现代药理学表明,何首乌具有抗氧化、抗癌、乌发及神经镇定等活性,其对阿兹海默症、失眠、糖尿病及心脑血管病均有一定的治疗效果[3-7]。
何首乌含有丰富的化学成分,包括二苯乙烯类、黄酮类、酚类、萜类以及醌类等化学成分,这些成分与其生物活性有着密切的关系[8-10]。目前,有关何首乌块根的化学成分及含量测定已有大量学者进行了研究,尤其是对何首乌块根中的二苯乙烯苷及蒽醌类含量的研究,其评价标准与质量控制体系已相当完善。而何首乌的采后剩余部分如首乌叶中的化学成分分离及其含量测定,却鲜有报道,同时也存在着研究不够深入、缺乏相应评价标准等问题。王芳等[11]对贵州省何首乌不同部位的成分进行检测,结果在首乌叶中未检测出二苯乙烯苷,同时蒽醌类化合物的含量也极低(仅有0.01%),表明何首乌叶的化学成分与块根有较大差异。因此,进行首乌叶有效成分的分离纯化及质量控制方法研究,对于完善该鉴定体系尤为重要。江西省产品质量监督检测院曾对江西省种植区域内的首乌叶中的总黄酮含量进行了检测,结果表明首乌叶中总黄酮含量约为1%,含量较高,有进一步研究的价值[12]。本实验从首乌叶中首次分离纯化得到了杨梅苷、槲皮苷及阿福豆苷3种黄酮苷类化合物,杨梅苷与槲皮苷在抗氧化及抗炎等方面均有较强的活性[5],具有成为首乌叶中质量标志物的潜力。本研究在化学成分分离的基础上,建立HPLC法同时测定首乌叶中3个黄酮苷类成分含量的方法,以期为建立首乌叶质量评价标准并完善其质量控制体系提供理论依据。
1 材料与方法
1.1 仪器与设备
RE52CS-1旋转蒸发器、B-260恒温水浴锅,上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;DLSB-10L/10低温冷却液循环泵,巩义市予华仪器有限责任公司;KQ-500DB型数控超声波清洗器,昆山市超声仪器有限公司;ME204E电子天平,梅特勒-托利多仪器有限公司;Milli-Q® IQ Element超纯水器,法国密里博公司;S-501高效液相色谱仪,德国赛卡姆公司;AV-400型核磁共振仪,瑞士Bruker公司。
1.2 试剂与材料
对照品:杨梅苷(纯度95.9%)、槲皮苷(纯度97.0%)、阿福豆苷(纯度96.7%),均由本实验从何首乌叶中分离纯化得到;甲醇、乙腈均为色谱纯,德国Sigma公司;乙醇、乙酸乙酯,分析纯,天津致远化学股份有限公司;CHP20/P120 MCI凝胶,日本三菱化学公司;水为超纯水。
8批药材由江西新世嘉农业科技有限公司采收并提供,经江西省科学院应用化学研究所鉴定均为何首乌叶,具体信息如表1所示。

表1 样品信息
1.3 实验方法
1.3.1 提取与分离
将何首乌叶彻底干燥后粉碎,取粉碎后的何首乌叶10 kg,料液比1∶20 (g∶mL)加入70%的乙醇超声(400 W,25 min)重复提取2次,之后进行抽滤,旋转蒸发,减压浓缩后得到何首乌叶乙醇粗提物(1.745 kg),将粗提物加入适量水混合后,用乙酸乙酯进行萃取,之后经过旋转蒸发、减压浓缩后得到乙酸乙酯萃取部位浸膏(149.71 g)。乙酸乙酯部位经MCI中高压色谱柱(10%甲醇-100%甲醇梯度洗脱)得到5个部分,其中30%甲醇洗脱部分经半制备高效液相色谱分离得到化合物1(27.91 mg,tR=18.07 min)、化合物2(32.47 mg,tR=20.61 min)和化合物3(9.05 mg,tR=24.39 min)。
1.3.2 HPLC色谱条件
色 谱 柱 为SHIMADZU Shimpack GIST C18柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-水(B),梯度洗脱程序(0~10 min,15%A;10~13 min,15%A → 25%A;13~ 35 min,25%A);柱温35 ℃;流速1.0 mL/min;检测波长350 nm;进样量10 μL。
1.3.3 溶液制备
(1)混合对照品溶液的制备。杨梅苷、槲皮苷及阿福豆苷对照品均由本次实验分离得到(经ESI-MS及NMR结构鉴定,分别对应化合物1、化合物2及化合物3),经HPLC峰面积归一化法得出杨梅苷、槲皮苷及阿福豆苷纯度分别为95.9%、97.0%、96.7%。准确称量杨梅苷、槲皮苷、阿福豆苷对照品适量,加入甲醇配制成每1 mL分别含杨梅苷400 μg、槲皮苷200 μg和阿福豆苷200 μg的混合对照品溶液。
(2)供试品溶液的制备。将何首乌叶烘干,粉碎过筛后,准确称取干燥的何首乌叶粉末0.1 g,精密加入100%甲醇溶液10 mL,称定质量,超声提取25 min(功率400 W,频率40 kHz),放冷,并用100%甲醇补足损失的量,摇匀后过0.45 μm微孔滤膜。取续滤液,即得供试品溶液[13]。
看到孩子眼中的热爱,也看到孩子身上的天赋,振宇的爸爸一咬牙,在自己的工作室打造了一个小小的“实验室”,配备了各种设备仪器,方便振宇进行各种实验,实现脑中的“奇思妙想”。在爸爸的大力支持和温暖陪伴下,小振宇获得了更多机会去接触和探索科技世界。就这样,一颗充满无限可能性的种子渐渐发芽……
1.3.4 方法学考察
(1)专属性实验。取“1.3.3”项下混合对照品溶液和供试品溶液,按“1.3.2”项下HPLC色谱条件进行进样分析。
(2)线性关系考察。精确量取混合对照品溶液适量,按一定比例稀释并配制成6.25 μg/mL、12.50 μg/mL、25 .0 0μg/mL、50.00 μg/mL、80 .00 μg/mL、100 .00 μg/mL和200.00 μg/mL溶液,按照“1.3.2”的色谱条件进行进样分析测定。以峰面积为纵坐标(Y),以质量浓度为横坐标(X),绘制标准曲线。
(3)精密度实验。取“1.3.3”项下混合对照品溶液,连续进样6次,按照“1.3.2”的色谱条件进行进样分析测定。
(4)重复性实验。取同一批何首乌叶样品(S1),按“1.3.3”项方法制备6份供试品溶液,并按照“1.3.2”的色谱条件进行进样分析测定。
(5)稳定性实验。取同一份供试品溶液,分别在0 h、3 h、6 h、9 h、12 h和24 h进样,按照“1.3.2”的色谱条件进行进样分析测定。
(6)加样回收率实验。取同一批号已知含量样品(S1)9份,准确称取每份0.1 g,分别精密加入浓度为400 μg/mL的杨梅苷对照品溶液0.25 mL,浓度为200 μg/mL的槲皮苷对照品溶液和阿福豆苷对照品溶液各0.5 mL,定容至10 mL,按照“1.3.2”的色谱条件进行进样分析测定,计算3个成分的平均回收率与RSD值。
2 结果与分析
2.1 结构鉴定
化合物1:黄色粉末(甲醇),C21H20O12;1H-NMR(400 MHz, DMSO-d6):δ 0.84 (3H,d,J=6.2 Hz,H-6”),3.17(1H,m,H-4”),3.40(1H,m,H-5”),3.57(1H,dd,J=9.2,3.0 Hz,H-3”),3.98(1H,brs,H-2”),5.20(1H,d,J=1.0 Hz,H-1”),6.20(1H,d,J=1.9 Hz,H-6),6.37(1H,d,J=1.9 Hz,H-8),6.88 (2H,s,H-2’,6’);13C-NMR(100 MHz,DMSO-d6):δ 17.99(C-6”),70.47(C-2”),70.84(C-3”),71.01(C-5”),71.72(C-4”),93.97(C-8),99.11(C-6),102.38(C-1”),104.49 (C-10),108.35(C-2’,6’),120.06(C-1’),134.72(C-3),136.90(C-4’),146.22(C-3’,5’),156.85(C-9),157.94(C-2),161.76(C-5),164.61(C-7),178.23(C-4)。以上数据与文献[14]报道基本一致,故鉴定化合物1为杨梅苷。
化合物2:黄色粉末(甲醇);C21H19O11;1H-NMR(400 MHz,DMSO-d6):δ 0.83 (3H,d,J=6.1 Hz,H-6”),3.17(1H,t,J=9.4 Hz,H-4”),3.40(1H,m,H-5”),3.53(1H,dd,J=9.1,3.3 Hz,H-3”),3.99(1H,brs,H-2”),5.26(1H,s,H-1”),6.22(1H,s,H-8),6.41(1H,s,H-6),6.86(1H,d,J=8.3 Hz,H-5’),7.25(1H,dd,J=8.3,2.1 Hz,H-6’),7.31(1H,d,J=2.1 Hz,H-2’);13C-NMR(100 MHz,DMSO-d6):δ 17.96(C-6”),70.04(C-3”),70.51(C-5”),70.80(C-2”),71.63(C-4”),94.08(C-8),99.14(C-6),102.28(C-1”),104.53(C-10),115.91(C-2’),116.10(C-5’),121.17 (C-1’),121.56 (C-6’),134.66(C-3),145.65(C-3’),148.89(C-4’),156.89(C-2),157.75(C-9),161.74(C-5),164.64(C-7),178.19(C-4)。以上数据与文献[14]报道基本一致,故鉴定化合物2为槲皮苷。
化合物3:黄色粉末(甲醇),C21H20O10;1H-NMR(400 MHz,DMSO-d6):δ 0.78 (3H,d,J=6.0 Hz,H-6”),3.11(1H,t,J=9.2 Hz,H-4”),3.39(1H,m,H-5”),3.46(1H,dd,J=9.0,2.9 Hz,H-3”),3.98(1H,brs,H-2”),5.30(1H,s,H-1”),6.22(1H,s,H-6),6.42(1H,s,H-8),6.91(2H,d,J=8.7 Hz,H-3’,5’),7.77(2H,d,J=8.7 Hz,H-2’,6’);13C-NMR(100 MHz,DMSO-d6):δ 17.92(C-6”),70.52 (C-5”),70.77(C-4”),71.07(C-2”),71.55(C-3”),94.21(C-8),99.21(C-6),102.23(C-1”),104.52(C-10),115.84(C-3’,5’),120.95(C-1’),131.04(C-2’,6’),134.63(C-3),150.45(C-4’),156.95(C-2),157.66(C-9),161.72(C-5),164.82(C-7),178.14(C-4)。以上数据与文献[14]报道基本一致,故鉴定化合物3为阿福豆苷。
2.2 专属性实验结果
本实验前期采用了DAD检测器对这3个黄酮苷进行全波长扫描,发现其在波长350 nm处吸收较好,故选择波长为350 nm。同时考察了甲醇-水、甲醇-0.1%乙酸、乙腈-水以及乙腈-0.1%乙酸等流动相系统,结果表明添加乙酸的情况下,峰形无明显变化;使用甲醇-水系统时,出峰时间较长,若增大甲醇浓度则导致目标峰与前面杂峰相连,分离度较低;使用乙腈-水系统时,出峰时间缩短且目标峰周围也无其他杂峰的干扰,峰的分辨率及分离度均较好,故选择乙腈-水作为流动相。
专属性实验结果如图1所示,在上述选用的条件下,目标峰与相邻峰的分离度均大于1.5,表明各成分分离效果理想,且理论塔板数不低于3 000。

图1 混合对照品和何首乌叶供试品色谱图
2.3 标准曲线测定结果
如表2所示,杨梅苷、槲皮苷和阿福豆苷分别在 25.00~ 400.00 μg/mL,6.25~ 200.00 μg/mL,6.25~200.00 μg/mL质量浓度范围内线性关系良好。

表2 各成分线性关系
2.4 精密度实验结果
如表3所示,根据HPLC测得的杨梅苷、槲皮苷和阿福豆苷的峰面积,计算得出峰面积RSD分别为1.19%、0.96%、0.71%,表明该实验仪器精密度良好。

表3 精密度实验结果
2.5 重复性实验结果
如表4所示,将HPLC测得的峰面积代入各成分标准曲线得到杨梅苷、槲皮苷和阿福豆苷的平均含量分别为9.447 mg/g、8.712 mg/g、5.160 mg/g,RSD分别为1.77%、1.02%、1.23%,表明本方法重复性良好。
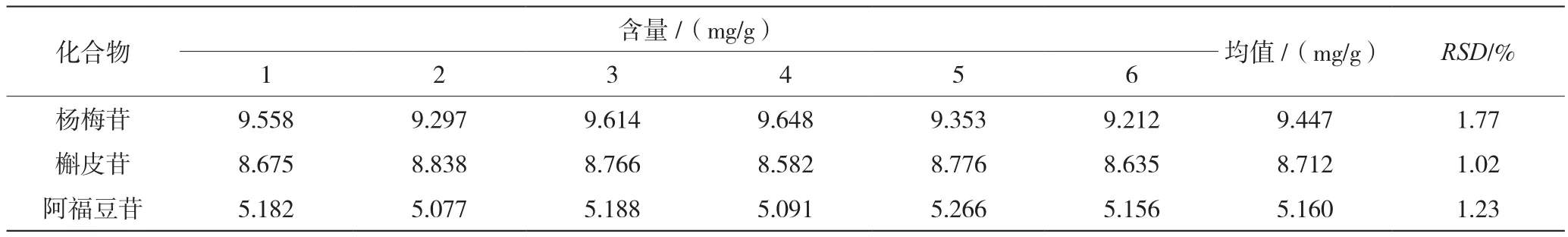
表4 重复性实验结果
2.6 稳定性实验结果
如表5所示,杨梅苷、槲皮苷和阿福豆苷峰面积的RSD分别为1.30%、1.31%、1.06%,表明供试品溶液中杨梅苷、槲皮苷和阿福豆苷在24 h内稳定。

表5 稳定性实验结果
2.7 加样回收率实验结果
如表6所示,杨梅苷、槲皮苷和阿福豆苷的加样平均回收率分别为99.49%、97.29%、97.57%;RSD分别为1.26%、1.91%、1.88%,表明所建立的方法可行。

表6 加样回收率实验结果(n=9)
2.8 样品含量测定结果
不同采收期的样品含量测定结果如表7所示,本次实验测得不同采收期的首乌叶中杨梅苷、槲皮苷及阿福豆苷含量分别为1.269~19.340 mg/g、1.068~16.840 mg/g、0.775~6.921 mg/g。不同采收期的首乌叶中的黄酮苷类含量差异较大,尤其是在清明节后(4月)采收的首乌叶中,其杨梅苷与槲皮苷含量相对较高,而6月份采收的首乌叶中杨梅苷、槲皮苷及阿福豆苷的含量均最低,且与其他月份差异明显,这些差异可能和生长期、日照时间及降雨量等因素有关。日照与降水会影响植物的生长发育与光合作用,从而影响其有机物及次生代谢产物等的生成与积累[15]。江西4月份气温及光照强度适中,且有一定的降雨量,可能更有利于黄酮类化合物的产生,而6月份日照强度高且多雨,这种高温强光高湿的环境可能抑制了杨梅苷及槲皮苷等黄酮类次生代谢产物的生物合成及代谢通路,降低了该类产物的积累。8月份采收的何首乌叶中杨梅苷含量最高,槲皮苷和阿福豆苷含量相对较高,这可能与气候、植物生长环境等综合因素影响有关。因此,建议在4月和8月进行首乌叶的采收,以获得更高黄酮含量的首乌叶。
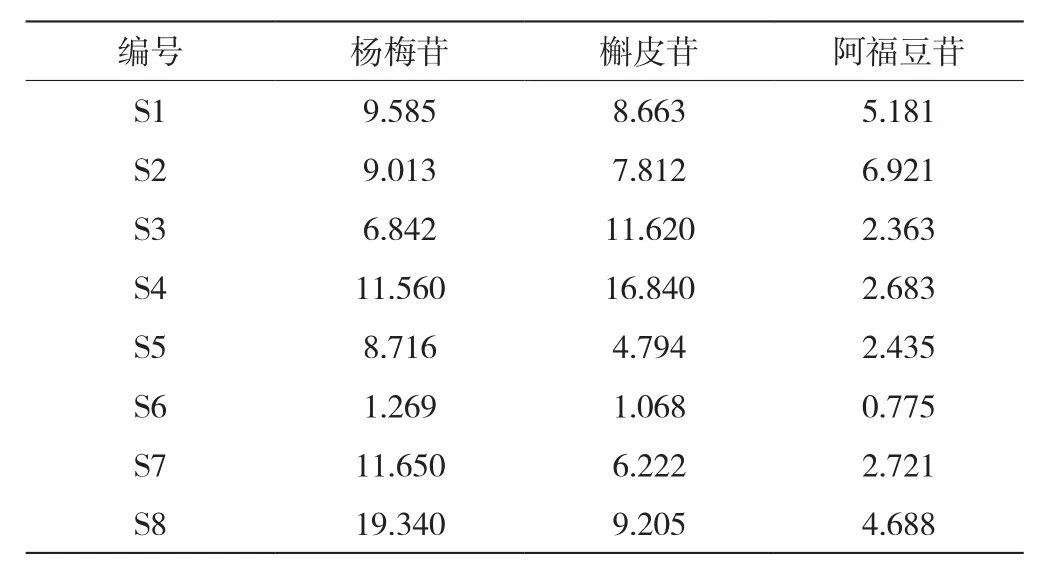
表7 含量测定结果(单位:mg/g)
萹蓄和何首乌同属蓼科植物,其杨梅苷含量为1.611~4.370 mg/g,槲皮苷含量为0.432~1.480 mg/g,均明显低于首乌叶中的含量[16]。侧柏叶中的黄酮类化合物为其主要成分,罗世恒等[17]采用HPLC法测定了不同采集期及不同产地侧柏叶中杨梅苷和槲皮苷的含量,结果表明杨梅苷与槲皮苷的含量分别为0.587~1.420 mg/g和1.924~6.041 mg/g,也远低于其在首乌叶中的含量。这些研究均表明首乌叶中的黄酮类化合物含量较高,尤其是杨梅苷及槲皮苷的含量,同时杨梅苷与槲皮苷也有着较强的抗氧化及抗炎活性[5]。综上,建议将杨梅苷与槲皮苷作为首乌叶质量控制的指标性成分。
3 结论
本文考察了江西宜春地区不同月份的何首乌叶中杨梅苷、槲皮苷和阿福豆苷的含量,结果发现,4月和8月杨梅苷、槲皮苷和阿福豆苷的含量相对较高,可集中进行采收;此外,本实验首次从首乌叶中分离得到杨梅苷、槲皮苷及阿福豆苷3个黄酮苷,建立了HPLC法同时测定何首乌叶中杨梅苷、槲皮苷和阿福豆苷含量的方法,该方法操作简单、重现性高、结果准确、专属性强,可考虑用于首乌叶质量检测的方法。

