糖尿病下肢动脉病变诊断方法的现状与展望
杨宇祥 史壮志 张 甫 张林杉 朱 艳 李中林
1(湖南师范大学工程与设计学院,长沙 410081)
2(复旦大学附属中山医院内分泌科,上海 200032)
3(湖南师范大学第一附属医院内分泌科,长沙 410005)
4(湘潭糖尿病医院,湖南湘潭 411100)
引言
糖尿病(diabetes mellitus,DM)是一种因体内胰岛素水平异常引起的慢性代谢性疾病,其原因是胰岛素分泌绝对或相对不足,或体内细胞不能有效利用胰岛素而导致高血糖[1]。2016年世界卫生组织(World Health Organization,WHO)发布的第一份“全球糖尿病报告”称,至2014年全球糖尿病患病人数已达4.22 亿人,占全球总人口的8.5%[2]。2019年国际糖尿病联盟(International Diabetes Federation,IDF)发布的全球糖尿病地图表明:全球有4.63 亿糖尿病患者,中国糖尿病患者占其中的四分之一,约为1.298 亿,居全球首位[3]。根据IDF 的估计,到2030年全球糖尿病患病人数将增至5.52亿,而到2040年将增至6.42 亿[4]。糖尿病可引发心、脑、肾、眼、足等多器官并发症[5],是继肿瘤和心脑血管疾病之后第3 大威胁人类健康的重大非传染性疾病[6]。
糖尿病并发症包括微血管和大血管病变,是导致糖尿病患者致残、致死的主要原因[7]。在糖尿病所引发的各种并发症中,糖尿病足是最严重且治疗费用最多的慢性并发症,而下肢动脉病变(lowerextremity arterial disease,LEAD)是引发糖尿病足的主要危险因素之一[8-9]。由于该病变早期症状隐匿,且缺少有效检测方法,极易漏诊,导致其患病率居高不下。因此,早期诊断成为降低糖尿病下肢动脉病变(DM-LEAD)发病率的关键。文中系统回顾现有各种用于DM-LEAD 的诊断方法,对比各自优势与不足,并根据最新的研究成果展望了未来糖尿病下肢动脉病变诊断方法的发展趋势及突破路径。
1 下肢动脉病变概述
下肢动脉病变(LEAD) 是外周血管病变(peripheral vascular disease,PVD)或外周动脉病变(peripheral arterial disease,PAD)[10]的主要形式,是指由于下肢一条或多条动脉部分或完全阻塞引起的一种临床病变及其导致下肢功能持续衰退或致残[11]。据文献报道,2010年全球确诊的LEAD 病例为2.02 亿[12]。在LEAD 的几个主要致病危险因素中,糖尿病排第二位,仅次于吸烟[13]。最新文献表明,全世界糖尿病相关下肢并发症的人数约有1.31亿,占全球人口的1.8%[14]。在糖尿病患者中,LEAD 既是引发糖尿病足的主要危险因素,也是截肢和致死的主要原因之一[15]。2020年IDF 表示,世界上每30 s 就有1 名糖尿病患者因LEAD 而施行截肢手术[16]。
由于当前LEAD 的检查方法与诊断标准的不同,加上地域、种族、年龄及生活方式的差异,LEAD在全世界不同人群中的患病率报道存在较大差异[13],且随着年龄的增长LEAD 的患病率会逐年增加[15]。踝肱指数(ankle-brachial index,ABI)是目前被普遍采用的测定指标,一般以ABI≤0.90 作为LEAD 的诊断标准。以此为标准,在1999-2000年美国健康与营养检查中,美国40 岁以上成年人的LEAD 患病率为4.3%,70 岁以上人群的LEAD 患病率为14.5%[17];而1999-2004年美国国家健康和营养检查结果则显示,美国40 岁以上成年人的LEAD患病率为5.9%[18];一项在英国开展的研究显示,55至74 岁人群的LEAD 患病率为9%[19]。
研究表明,糖尿病患者的LEAD 患病率是非糖尿病患者的2~7 倍[13]。在多个不同国家开展的针对糖尿病患者的LEAD 筛查研究中,LEAD 患病率分别为8.52%[20]、13%[21]、13.98%[22]、14%[23]、18.3%[24]、20%[25]、30.7%[26]、31.6%[27]。一项统计德国6880 例65 岁以上人口的研究发现,糖尿病患者的LEAD 患病率高达26.3%,而在非糖尿病人群中仅为15.3%[28];尼日利亚一项对比研究也表明,糖尿病和非糖尿病人群的LEAD 患病率分别为22.0%和8.0%[29]。另有一项比较研究称,糖尿病患者的LEAD 患病率介于20%至50%之间,而非糖尿病患者的LEAD 患病率介于10%至26%之间[30]。
我国的糖尿病患者已超1 亿人,居全球首位[31]。由北京大学人民医院纪立农教授发起的糖尿病下肢动脉病变筛查研究项目(China-DiaLEAD)调查结果显示,我国糖尿病患者LEAD 的总患病率为21.2%[32];国内多中心研究资料显示我国50 岁以上糖尿病患者并发LEAD 的比例为19.5%,单中心研究显示60 岁以上糖尿病患者并发LEAD 的比例为35.4%[33]。由此可知我国糖尿病患者罹患LEAD 的人数之众。
据调查统计,在全世界超过2 亿的LEAD 患者中,约三分之二的患者无症状[34]。与非糖尿病LEAD 相比,糖尿病合并LEAD 更易发生在肢体末端,早期无症状或症状不典型的患者比例也更高[35]。糖尿病下肢动脉病变早期症状隐匿,且多数合并有糖尿病周围神经病变(diabetic peripheral neuropathy,DPN),导致病人对疼痛的感觉迟钝,往往要发展到晚期出现间歇性跛行、静息痛、溃疡和坏疽等不可逆性的严重后果后才被发现[36],因此糖尿病下肢动脉病变长期保持高发病率、高致残率和高病死率,以及低诊断率、低治疗率和低知晓率[37]。且与非糖尿病LEAD 相比,糖尿病LEAD 的发病年龄更早、病变更广泛、病情更严重、预后更差,截肢率与死亡率更高,但由于早期诊断的缺失,LEAD 仍然被临床诊断所忽略[15]。
早期诊断是降低糖尿病LEAD 患病率的关键。有报告显示,85%由糖尿病足导致的截肢可通过早期预防而避免[38]。另一项统计分析表明,在无症状阶段对糖尿病下肢动脉病变进行治疗是非常有益的,特别是在减轻不同级别血管动脉粥样硬化的常见风险因素方面,具有长期的医疗成本效益[16]。早期诊断一方面可以判别病变的发生及其进程,便于确定相应干预,从而延缓甚至避免下肢动脉病变的发生,进而控制糖尿病足的发生发展,降低截肢率;另一方面针对阳性结果可对症治疗,并有助于减少发生心脑血管疾病如冠心病、脑卒中的危险,降低病死率[39]。
如图1 所示,目前诊断下肢动脉病变的常规方法大致可以分为三大类型:(1)主观评测法,以足部脉搏触诊、量表分级法与皮肤温度检查为代表;(2)影像学检测法,包括有创的数字减影血管造影(digital subtraction angiography,DSA)、CT 血管造影(computed tomography angiography,CTA),无创的彩色多普勒超声(color doppler ultrasound,CDU)、磁共振血管造影(magnetic resonance angiography,MRA),以及新兴的激光多普勒微循环血流检测技术(laser doppler flowmetry,LDF)、激光散斑微循环血流成像技术(laser speckle contrast imaging,LSCI)等;(3)生理参数检测法,以经皮氧分压(transcutaneous oxygen pressure,TcPO2)、分段血压测量(segmental limb pressure,SPL)、踝肱指数(ABI)及脉搏波速度(pulse wave velocity,PWV)为代表。
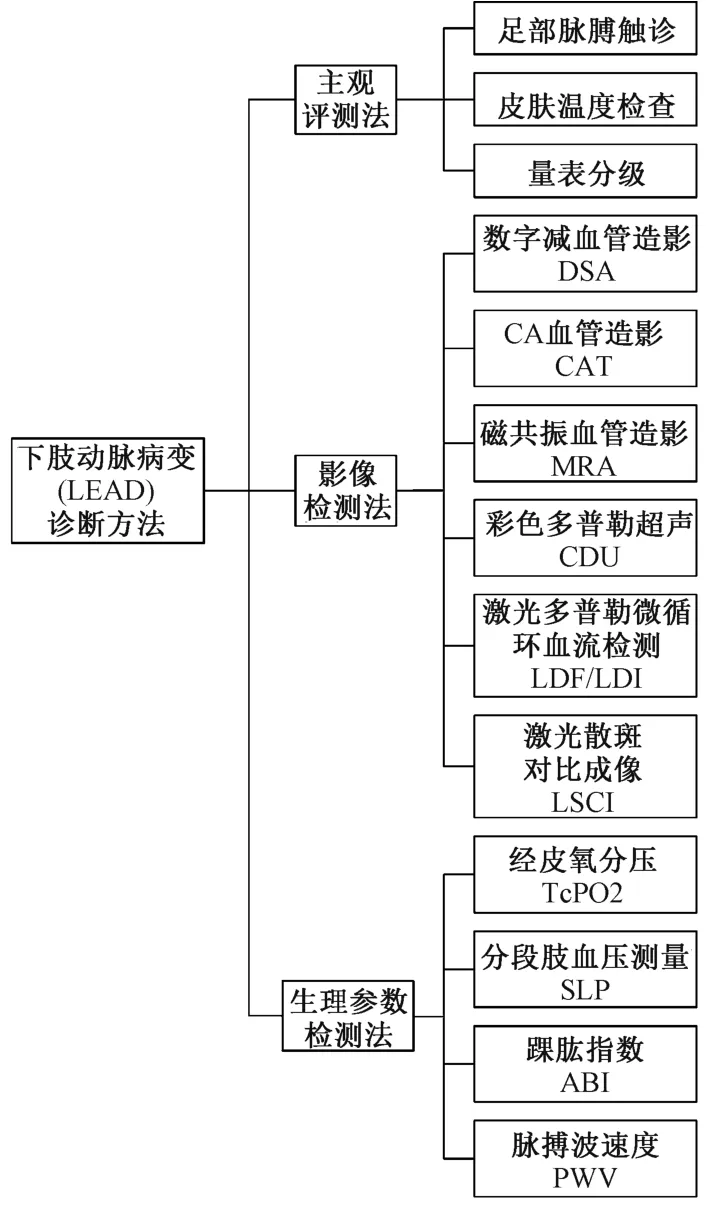
图1 现有的下肢动脉病变(LEAD)诊断方法分类结构Fig.1 Classification structure of the present diagnostic methods for lower extremity arterial disease (LEAD)
2 主观评测法
2.1 足部脉搏触诊法
足部脉搏触诊(足底远端、胫后动脉、腘动脉和股动脉)是一种简单廉价的临床检查,也方便用于患者自助监测。美国糖尿病协会(American Diabetes Association, ADA)建议针对所有糖尿病患者应首先且系统地应用脉搏触诊,作为LEAD 的初步筛查[40]。有研究显示,脉搏异常与足部缺血症状有显著的相关性[41]。但因存在假阳性,脉搏触诊也备受质疑,因为即使没有血管疾病,足背脉搏也可能消失[11];此外它还依赖于医生的经验和检查条件[42]。
2.2 皮肤温度检查法
皮肤温度变化是皮肤灌注、环境温度、组织炎症反应等多方面因素共同作用的结果,与LEAD 的发生和发展有一定相关性。自我检测或临床初检,可采用简单的手触法皮温检查,即通过检查者以同一只手背接触双下肢同水平面对应部位,判断两侧有无明显温度差别。目前,主流方法是使用红外线皮温测量仪测试皮温,无需接触患者皮肤。不同研究对皮温差阳性的界值定义有较大差别。柴萌等[43]以差别1℃以上判定为皮温减低,与DSA 相比,患肢皮温测定的准确度为87.2%,敏感度为87.9%,特异度为83.3%。李虎山等[44]以彩色多普勒超声检查为标准,采用皮温检查判断下肢血管狭窄情况,得到皮温差界值最佳临界点为6.35 ℃,此时皮温测量的灵敏度为72%,特异度为60%,准确度为66%。可见不同皮温差界值的诊断效果差异较大。此外,该方法测量的是小范围的皮温,可能会遗漏皮温异常区域。目前,皮温测量并未被ADA和国际糖尿病足工作组(International Working Group on the Diabetic Foot,IWGDF)及《中国2 型糖尿病防治指南》[45]推荐[46]。
2.3 量表分级法
LEAD 的临床表现可以根据传统的Fontaine 或Rutherford 分类进行评估[47],此两种分类多强调间歇性跛行和静息痛等症状表现,而2017年欧洲心脏病学会(European Society of Cardiology, ESC)发布的《外周动脉疾病诊断与治疗指南》[48]则进一步强调了“隐匿性LEAD”(masked LEAD)的概念,开始重视针对大多数无典型症状患者的诊断[49]。鉴于糖尿病患者接受慢性肢体缺血治疗的比例不断增加,美国血管外科学会(American Society for Vascular Surgery, SVS)根据影响截肢风险的3 个主要因素:创伤、缺血和足部感染,提出了一种新的伤口/缺血/足部感染(wound/ischemia/foot infection,WIfI)分类系统,目的是为下肢受威胁的患者提供准确的风险分层,协助临床管理[50]。WIfI 分类可能会在未来的LEAD 临床评估中获得普及,但它主要针对下肢已经出现明显缺血损伤症状的情况,并不适合用于LEAD 的更早期诊断。
3 影像检测法
3.1 数字减影血管造影
数字减影血管造影(DSA)通过计算机技术与血管造影技术相结合,动态观察对比剂在血管中通过的全过程,可清晰显示下肢血管的狭窄、栓塞所在的部位,异常斑块的位置、大小、形态,并且对于侧支细小血管具有较高的分辨能力,因此对LEAD的检测更加直观,被认为是诊断LEAD 的“金标准”[12]。但是DSA 存在若干局限性:(1)DSA 属于侵入性检测,需要对患者实施穿刺及插管,并注入一定剂量的造影剂[51],因此有损伤患者肾脏功能的风险,并且在造影时容易引起血管壁损伤,使得血栓形成的风险性升高[52];检查费用昂贵,从而在基层医院中受到一定限制[48,52];(2) 由于糖尿病LEAD 主要涉及膝关节腘动脉以下部位血管,其走向复杂,形状细长,注入造影剂后,造成远端目标血管的显影效果差,因此操作时间较长,并伴有创伤和造影剂增强的足部疼痛,以及增加了患不良并发症的风险[53]。因此DSA 不能作为诊断LEAD 的首选方法,而是作为诊断困难时的备选方案[39]。
3.2 CT 血管造影
CT 血管造影(CTA)属于微创血管检查方法,其优势在于:仅需从肘静脉注射对比造影剂,安全性高,扫描时间短,空间分辨率高,与DSA 类似,可显示血管化的“路线图”(即病变部位和严重程度,以及上游/下游状态),提供关于血管狭窄的特征信息,如闭塞病变的位置、数量和长度、钙化程度和钙成分的排列、远端径流的质量等,在诊断LEAD 中显示出巨大价值。据报道CTA 的分辨率可达1.5 mm,评估LEAD 的敏感性为91.6%,准确性为73.3%,阳性率为78.5%[54]。CTA 的缺点是:(1)不能提供病变部位的血流动力学数据;(2)血管在明显钙化的情况下诊断能力较差;(3)评估侧支血管的敏感性仅为62.7%,明显低于DSA;(4)需要使用静脉碘造影剂,受试者存在过敏反应的风险;(5)检测费用较高[55]。
3.3 磁共振血管造影
磁共振血管造影(MRA)是随着磁共振成像技术的发展应运而生的一种血管检测手段,它利用造影剂使血管和周围组织弛豫时间不同的特性成像,可有效减少伪影、噪声、静脉显影的干扰。相比于CDU 和CTA,MRA 不受动脉钙化的影响,故MRA对于评价糖尿病患者下肢血管的不同程度钙化有着明显的优势,且对膝下血管狭窄程度评估的敏感性要优于CTA[56]。MRA 也有其不足之处:一是由于涡流、边缘放大效应、膝以下静脉污染等原因,MRA 有高估病变的风险;二是有较多禁忌症,如严重肾功能不全、体内支架置入、心脏瓣膜置换术的病人不允许行MRA 检查;三是成本昂贵[57]。
3.4 彩色多普勒超声
彩色多普勒超声(CDU)属于非侵入性检查,可清晰显示下肢动脉壁及管腔内的变化,通过检查血管内-中膜厚度(IMT)能够较早提供动脉管壁硬化的形态学信息,反映动脉结构的早期改变[58]。有研究表明,CDU 诊断LEAD 的敏感性和特异性分别为98%和100%,阳性预测值达94.6%,阴性预测值为97.8%,总体准确率高达96%[59],因此CDU 在LEAD 的诊断中扮演着重要角色,。然而CDU 对LEAD 的诊断也有一定的自身缺陷:一是对某些特殊的受检者,如肥胖、肢体坏疽等,血管全貌的观察较动脉造影效果差;二是操作者自身技术水平及经验对结果会产生影响,如探头压力、声束与血流夹角、彩色增益的调节等;三是CDU 在评估下肢血管狭窄情况时,股动脉至腘动脉之间的血管管腔内径较大,其狭窄率可用管腔缩小的面积来计算,而小腿以下血管如胫前动脉的血管直径小,同时内膜不规则增厚及斑块形成引起管腔不平整,用管腔缩小来评估狭窄或闭塞的情况,结果有争议性。这时需借助彩色多普勒血流成像(color Doppler flow imaging,CDFI)来观察血管腔内血液流动情况有无充盈和缺损才能判断狭窄情况[59]。总的来说,CDU和CDFI 技术是目前最常用的诊断大血管狭窄或闭塞等结构性病变的手段,但并不擅长诊断LEAD 更早期的微血管病变及其引发的肌肉缺血、营养不良等功能性病变。
3.5 激光多普勒微循环血流检测
激光多普勒血流仪(LDF)及其衍生的激光多普勒血流成像仪(laser doppler flowmetry imaging,LDFI)是一种无创微循环血流检测系统,已成为微循环血流测量的常用方法。其根据多普勒频移效应原理,通过激光照射,检测经微血管内运动的血细胞反射光的频移,测定血流速度及血流量等微循环参数[60]。通过多点的线性扫描探头,可以获得二维组织表面的微循环血流灌注图(LDFI)[61]。目前主要用于皮肤及表面粘膜下微循环血流监测。在临床上,已成熟用于烧伤诊治,用于烧伤深度评判、皮瓣移植术及术后监测,预后评估等,也已用于糖尿病足溃疡和小腿静脉溃疡、褥疮、瘢痕进程等存在皮肤微循环障碍病症的诊断和动态监测等[62-63]。已有研究应用LDF 技术评估LEAD 对微循环的影响。刘亮等[64]利用LDFI 测定老年下肢动脉局部组织微循环血流灌注量,通过对比ABI 指标,该研究发现,LDFI 所代表的微循环指标比ABI 等传统评价指标更能反映下肢动脉硬化闭塞程度。LDF 操作简便、灵敏、实时、快速无创,且检测成本低廉,无需使用造影剂或同位素追踪,但其不足在于不能直接评价各级动脉病变,目前也还不能直接检测组织微循环血流灌注的绝对血流值,也难以检测皮下深层组织的血流灌注状态[65],且易受运动伪影和皮肤或环境温度变化影响[66]。LDFI 这种非接触测量技术可以扫描较大面积的微循环血流图,较LDF 可更全面反映组织血流分布,查找坏死区域或灌注不足区域,目前与LDF 一样,LDFI 也无法实现深层组织血流灌注的检测,测量深度约为1 ~1.5 mm[67]。虽然该技术应用潜力很大,但目前尚未广泛应用于临床,也未形成相关检测标准,特别对于下肢动脉硬化闭塞患者的肢体灌注评估尚未能形成统一的共识[63]。
3.6 激光散斑对比成像
激光散斑对比成像(LSCI) 是一种利用相干激光与红细胞相互作用形成散斑图样,散斑信息与运动的血细胞相关,通过计算模型,形成二维的动态微循环血流分布图[68],可测量血管密度、血流速度、血液灌注量等指标[69]。多项研究表明,LSCI 可用于糖尿病足溃疡、糖尿病脑血管病变及微循环改变的早期评估。Katsui 等[70]利用LSCI 技术评价足背近端和远端因加热引起的微循环灌注波动,认为LSIC 技术对足部严重缺血均有诊断价值;Mennes等[71]对33 名糖尿病足溃疡患者进行LSCI 检测,发现LSCI 是评估糖尿病足部溃疡患者微循环状态的一种稳定和可重复性的技术,在非缺血性、缺血性和危重缺血性患者群体中显示出显著差异。作为一种大视场血流成像技术,LSCI 具有较高的时空分辨率、无需造影剂、可实时快速非接触成像等优点,且检测成本低廉,具有长期、动态监测微循环血流动力学状态[72]和微循环障碍[73]的能力,且比LDF具有更好的重复性[69],被认为是记录再灌注和血管形成过程的理想设备[74]。LSCI 技术的不足之处在于:(1)测量深度较LDF 更浅,约为300 μm,且对运动伪影敏感[66];(2)测量结果非定量,而是以光通量强度表示,并以空间、时间或时空散斑对比度的相对单位进行转换,以形成研究区域的灌注图像[68,73];(3)测量结果为相对流速,难以测量绝对流量[72]。
4 生理参数检测法
4.1 经皮氧分压测定法
经皮氧分压(TcPO2)测定是一种测量组织微循环内氧分压的非侵入性方法,其原理是通过对局部皮肤加热,促进皮下微循环内氧分子析出,然后经氧电极检测氧分子量,然后换算为组织氧分压。该技术在临床上用于检测下肢皮肤的经皮氧分压变化,用于LEAD 诊断。对下肢或足部连接氧分压电极,可用于估计动脉血管可被诱导形成的最大舒张程度,预测足部缺血性溃疡发生及愈合情况,可根据血管灌注情况决定是否行下肢血运重建治疗。正常人足背TcPO2>40 mmHg;当TcPO2<30 mmHg时,提示下肢血运差,溃疡发生机会大,溃疡愈合的可能性很小;当TcPO2≤20 mmHg 时,溃疡愈合无望,截肢风险很大[75]。TcPO2 测定对于评估严重肢体缺血最有帮助,但是由于皮肤氧供远远高于氧耗,TcPO2 对轻中度LEAD 相对不敏感,说明TcPO2测定并不擅长对LEAD 的早期诊断[76]。最近的文献也证明,在LEAD 的诊断检测中,TcPO2 的结果与ABI 不一致,二者不能互换[77]。此外,TcPO2 检查需要较为先进的设备,检测费用较昂贵。
4.2 分段肢体血压测量法
分段肢体血压测量(SLP)是一种通过比较肢体不同点位血压梯度值直接定位严重肢体缺血(critical leg ischemia,CLI)部位、评估LEAD 严重程度的检查方法[78]。该方法使用多普勒仪器或电子脉搏传感器及血压袖带检测肱动脉及下肢不同点(大腿上部和下部、腓肠肌上部、踝部和跖骨处)的血压,如果相邻节段间血压梯度达20 mmHg 以上则预示明显血管闭塞[79]。理论上袖带宽度应该比所取下肢点直径大20%,窄袖带可能导致假性高压现象不能精确定位病变[80]。SLP 可为多水平病变的患者提供信息并预测溃疡预后、肢体存活或是否需要血运重建[81]。SLP 方法也存在若干局限性:(1)小的血压梯度导致的单个轻度狭窄可能被漏诊;(2)钙化动脉会导致踝动脉压假性升高;(3)对于多水平病变的患者,近端血压降低可能掩盖远端梯度改变;(4)短段和长段病变之间或严重狭窄动脉和闭塞之间不适宜;(5)大腿动脉血压减少通常指示主-髂动脉段闭塞,然而股动脉或股浅动脉和股深动脉的闭塞也会出现相似的现象[82]。
4.3 踝肱指数法
踝肱指数(ABI)又称踝臂指数,是指人体仰卧休息5~10 分钟后所测的下肢踝部收缩压与上肢肱动脉收缩压的比值,它反映了下肢血管硬化或狭窄的程度,具有价格低廉、无创、简便易行的优点,广泛用于动脉粥样硬化和心血管疾病的危险评估[83]。LEAD 患者由于下肢动脉粥样硬化导致外周动脉狭窄,踝部收缩压降低,ABI 测量值小于正常值,其降低的程度与病变严重程度成比例[84]。ABI 的正常值为1.0~1.3,ABI 介于0.9~1.0 是临界值,静息下ABI≤0.9 诊断LEAD 的敏感性为90%,特异性为95%;0.4<ABI<0.9 则视为轻度至中度LEAD,ABI<0.40 则认为存在严重LEAD。当ABI>1.3 时,需加测趾臂指数(toe-brachial index,TBI),根据TBI 是否小于0.75 来判定LEAD 等级[85]。目前ADA、IWGDF 及中华医学会糖尿病学分会的防治指南均推荐将ABI 检查作为血管病变筛查及诊断标准之一[86]。
目前,大多数患者是通过踝臂指数检测异常(ABI<0.9)而被确诊[87]。通过同步测量四肢血压,不仅能简便地获得ABI,还可以得到臂间血压差异(inter-arm blood pressure difference,IAD)及踝间血压差异( inter-ankle blood pressure difference,IAND)[88]。
然而,ABI 也存在若干局限性:(1)易出现假阴性:由于糖尿病下肢动脉多有内膜广泛钙化形成,限制了动脉内侧层的可压缩性,即使是中度主动脉狭窄或广泛侧支血管病变的患者中,钙化的血管不能被膨胀的袖带膨胀压缩,ABI 值易出现假性升高,可能导致LEAD 筛查检测的漏诊[89],据统计由于内膜钙化而出现的假阴性率高达35%[90]。(2)灵敏度和特异度变化范围较大,诊断价值难以确定[91]:国内学者对ABI 预测LEAD 的价值做了对比研究,发现其灵敏度变化较大,分别为20.8%,25.49%,62.9%,91.18%到100%[92]。(3)无法提前预测病变,也不能精确定位病变部位:当检测的ABI 值为阳性时,受试者实际上已经发生了较严重的动脉病变,也不能对病变部位进行精确定位[59]。据报道,在糖尿病患者中,ABI 用于LEAD 筛查的表现尤其不一致[93],美国预防服务工作组最新的建议也强调了缺乏证据支持ABI 用于筛查无症状成年人的LEAD 风险[94]。
4.4 脉搏波速度法
早期的研究认为,糖尿病LEAD 属于大血管病变,其主要成因是动脉粥样硬化(atherosclerosis,AS),因此检测动脉硬度逐渐成为诊断LEAD 的重要方法。AS 目前比较明确的发生机制是糖基化终末产物(AGEs)生成增多、氧化应激、炎症因子生成增多及脂代谢异常[11,95]。与非糖尿病患者相比,糖尿病患者会更早地发生动脉硬化,引起管腔压力和切应力增加,产生内皮功能障碍,刺激动脉壁胶原过度生成和沉积,形成脂肪沉积或斑块,促进AS 的形成[96]。研究表明,动脉硬度增加反映了AS 的状态[97]。
脉搏波速度(PWV)是目前应用最广泛的动脉硬度测量方法,它是指心脏泵血后引起的动脉搏动从心脏传到目标动脉的速度,以两个脉搏检出点之间的距离除以两点之间的传播时间差来获得,是经典的大动脉病变无创检测指标[96]。PWV 的快慢能够反应血管壁的结构状况,当PWV 较慢的时候,反应动脉血管的僵硬度较低,血管壁的顺应性好;当PWV 过快时,表明动脉血管的僵硬程度较高,血管壁的顺应性变差。有研究发现,PWV 能够发现早期动脉硬化,可作为大规模筛查亚临床AS 或心血管疾病高危人群的有用工具[98]。在糖尿病患者中,PWV 被证明比踝肱指数(ABI)更可靠[42]。
目前最常用的PWV 参数是颈-股动脉脉搏波速度(carotid-femoral PWV,cfPWV)以及肱-踝动脉脉搏波速度(brachial-ankle PWV,baPWV),其中cfPWV 反映主动脉硬度,baPWV 反映大中动脉的硬度。cfPWV 被欧洲高血压和心脏病学会以及美国心脏协会作为评估动脉硬化的金标准,但是cfPWV测量时需要患者暴露腹股沟部位,而且对操作人员的技术水平要求非常高[48]。baPWV 的最大优点是测量方法比cfPWV 更简单,可重复性好[99]。日本高血压治疗指南建议将baPWV 的测量纳入亚临床靶器官损害的评估[100]。最近一项研究表明,baPWV 与颈动脉斑块形成的风险独立相关[96],证明其在AS 早期诊断中的应用潜力。
然而,PWV 检测法用于糖尿病LEAD 的早期诊断还远未成熟,主要缺陷表现在:(1)PWV 受年龄、动脉僵硬度、血压、心率变异性和糖尿病病程等若干因素的影响,LEAD 不是唯一改变PWV 的因素,因此PWV 在评估下肢动脉硬化程度变化时可信性降低,在临床和实验室研究中观察到了相互矛盾的结果[101-102];(2)baPWV 或cfPWV 作为一种大血管动脉的宏观评价指标,本质上反映的是较长一段动脉的平均弹性特性,无法反映各个动脉局段的病变特点[103]。
上述各类LEAD 诊断方法的优缺点比较如表1所示。

表1 下肢动脉病变(LEAD)诊断方法比较Tab.1 Comparison of diagnostic methods for lower extremity arterial disease (LEAD)
5 展望
综上所述,目前LEAD 检测及诊断方法尚无最佳方法,其早期诊断更是期待较好的解决方案。最新研究表明, 就血管病变而言, 微血管病变(microvascular disease,MVD)是引发LEAD 的最初期、更关键、且易忽视的源头性因素,微血管病变及其引发的微循环障碍的长期累积,与引发大血管病变,特别是促使下肢动脉病变,有互为因果、交替影响的相互作用,对糖尿病足的发生发展具有关键性推动作用,这刷新了人们将LEAD 简单归类为大血管病变的认知。有研究表明,糖尿病患者下肢血管病变多源于且集中于中小动脉血管,而大血管受累较少,且程度较轻;而非糖尿病患者下肢血管病变情况与糖尿病患者相反,多源于且集中于大血管,小血管受累较少,且程度较轻[104-105]。Netivel 等[42]研究发现,大血管病变更多地与近端疾病有关,如心肌梗死、脑中风等;而MVD 则更多地与远端疾病相关,如LEAD、下肢溃疡或截肢等,可作为LEAD的独立危险因素。Mohammedi 等[106]证实MVD 在LEAD 的发病机制中的扮演了更重要的角色,微循环障碍是诱发中小动脉病变的基础;而在其另一项研究中[107],通过对10 624 名2 型糖尿病患者的跟踪对比证实,MVD 对糖尿病患者的LEAD 有很强的预测作用,而大血管病变反而没有预测能力。Beckman 等[108]通过对125 674 名退伍军人长达11年的跟踪研究表明,MVD 的存在会单独增加截肢的风险,并协同增加罹患LEAD 的风险。Beckman等[109]随后指出,微血管密度降低可作为腿部功能疾病的一种独立风险因素,因此与动脉硬化相比,小腿肌肉微血管密度降低能更好地预测LEAD。陆冰等[110]也发现,糖尿病肌病是MVD 的主要表现。
糖尿病肌病在临床上被认为是一种缺血性肌病,缺血与Beckman 认为的微血管密度降低相吻合,好发于下肢肌肉群,特别是小腿腓肠肌,临床症状主要表现为肌无力、肌疼痛和肌肉萎缩,但因其症状不典型,又常与糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)的症状相似或相伴行而易被忽略。值得注意的是,DPN 已被证实与动脉内膜钙化密切相关[111],Edmonds 等[112]研究发现,DPN 可以引起颈动脉形成钙化和斑块,这恰好可以解释DPN 伴有糖尿病下肢动脉硬化的特点,由于DPN 时常伴有骨量的减少及血管平滑肌细胞的钙化,从而导致下肢动脉钙化的形成;杨光燃等[113]通过实验发现,DPN 与LEAD 呈正相关。上述研究结果表明,采用DPN 与LEAD 联合筛查对糖尿病患者的LEAD 早期诊断具有重要帮助。此外,Gotschy等[114]通过动物实验证明,早期动脉粥样硬化引起的动脉硬化在大血管路径上分布不均,利用局部PWV 检测来评估动脉硬度的异质性,比宏观PWV检测更敏感地识别早期动脉病变。
综上所述,未来发展针对微血管病变及局部动脉PWV 的检测技术,是糖尿病LEAD 早期诊断的突破口,有望实现对糖尿病这种隐匿性LEAD 的早期诊断,从而突破现有诊断方法的瓶颈。
研究显示,新确诊的糖尿病患者大多就已经存在慢性并发症[6],但我国针对糖尿病患者的并发症筛查率普遍偏低,其中LEAD 长期保持高发病率、高致残率和高病死率,以及低诊断率、低治疗率和低知晓率。早期诊断是降低糖尿病LEAD 患病率的关键,因此研究准确有效、安全快捷的LEAD 早期诊断方法已成为一项涉及数亿糖尿病患者生存质量和生命安危的重大需求,可从根本上改善数以亿计的糖尿病患者的生活质量,社会效益深远。

