金沙江干热河谷不同区段土壤碳氮磷化学计量和酶活性研究
阮长明,杜寿康,孙永玉,张春华,欧朝蓉,王 猛*,唐国勇*
1. 西南林业大学林学院,云南 昆明 650224
2. 中国林业科学研究院高原林业研究所,云南 昆明 650233
3. 云南元谋干热河谷生态系统国家定位观测研究站,云南 昆明 650233
生态化学计量是一门结合物理、化学和生物学等基本原理的研究生态系统中相关化学元素与能量平衡的科学[1]. 土壤是生态系统的重要部分,土壤养分元素的变化将影响生态系统的结构和功能. 土壤C、N、P元素是土壤提供给植物生长所必需的大量营养元素[2-3],其含量对生态系统有重要作用;土壤C、N、P元素化学计量比能反映土壤养分循环状态,揭示生态系统结构与功能的异质性[4],能反映土壤质量和养分循环状况,可作为土壤矿化、养分循环的重要指标[5-6]. 土壤酶参与土壤中各项生物及化学反应,在土壤物质循环与转化中起重要作用[7-9],其活性能客观地反映生物多样性、微生物量等变化状况[10-11],能反映C、N、P等养分循环和代谢情况[12]. 金沙江干热河谷特殊的生态环境导致土壤养分和酶活性有别于其他地区,所以在该区域开展土壤养分和酶活性研究具有重要意义.
金沙江干热河谷位于我国西南横断山区河谷深切后形成的大断裂带上,受大气环流和地理位置、地形地貌等因素影响,该区域气候干旱、水热极度不平衡,加上自然资源的不合理开发利用等因素,导致该区域生态功能退化明显,成为我国生态环境脆弱地区之一[13]. 该区域跨越纬度大,地形地势复杂,其上、中、下游的光照、温度、水热条件等有较大差异[14-15],形成独特区域性气候导致土壤C、N、P含量和酶活性有别于其他地区,具有高度空间异质性. 近年来,研究人员对金沙江干热河谷地区植被恢复和生态治理开展了大量涉及植被、土壤、微生物的相关研究,其中土壤C、N、P等营养元素和酶活性的研究主要集中在小区域研究[16-18],缺乏对金沙江干热河谷整体区域的时空尺度研究. 因此,该研究对金沙江干热河谷上、中、下游开展调查研究,结合分析不同区段土壤C、N、P含量及化学计量比和酶活性的差异性,以期为该区域植被恢复和生态治理提供基础数据和研究依据.
1 材料与方法
1.1 研究区概况
该研究以金沙江干热河谷为研究区域,其主要分布在云南省鹤庆县与四川省布拖县之间. 区域最冷月平均气温>12 ℃,最暖月平均气温24~28 ℃,日均气温≥10 ℃,年均积温>7 000 ℃,日均气温≥10 ℃持续天数大于350 d,全年无霜;年均降雨量600~800 mm,年均蒸发量2 750~3 850 mm,年均干燥度在2.0以上[13]. 土壤类型有燥红土、黄壤、赤红壤、紫色土等. 植被以干热河谷灌丛和稀树灌草丛为主,其中乔木主要有锥连栎(Quercus franchetii)、滇榄仁(Terminalia franchetii)、山合欢(Albizzia kalkora)、攀枝花(Gossampianus malabarica)等;灌木主要为车桑子(Dodonaea viscose)、余甘子(Phyllanthus emblica)、杭子梢(Campylotropis macrocarpa)等;草本以扭黄茅(Heteropogon contortus)、鬼针草(Bidens pilosa)、香茅(Mosla chinensis)、龙须草(Juncus effusus)等为主.
1.2 样地设置与样品采集
参考张建利等[19]的区划方案,选取坡度、坡位、海拔等相近的样地;2021年1月在金沙江干热河谷上游(云南省鹤庆县和永胜县)设8个样方,在中游(四川省仁和区和云南省元谋县)设12个样方,在下游(云南省东川区和四川省宁南县)设12个样方,共32个样方,其中,4个稀树灌草丛样方,10个天然林样方,18个人工林样方(林龄20年左右). 乔木样方大小为20 m×20 m,在乔木样方内设置4个5 m×5 m的灌草样方,在样方内进行植被调查和土壤样品采集,并记录样地基本信息(见表1)、土壤特征(见表2)及植被信息等.
土样采集前去除地表凋落物层,在样方内按“S”形五点采样法采集表层(0~15 cm)土样,形成混合样,同时采集环刀样用于测定土壤理化性质等.

表 1 样地基本信息Table 1 Plot information
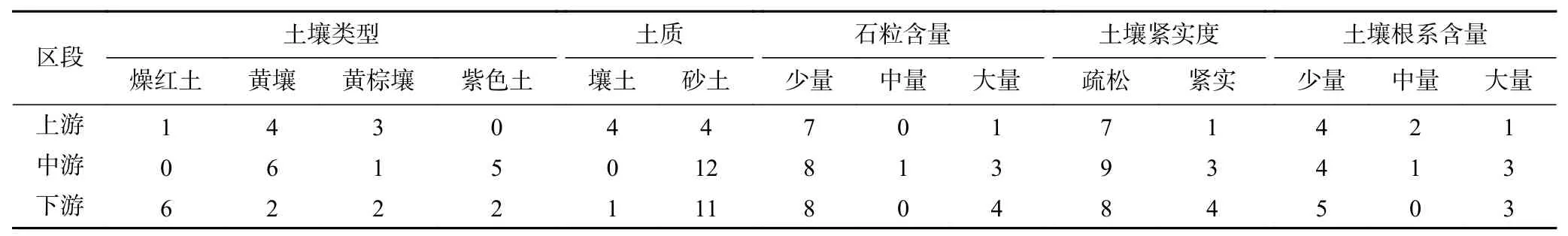
表 2 样地土壤特征及个数Table 2 Soil characteristics and quantity of plots
1.3 样品测定
土壤养分含量测定参考文献[20],土壤有机碳(SOC)含量采用LY/T 1237−1999《森林土壤有机质的测定》中重铬酸钾容量法测定,土壤全氮(TN)含量采用LY/T 1228−1999《森林土壤全氮的测定》中凯氏定氮法测定(全自动凯氏定氮仪KjeltecTM8400,FOSS,丹麦),土壤全磷(TP)含量采用LY/T 1232−1999《森林土壤全磷的测定》中碱熔-钼锑抗比色法测定,土壤容重、总孔隙度及毛管孔隙度等物理指标采用LY/T 1215−1999《森林土壤水分-物理性质的测定》中环刀法测定,土壤pH采用LY/T 1239−1999《森林土壤pH的测定》中电位法测定(雷磁PHS-25 pH计,上海仪电科学仪器股份有限公司),其水土比(水体积与土质量之比)为2.5∶1.
土壤酶活性测定:使用微孔板荧光底物法进行测定,将标准样品和空白对照放入酶标板,使用全波长多功能酶标仪(Varioskan fiash多功能酶标仪,赛默飞世尔科技公司,美国)在特定的激光波段下测定吸光值,通过计算得出酶活性. 土壤脲酶(Ure)采用次氯酸钠-苯酚比色法测定酶活性,脲酶水解尿素产生的NH3-N在强碱性介质中能够与次氯酸钠和苯酚反应,生成水溶性蓝色染料靛酚蓝,产物在630 nm处有特征吸收峰,通过吸光值的变化即可表征土壤脲酶的活性. 土壤β-葡萄糖苷酶(BG)采用对-硝基苯-β-D-吡喃葡萄糖苷比色法测定酶活性,土壤β-葡萄糖苷酶能够分解对-硝基苯-β-D-吡喃葡萄糖苷生成对-硝基苯酚,产物在400 nm处有特征吸收峰,通过吸光值变化即可表征土壤β-葡萄糖苷酶的活性. 土壤酸性磷酸酶(AP)采用磷酸苯二钠比色法测定,土壤酸性磷酸酶能够在酸性环境中催化磷酸苯二钠水解生成苯酚和磷酸氢二钠,通过测定酚的生成量即可表征土壤酸性磷酸酶的活性.
1.4 数据分析
使用Excel 2010软件对数据进行归纳整理;使用方差分析(ANOVA, Duncan检验)比较金沙江干热河谷土壤C、N、P化学计量特征和土壤酶活性在金沙江干热河谷上、中、下游的差异显著性,用Pearson相关性分析土壤C、N、P化学计量特征和酶活性的相关性;用CANOCO 5软件对不同环境因子与土壤酶之间关系进行冗余分析(redundancy analysis, RDA).
2 结果与分析
2.1 金沙江干热河谷不同区段植被特征
由表3可见:金沙江干热河谷草本种类、灌木种类及乔木种类从上游至下游均表现出逐渐增大的趋势;而草本覆盖度则是中游(66.92%)最小、下游(72.08%)最大;灌木覆盖度为上游(23.75%)最小、中游(36.00%)最大;乔木郁闭度从上游至小游逐渐增大;地表凋落物在中游(1.72 cm)最厚,在上游(0.93 cm)最薄.
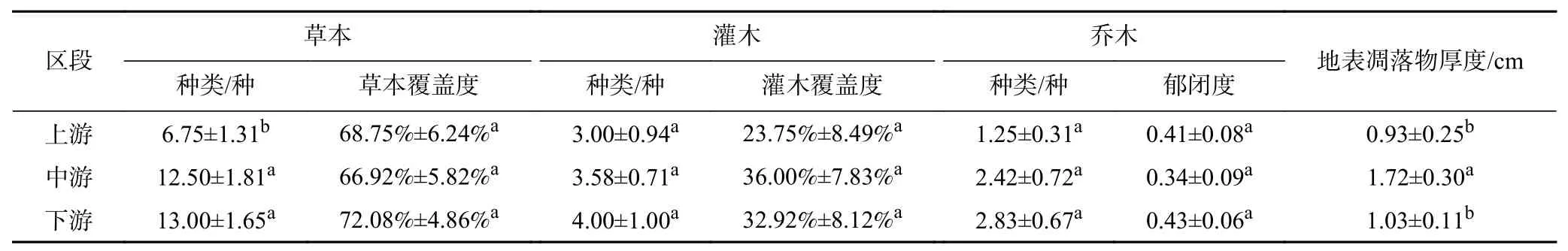
表 3 金沙江干热河谷样地植被信息Table 3 Vegetation information of plots in the Dry-Hot Valley of Jinsha River
2.2 金沙江干热河谷不同区段土壤理化性质特征
由表4可见:金沙江干热河谷土壤容重呈中游>下游>上游的特征;土壤总孔隙度及毛细管孔隙度则均呈上游>下游>中游的特征;土壤自然含水率在中游(14.89%)最小,在上游(16.48%)最大;土壤pH从上游至下游逐渐增大.

表 4 金沙江干热河谷不同区段土壤理化性质特征Table 4 Soil physical and chemical properties at various reaches of the Dry-Hot Valley of Jinsha River
2.3 金沙江干热河谷不同区段土壤C、N、P化学计量特征与土壤酶活性
金沙江干热河谷不同区段土壤C、N、P化学计量特征差异性如表5所示. 由表5可见:土壤SOC(土壤有机碳)、TN (土壤全氮)、TP (土壤全磷)元素含量均表现为上游>下游>中游的特征. 上游土壤SOC含量(21.53 g/kg)显著大于中游(17.65 g/kg),土壤TN和TP含量在上、中、下游没有显著差异;中游土壤SOC、TN、TP含量均小于金沙江干热河谷区域平均值. 不同植被类型的土壤SOC、TN、TP含量表现为天然林>人工林>稀树灌草丛的特征,中游天然林、人工林和稀树灌草丛的土壤SOC、TN、TP含量均小于金沙江干热河谷天然林、人工林和稀树灌草丛的平均值.
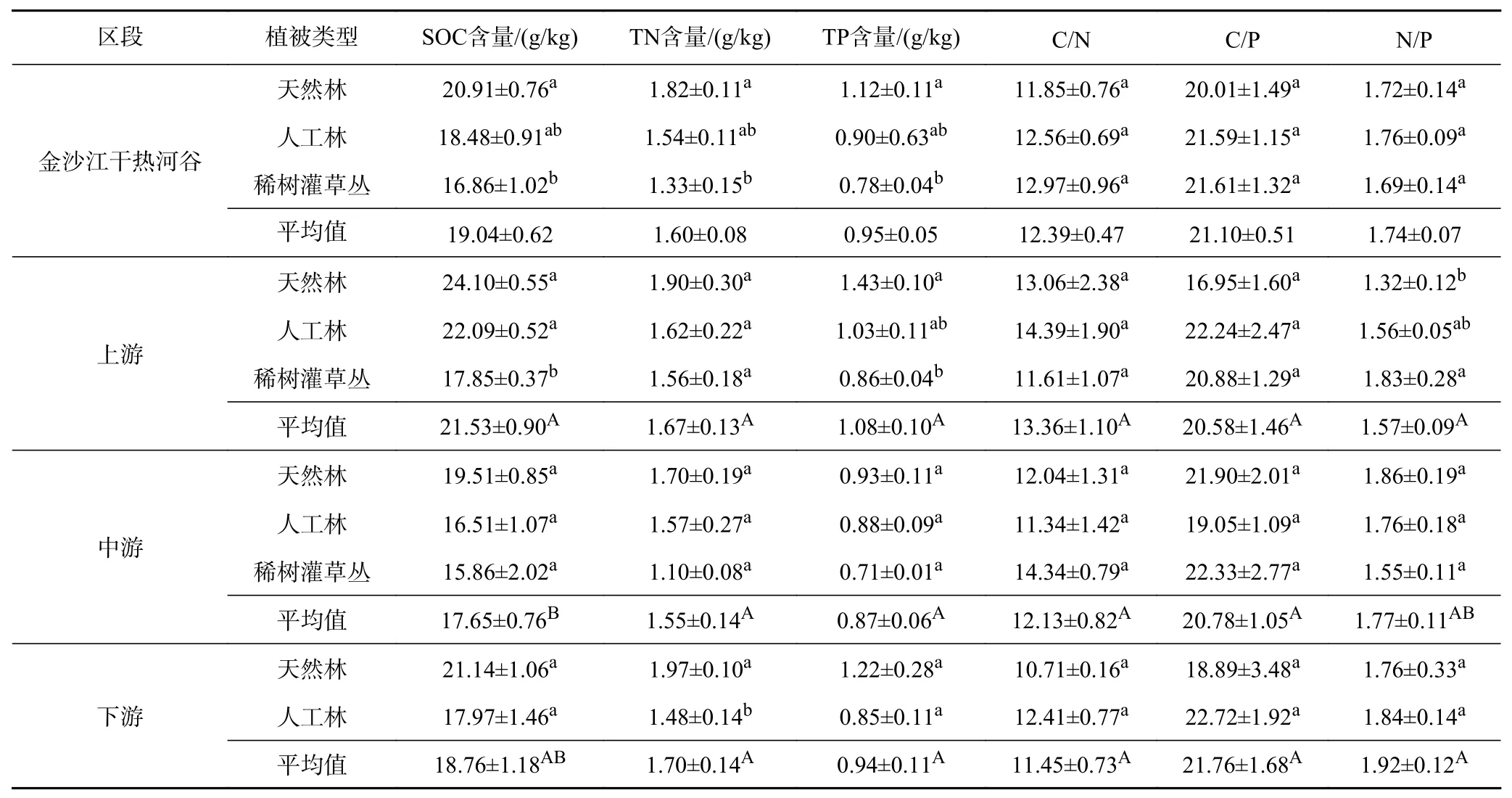
表 5 金沙江干热河谷不同区段土壤C、N、P 化学计量特征Table 5 Stoichiometric characteristics of soil C, N and P at various reaches of the Dry-Hot Valley of Jinsha River
金沙江干热河谷土壤C/N、C/P、N/P(C、N、P元素之间的含量比,下同)平均值分别为12.39、21.10、1.74,其中C/N值为上游(13.36)>中游(12.13)>下游(11.45),C/P值为下游(21.76)>中游(20.78)>上游(20.58),N/P值为下游(1.92)>中游(1.77)>上游(1.57). 金沙江干热河谷不同植被类型的C/N、C/P平均值均表现为稀树灌草丛>人工林>天然林的特征,N/P值则为人工林>天然林>稀树灌草丛.
金沙江干热河谷上、中、下游的土壤酶活性存在差异(见表6),土壤Ure(脲酶)、BG(β-葡萄糖苷酶)和AP(酸性磷酸酶)酶活性的变化范围分别为25.42~34.40 μg/(g·h)、81.39~102.34 nmol/(g·h)和902.92~1 128.07 nmol/(g·h),其活性在各区段均表现为上游>下游>中游的特征,但各区段间差异不显著. 金沙江干热河谷上、中、下游不同植被类型的土壤Ure、BG和AP酶活性均表现为天然林>人工林>稀树灌草丛的特征,土壤Ure、BG和AP酶活性均表现为天然林显著大于稀树灌草丛的特征(P<0.05).
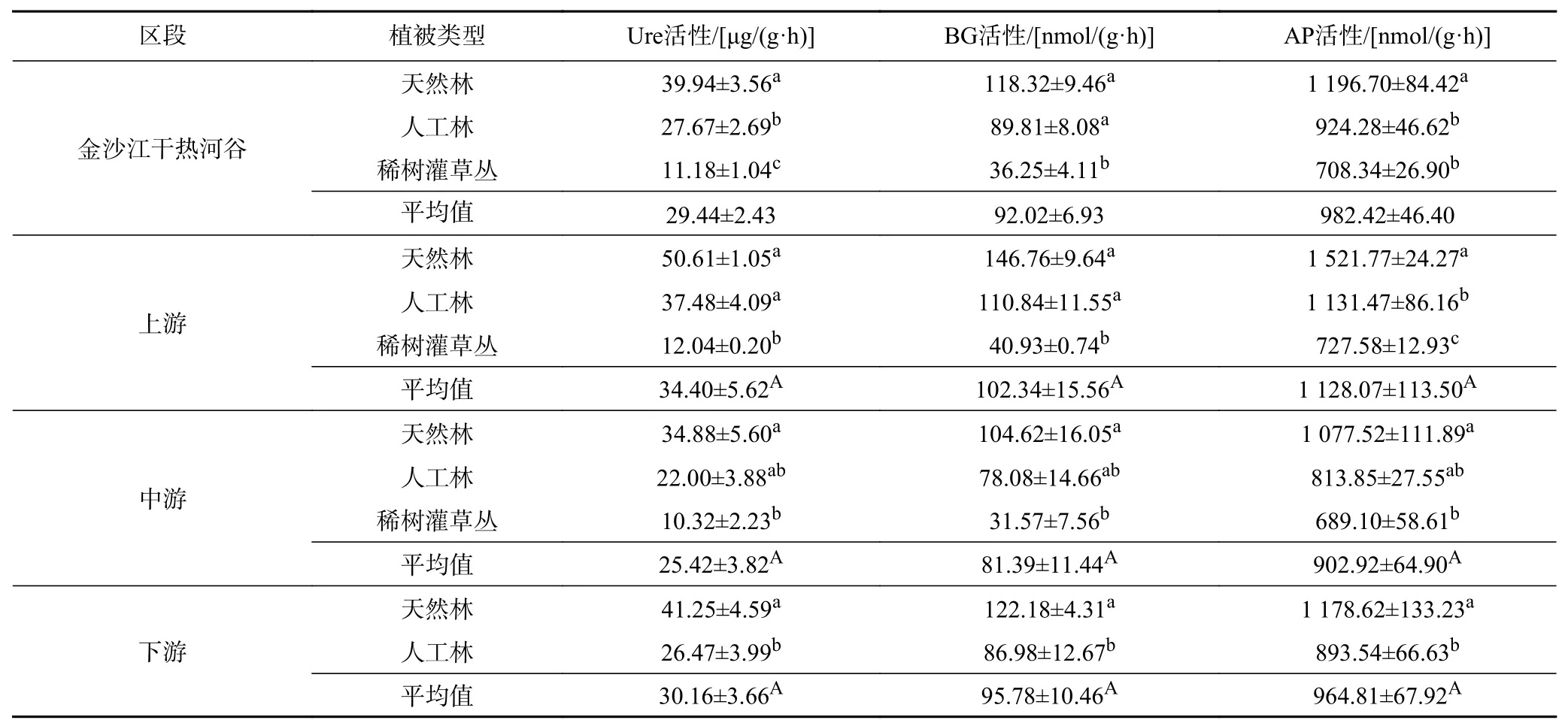
表 6 金沙江干热河谷不同区段土壤酶活性特征Table 6 Characteristics of soil enzyme activities at various reaches of the Dry-Hot Valley of Jinsha River
2.4 土壤C、N、P化学计量及酶活性与其他因子的相关性分析
由表7可见,土壤Ure、BG、AP活性与土壤SOC含量、TN含量、TP含量、土壤总孔隙度、土壤毛细管孔隙度、土壤自然含水率均呈极显著正相关(P<0.01),与土壤容重、土壤pH均呈极显著负相关(P<0.01),与C/N、C/P、N/P均呈负相关. 土壤SOC、TN、TP含量与土壤总孔隙度、毛细管孔隙度和土壤自然含水率均呈极显著正相关,与土壤容重、土壤pH均呈极显著负相关. 土壤SOC含量与C/N呈正相关,与C/P、N/P均呈负相关;土壤TN含量与C/N、C/P均呈极显著负相关,与N/P呈正相关;土壤TP含量与C/P、N/P均呈极显著负相关,与C/N呈负相关.C/N、C/P、N/P与土壤容重和pH均呈正相关,与土壤总孔隙度、毛细管孔隙度和土壤自然含水率均呈负相关.

表 7 土壤C、N、P化学计量及酶活性与其他因子的相关性分析Table 7 Soil C, N, P stoichiometry and correlation analysis of enzyme activities with other factors
选取土壤SOC、TN、TP含量以及C/N、C/P、N/P、容重、总孔隙度等12个因子作环境变量,以Ure、BG和AP三种酶活性作响应变量,通过RDA冗余分析表明,土壤酶活性特征值在轴1和轴2分别为0.85和0.03,土壤酶活性与环境因子的相关性在轴1和轴2分别为0.95和0.69,前两轴对土壤酶活性累计解释量达87.57%,土壤酶活性与环境因子的累计解释量在前两轴达99.36%,由此可得土壤酶活性与环境因子的关系可以通过RDA的轴1和轴2来体现,且主要通过轴1来反映.
由图1可见:土壤SOC、TN、TP含量以及自然含水率、总孔隙度、毛细管孔隙度、枯落物厚度与土壤BG、Ure、AP酶活性均呈正相关;C/N、C/P、N/P、pH、容重与土壤BG、Ure、AP酶活性均呈负相关. 其中土壤容重、土壤SOC和TP含量对土壤酶活性解释度达82.5%,对酶活性影响较显著,可认为土壤SOC、TP含量以及土壤容重对酶活性起主导作用.
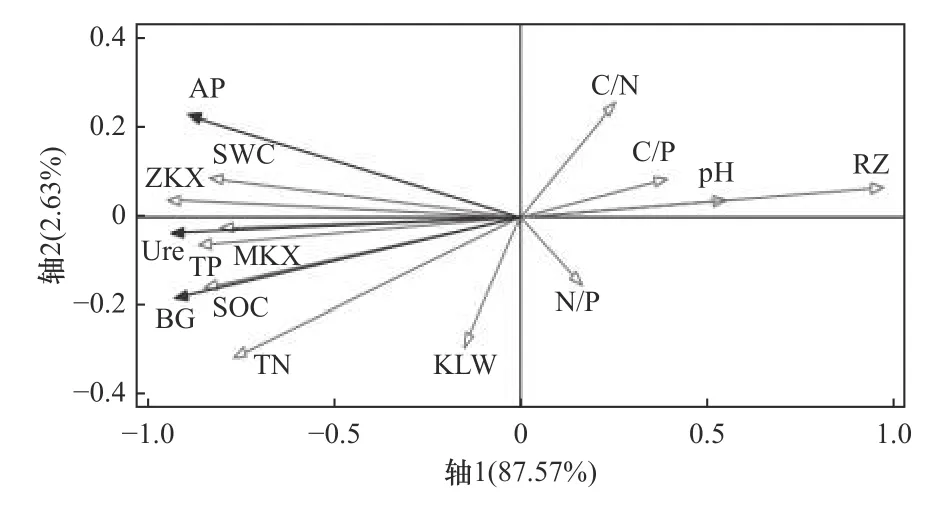
图 1 土壤C、N、P化学计量及酶活性与其他因子的冗余分析Fig.1 Soil C, N, P stoichiometry and redundancy analysis of enzyme activity and other factors
3 讨论
3.1 金沙江干热河谷不同区段对土壤C、N、P含量及化学计量比的影响
地理位置、地形地貌、水热条件、土壤理化性质、微生物量、群落结构等条件对土壤C、N、P含量有较大影响[10],金沙江干热河谷总体呈东西向分布,跨越区段大、覆盖面积广,因地形和季风等因素影响导致上、中、下游的气候、土壤和植被均存在空间异质性.在高温干燥环境下土壤有机碳分解速率加快,土壤保持营养元素能力降低,土壤SOC等含量减小[21]. 笔者研究发现,金沙江干热河谷上游地区环境温度低,相对湿度大,土壤的水热条件最优越,上游土壤营养元素最容易积累;中游地区环境温度高,蒸发量大,土壤处于高温干燥的条件下,土壤SOC等元素更容易被分解. 土壤母质、植物凋落物等条件对土壤营养元素也有较大影响[22],其中金沙江干热河谷土壤SOC、TN、TP含量均受土壤母质和植物凋落物影响较大[23-24]. 笔者调查发现,上游土壤以黄壤为主,中游以黄壤和紫色土为主,下游以黄壤和燥红土为主(见表2).黄壤和黄棕壤的有机质分解和矿化较弱,弱度富铝风化,土壤黏性大,生物积累作用强,因此上游土壤有机碳和全氮含量高[25]. 红壤为中度脱硅富铝风化,土壤板结,土壤中全氮和有机碳流失严重[26]. 紫色土是砂岩发育而成,含大量磷元素,但有机质含量较低,因此中、下游土壤C、N、P元素含量减小. 另外上游到下游土质由疏松逐渐变紧实,土壤石粒含量逐渐增多,土壤类型由壤土逐渐变为砂土(见表2),这与表4中土壤各项物理指标一致,这导致上游土壤容重小、土壤孔隙度大,中游土壤容重最大、土壤孔隙度最小.土壤容重小、孔隙度大能够增加土壤透气性和水保持能力,提升土壤物质循环能力[27],增加土壤C、N、P等元素,所以金沙江干热河谷土壤SOC、TN、TP含量变化与土壤母质和土壤理化性质有密切联系. 地表植被及凋落物对土壤C、N、P等营养元素也有较大影响[28],笔者研究发现,金沙江干热河谷天然林的植被覆盖度大,能够改善地表微生物群落结构,增加微生物活性;其次是人工林经过人类干涉增加了地表物种丰富度、改善了土壤理化性质,使其土壤C、N、P等元素含量较稀树灌草丛有明显增加,这种现象证明植被对土壤营养元素含量有较大影响[29]. 而金沙江干热河谷中游植物种类多,土壤根系多,地表凋落物层最厚,但中游气候、土壤条件恶劣降低了微生物的活性,植物枯枝落叶不能及时分解,植物所含营养元素不能有效地回归土壤,导致中游土壤SOC、TN、TP含量低于上游和下游. 特殊的气候、土壤、植被等条件导致金沙江干热河谷上、中、下游土壤中C、N、P元素含量具有特殊的空间异质性.
金沙江干热河谷土壤C、N、P元素含量具有空间异质性,导致上、中、下游土壤元素计量比(C/N、C/P、N/P)具有空间变异性. 金沙江干热河谷土壤C/N值(12.39)、C/P值(21.10)和N/P值(1.74)均 小于全国森林土壤平均值(分别为13.70、44.5、3.2)[30],这是由于该区域高温、低湿的特殊生态环境造成植被、土壤、微生物等特征低于全国平均水平. C/N能够反映土壤有机质分解状态[31],土壤C/N值从上游到下游逐渐降低,主要原因是中、下游土壤有机碳更容易被分解,而土壤TN的稳定性好、空间异质性小,因此金沙江干热河谷土壤C/N值的变化主要受土壤SOC含量影响较大. C/P能反映土壤磷的矿化能力[32],N/P能反映土壤养分状态[33],C/P和N/P值均从上游至下游逐渐增大,其原因是在金沙江干热河谷地区土壤全磷受环境影响,其迁移强度小于有机碳和全氮,因此C/P、N/P值变化受有机碳和全氮含量影响较大.
3.2 金沙江干热河谷不同区段对土壤酶活性的影响
金沙江干热河谷土壤Ure、BG、AP酶活性受气候、土壤、植被等环境因子影响较大[34]. 笔者研究表明,金沙江干热河谷土壤自然含水率与土壤Ure、BG、AP活性的相关性均呈极显著正相关(P<0.01),说明土壤水分增加能够促进土壤酶活性,这与靳振江等[35]研究结果一致. 金沙江干热河谷环境温度从上游至下游逐渐升高,但土壤酶活性则逐渐降低,这与Erhagen等[36]研究结果不同,其原因是金沙江干热河谷是高温干燥的环境,环境水分对土壤酶活性有促进作用,而环境温度过高会加速环境水分流失进而抑制酶活性. 土壤营养元素对土壤酶活性有较大影响[37],笔者研究发现金沙江干热河谷土壤有机碳、全氮、全磷与土壤Ure、BG、AP酶活性均呈极显著正相关(P<0.01),表明土壤营养元素能影响土壤酶生化反应和调节酶分泌,进而影响土壤酶活性[38],这与Banerjee等[39-40]研究结果一致. 其原因是土壤有机质是土壤酶促反应的主要底物,土壤有机碳含量高能够提高土壤酶活性[41];土壤氮元素通过参与土壤酶合成、增强微生物繁殖等途径促进土壤酶活性[42];土壤中含磷化合物水解能够影响酸性磷酸酶活性[43]. 植被条件对酶活性也有一定影响,土壤根系会增加土壤容重和土壤孔隙度,笔者研究发现,土壤容重与土壤Ure、BG、AP酶活性均呈极显著负相关(P<0.01),土壤总孔隙度和毛细管孔隙度与土壤Ure、BG、AP酶活性均呈极显著正相关(P<0.01),证明植被根系的增加可以提高土壤酶活性. 金沙江干热河谷地表凋落物厚度与土壤酶活性呈正相关(见图1),证明地表凋落物厚度的增加能够提高土壤含水率、增加土壤酶反应底物,从而提高微生物活性[44]. 金沙江干热河谷天然林物种丰富、土壤中根系及枯落物较多,增加了土壤微生物生化反应底物及活性,使天然林土壤酶最高;而稀树灌草丛植被稀少,地表覆盖度低,不利于土壤透气保水,其土壤酶活性则最差.
比较金沙江干热河谷气候、土壤和植被对土壤酶活性的影响,发现低温高湿的环境中能够增加微生物活性[45],加速植物凋落物的分解,大量植物元素能够及时分解并回归土壤,增加了土壤营养元素和酶活性;高温干燥环境下微生物等活性被抑制,地表土壤中各种生化反应速率降低,使植物-土壤-微生物的物质循环和能量流动降低,土壤营养元素含量及酶活性降低.
4 结论
a) 金沙江干热河谷土壤C、N、P元素含量受气候、土壤和植被等环境因子影响呈现独特的空间异质性,其元素含量表现为上游>下游>中游的特征,C/N值从上游向下游逐渐降低,C/P和N/P值均从上游向下游逐渐增加.
b) 土壤Ure、BG和AP的酶活性受金沙江干热河谷上、中、下游气候以及土壤、植被等环境因子的影响,其活性均表现为上游>下游>中游的特征.
c) 金沙江干热河谷不同植被类型土壤C、N、P含量和酶活性均表现为天然林>人工林>稀树灌草丛的特征.

