石油烃污染土壤中蚯蚓对PAHs富集研究
黄盼盼,陶宗鑫,王佳佳,徐晶,欧阳少虎,*
1. 东营市生态环境局,东营 257000 2. 南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津 300071
石油是当今世界的主要能源之一,被誉为“经济血液”和“黑色黄金”。人类对于石油需求的不断增长使得石油烃污染事故频发,日益受到广泛关注[1-3]。石油及其产品的生产、运输和处置等过程中的意外排放是多环芳烃(polycyclic aromatic hydrocarbons, PAHs)的重要来源,也可以说发生石油污染时往往伴随着PAHs污染。此外,PAHs是石油烃重要组成部分,虽然仅占到其烃类物质的5%~9%,但因PAHs具有致突变、致癌、致畸和高富集性的特点,导致石油烃的危害绝大多数都是由于PAHs造成的[4-6]。研究表明,石油烃污染土壤往往会伴生PAHs污染[7],并且PAHs具有亲脂性和疏水性易被土壤颗粒吸附积累[8],还能通过食物链在生物体内不断富集[9-10]。因此,研究石油烃污染胁迫下土壤生物对PAHs富集特征对于土壤生态系统保护、修复和健康评估是很有必要的。
蚯蚓作为土壤污染的重要指示生物,它的生命活动会直接或间接影响PAHs在土壤中的迁移和转化[11-12]。生物富集系数可以综合评价污染物在生物体内的富集趋势[6, 13],因而分析蚯蚓中PAHs的富集量和生物富集系数,可以间接地反映土壤被石油烃污染的状况。目前石油烃污染物在海洋生物和土壤生物体内的富集特征研究已有一些报道[14-16],而关于石油污染伴随的PAHs污染中不同环数PAHs在蚯蚓体内的富集特征的研究则鲜有报道。因此,本文模拟土壤在不同污染浓度石油烃污染胁迫下蚯蚓对其伴随的PAHs富集量和富集系数研究,揭示不同环数PAHs在蚯蚓体内的富集规律,该研究成果可为土壤石油烃污染物中PAHs对土壤生物的生态健康评估提供数据支撑。
1 材料与方法(Materials and methods)
1.1 实验材料
试验所用赤子爱胜蚓(Eiseniafoetida)为国际标准(OECD 207)试验蚓种之一[17],购于天津贾立明蚯蚓养殖有限公司。赤子爱胜蚓体长35~70 mm,宽3~5 mm。颜色不定,紫色、红色、暗红色或淡红褐色,有时在背部色素变少的节间区有黄褐色交替的带。挑选健康的个体,清肠24 h后用作正式实验测试生物。
16种优先控制的多环芳烃PAHs(萘、苊、二氢苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、二苯并[a,h]蒽、茚并[1,2,3-cd]芘和苯并[g,h,i]苝)标准样品(初始浓度2 mg·mL-1),购自美国J&K Acros公司。色谱纯二氯甲烷和正己烷购买自天津市康科德科技有限公司,中性氧化铝、层析用硅胶和无水硫酸钠购买自天津市化学试剂厂。
试验所用石油污染和清洁表层土壤(0~20 cm)分别采自山东省胜利油田现河采油厂(37°7′N,118°22′E)及其附近无污染的农田。将土壤样品自然风干,过2 mm筛,测定其pH值为8.3~8.4,石油污染土壤和清洁土壤中有机质含量分别为275.3 g·kg-1和59.0 g·kg-1。
1.2 土壤中总石油烃含量和PAHs含量的测定
采用重量法中的索氏萃取法来测定土壤中总石油烃含量[18]。称取5.0 g过筛后的石油污染土样,用滤纸包好后放入索氏提取器中。加入150 mL二氯甲烷,于55 ℃恒温水浴萃取24 h。萃取结束后,取下圆底烧瓶,55 ℃旋转蒸发至干,在通风橱内挥发至恒重,称量质量。经测定,石油污染土壤中总石油烃的含量为110.0 g·kg-1。将上述石油烃萃取液过硅胶层析柱(12 cm硅胶,6 cm氧化铝和1 cm无水硫酸钠填充),加入70 mL正己烷与二氯甲烷1∶1混合液洗脱,此时得到含有PAHs洗脱液。将洗脱液再次旋蒸,待样品剩余2 mL时停止旋蒸,氮吹仪吹扫至近干。用色谱纯的正己烷定容至10 mL,取1 mL于气相小瓶中,待测,采用气相色谱质谱联用法(GC-MS)对石油污染土壤中16种PAHs进行定量分析。
1.3 蚯蚓石油烃污染土壤暴露富集实验
综合考虑石油烃在实际污染土壤中的浓度(110.0 g·kg-1)及其对蚯蚓14 d-LC50浓度(21.9 g·kg-1)[3],将过筛后的石油烃污染土壤与清洁土壤按不同比例充分混合,配制成不同浓度(0、0.5、1.0、2.5、5.0、10.0和20.0 g·kg-1)的石油烃污染土壤用于蚯蚓染毒,暴露试验按照OECD (2004)推荐的标准方法进行[19]。染毒实验选用1 L的烧杯,每个烧杯中加入500 g混匀的不同浓度石油烃污染土壤样品,每个试验浓度设置3个重复,试验期间调节土壤含水量为最大持水量的60%。平衡24 h后将土壤搅拌均匀,每个烧杯中放入10条已经清肠的蚯蚓,置于20 ℃的人工气候培养箱中黑暗避光培养。分别暴露7、14、21和28 d时,从每个烧杯中取出2条蚯蚓,用蒸馏水洗净、清肠、称量质量、编号,于-80 ℃超低温冰箱中保存,用于后续实验测定。
1.4 PAHs含量的测定
目前分析PAHs含量的主要方法有高效液相色谱法、纸色谱荧光光度法、气相色谱法和气相色谱质谱联用法等[20]。本文使用GC-MS法对石油污染土壤和蚯蚓样品体内16种PAHs进行定量分析。
1.4.1 蚯蚓样品体内PAHs的提取与富集
称取一定质量冷冻干燥48 h磨成粉末状的蚯蚓样品,用滤纸将蚯蚓样品包好,采用和1.2中完全一样的索氏提取方法提取和富集蚯蚓体内的PAHs。待富集到蚯蚓样品中的PAHs萃取液后,经氮吹后用色谱纯的正己烷定容至10 mL,取1 mL于气相小瓶中用GC-MS测定。
1.4.2 GC-MS测定PAHs仪器分析条件
利用GC-MS D5975气质联用仪(Agilent,美国)的SIM模式测定土壤和蚯蚓体内的PAHs。色谱条件如下:色谱柱为TR5-MS色谱柱(30 m×0.25 mm×0.25 μm),载气为高纯度氦气(99.999%),进样口温度为280 ℃,进样体积为1 μL,无分流自动进样。柱温箱升温程序:初始温度70 ℃,保持2 min,然后以10 ℃·min-1上升至260 ℃,保持8 min,最后以5 ℃·min-1上升至300 ℃,保持5 min。采用外标法对PAHs进行定量分析,以16种PAHs标准样品在相同色谱条件下样品中C10~C35之间所出的色谱峰进行积分,从而获得定量分析结果。16种PAHs的保留时间及特征离子如表1所示,标准样品色谱图如图1所示。
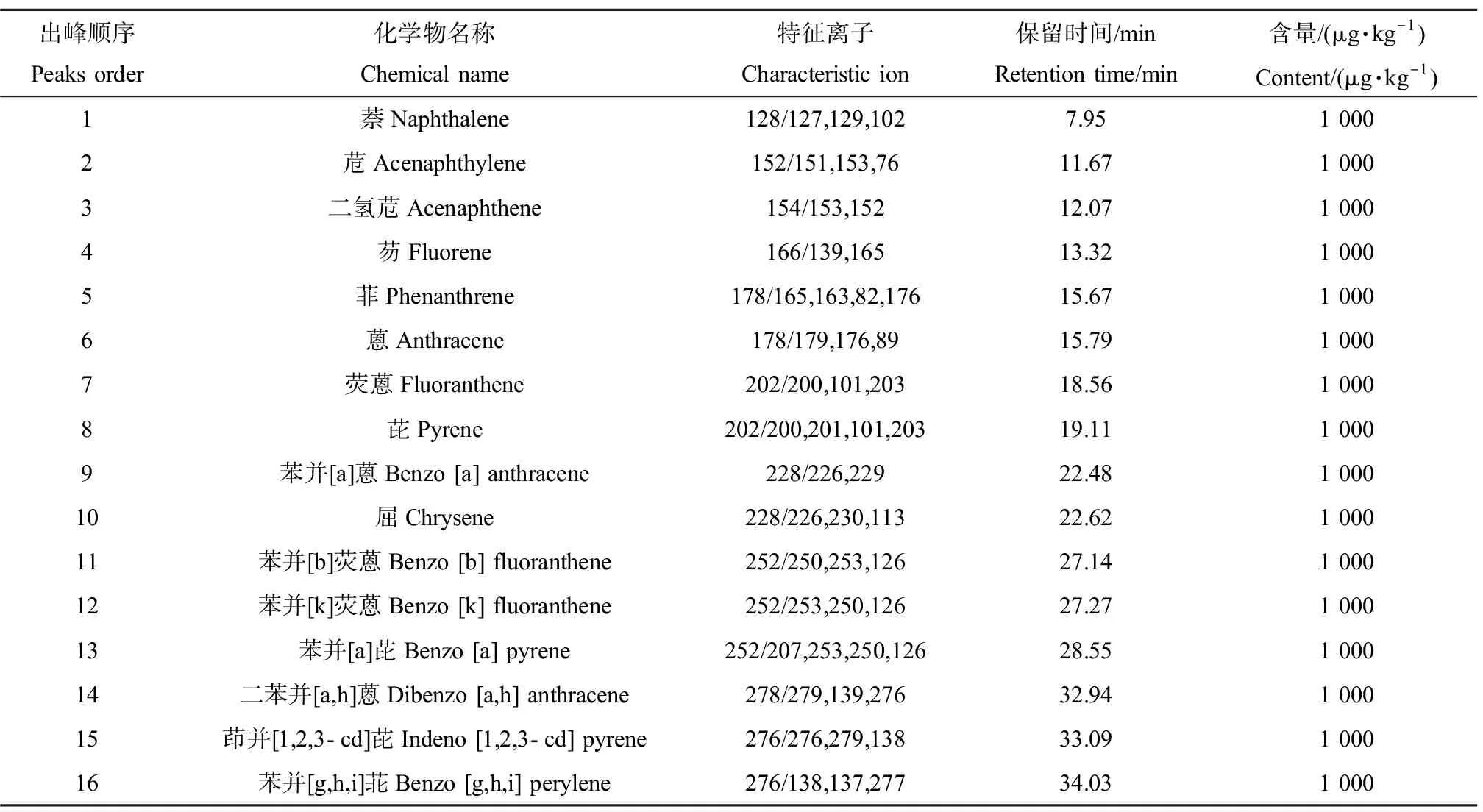
表1 16种多环芳烃(PAHs)标准样品的结构参数及GC-MS测定参数Table 1 Structural parameters and GC-MS determination parameters of 16 polycyclic aromatic hydrocarbons (PAHs) standard samples

图1 PAHs标准样品的GC色谱图Fig. 1 GC diagram of PAHs standard sample
1.5 数据统计和实验数据分析
对总PAHs在蚯蚓体内的生物富集系数(bio-concentration factors, BCF)进行计算,公式如下:
BCF=Ce/Cm
(1)
式中:Cm为暴露土壤介质中PAHs的浓度(μg·g-1);Ce为蚯蚓中PAHs富集浓度(μg·g-1)。
所有的实验组均设置3个实验组平行,结果用平均值±标准偏差表示,数据作图用Origin 2021b软件处理。实验数据使用SPSS 20.0统计软件进行单因素方差(ANOVA)分析,P<0.05、P<0.01为显著性差异。
2 结果与讨论(Results and discussion)
2.1 石油烃污染土壤中PAHs的含量及其组分特征
结果表明,石油污染附近农田表层清洁土壤中16种PAHs总含量为0.56 μg·kg-1,而石油烃污染表层土壤中16种PAHs总含量高达20 070 μg·kg-1。根据Maliszewska-Kordybach[21]提出的土壤PAHs污染评价标准,可将土壤中PAHs的残留浓度分为4个等级:未污染(<200 μg·kg-1)、轻度污染(200~600 μg·kg-1)、中度污染(600~1 000 μg·kg-1)和严重污染(>1 000 μg·kg-1)。本研究区表层清洁土壤属于未污染土壤,而石油污染土壤中PAHs的平均含量超过严重污染标准20倍,说明该地区土壤已受到PAHs超级严重污染。此外,与国内外其他地区PAHs污染严重土壤相比,如中国安徽芜湖市交通区土壤PAHs含量(5 030 μg·kg-1)、俄罗斯莫斯科国家公园交通区土壤(264 030 μg·kg-1)和印度尼西亚南加里曼丹煤炭储存地土壤(11 720 μg·kg-1)[22-24],本研究污染土壤中PAHs含量都明显偏高。根据以上结果分析,可以充分表明本地区人类石油烃开采活动对土壤PAHs超高水平污染的影响,因此急需开展PAHs治理与毒性评估工作。
土壤中PAHs环数的组成可反映其组分特征,同时也代表其不同的污染来源,在后期PAHs源解析中起着至关重要的基础数据支撑作用[25]。因此,根据16种PAHs环数组成可以将其分为2环(萘、苊、二氢苊和芴)、3环(菲、蒽和荧蒽)、4环(芘、苯并[a]蒽、屈、苯并[b]荧蒽和苯并[k]荧蒽)、5环(苯并[a]芘、二苯并[a,h]蒽和茚并[1,2,3-cd]芘)和6环(苯并[g,h,i]苝)PAHs,其相应的结构式如表2所示。由表2可知,本研究石油烃污染土壤中2个苯环的PAHs含量为3.43 μg·g-1,3个苯环的PAHs含量为12.13 μg·g-1,4个苯环的PAHs含量为3.80 μg·g-1,5个苯环和6个苯环的PAHs含量分别为0.41 μg·g-1和0.30 μg·g-1。PAHs环数占比依次为3环(60.44%)>4环(18.93%)>2环(17.10%)>5环(2.04%)>6环(1.49%)。由此可见,石油烃PAHs污染土壤中3环和4环PAHs占有较大比例(>79%),这与国内其他PAHs污染地区的组分特征研究结果保持一致[26-27]。石油烃污染土壤中含量最高的是菲,达到11.21 μg·g-1,其次>1.00 μg·g-1的依次是芴1.58 μg·g-1,屈1.27 μg·g-1,芘1.22 μg·g-1,萘1.1533 μg·g-1。

表2 石油烃污染土壤中16种PAHs的GC-MS测定参数及结果Table 2 Determination parameters and results of 16 PAHs in petroleum hydrocarbon contaminated soil by GC-MS
2.2 无石油烃污染胁迫时总PAHs及各环PAHs在蚯蚓体内的富集变化
据报道,不同环数的PAHs在蚯蚓体内的富集量是不同的[28-29]。如图2所示,在无石油烃污染暴露时,16种PAHs在蚯蚓体内也有不同程度的积累,达0.21 μg·g-1。而且,在暴露7 d与暴露14~28 d相比,总PAHs和各环PAHs在蚯蚓的体内富集浓度没有显著性差异(P<0.05),说明在7 d内蚯蚓对PAHs的富集已达到平衡。此外,暴露7 d时,蚯蚓对不同环数PAHs的富集量排序为:2环PAHs(0.11 μg·g-1)>5环PAHs(0.05 μg·g-1)>4环PAHs(0.03 μg·g-1)>3环PAHs(0.02 μg·g-1)>6环PAHs(0.01 μg·g-1),本研究结果也证实了不同环数的PAHs在蚯蚓体内的富集量确实有差异。此外,如表3所示,暴露28 d时,蚯蚓对不同环数PAHs的生物富集系数排序为:5环PAHs(0.58)>4环PAHs(0.46)>3环PAHs(0.44)>2环PAHs(0.32)>6环PAHs(0.24)。这表明,除了2环PAHs外,蚯蚓对其他多环PAHs富集量与富集系数保持一致的规律。
2.3 石油烃污染胁迫下伴随的总PAHs及各环PAHs在蚯蚓体内的富集变化

图2 未污染土壤中总PAHs及各环PAHs在蚯蚓体内的富集量Fig. 2 Enrichment of total PAHs and various cyclic PAHs in uncontaminated soil by earthworms

表3 不同暴露时间、暴露浓度下总PAHs及各环PAHs在蚯蚓体内的生物富集系数(BCFs)Table 3 Bio-concentration factors (BCFs) of total PAHs and various cyclic PAHs at different exposure duration and concentration in earthworms
在石油烃胁迫污染下7~28 d后,总PAHs及各环PAHs在蚯蚓体内的富集量如图3所示。总体而言,与无石油烃胁迫土壤相比(图2),石油烃污染土壤蚯蚓体内总PAHs(图3(a))和各环PAHs(图3(b)~3(f))的富集量都显著(P<0.05)提高,且随石油烃染毒浓度和暴露时间增加而提高。这说明蚯蚓在石油烃暴露下体内蓄积的PAHs主要来源是石油烃中PAHs。通常,PAHs在蚯蚓体内的富集与土壤中的PAHs浓度及组成有着极大的关系,因而有必要进一步考察石油烃胁迫下其伴随的PAHs含量。如表3所示,测得石油烃污染土壤中16种PAHs总含量为20.07 μg·g-1,石油烃含量为0.5、1.0、2.5、5.0、10.0和20.0 g·kg-1的土壤中PAHs的总含量依次为0.09、0.18、0.46、0.91、1.82和3.65 μg·g-1。特别是在高浓度(20 g·kg-1)暴露下这一规律显得尤为显著。例如,在20 g·kg-1石油烃污染土壤中,总PAHs在蚯蚓7、14、21和28 d富集量分别为3.55、4.59、5.57和7.05 μg·g-1,28 d富集量是7 d富集量的1.99倍,差异显著(P<0.01)。同样的趋势还出现蚯蚓对3环、4环、5环和6环PAHs的体内富集中(图3(c)~3(f))。结果表明,在相同的石油烃暴露浓度下,蚯蚓对PAHs的2环、3环和4环富集量显著(P<0.05)大于5环和6环富集量,并且土壤中石油烃暴露浓度越大,这种富集效果越明显。以上结果说明,蚯蚓对各环PAHs的富集量受到PAHs暴露浓度和暴露时间的影响。蚯蚓对PAHs的富集平衡时间与石油烃暴露的浓度存在一定关联,当无石油烃暴露时,蚯蚓在7 d内即可达到富集平衡,而当高浓度石油烃暴露时,蚯蚓对石油烃污染土壤伴随的PAHs的富集平衡时间延长了,14~28 d内都未达到富集平衡。随着石油烃暴露时间的增大(如28 d时),蚯蚓对PAHs的富集速率随其环数的增加而降低,这可能是由于PAHs进入土壤后与土壤中活性物质如有机质发生相互作用而引起的老化过程导致的,有研究表明PAHs在不同的老化时间,蚯蚓对低环数PAHs的吸收率和BCF都大于高环数PAHs(表3),表明高环数PAHs的生物有效性小于低环数PAHs[30]。污染物起始暴露浓度对生物的富集有很大影响[6, 31],本研究土壤中的2环PAHs、3环PAHs以及4环PAHs的初始暴露含量远高于5环和6环PAHs(表3),这可能是造成上述趋势的原因之一。此外,PAHs的辛醇水分配系数(Kow)也是影响PAHs生物有效性的关键因素之一,PAHs的环数不同,其辛醇水分配系数也不相同,低环数(2~4环)PAHs的辛醇-水分配系数(如萘,logKow=3.4)小于高环数(5~6环)PAHs(如苯并[a]芘,logKow=6.3),所以低环数(2~4环)PAHs更容易进入土壤空隙水中,从而容易被蚯蚓以被动扩散的方式吸收,而辛醇-水分配系数较高的高环PAHs(5~6环)则容易被土壤颗粒中黏粒组分吸附并结合,从而使得蚯蚓表现出较低的生物有效性,研究表明那些溶解于水相或者弱吸附状态的低环数(2~4环)PAHs(如萘)才更可能通过表皮或者肠道吸收的方式进入蚯蚓体内,从而增加其在蚯蚓体内富集[32-33]。Cuypers等[34]的研究表明当PAHs的环数从2环增加到6环时,PAHs分子直径相应地从0.5 nm增加到0.9 nm,而高环数大粒径的PAHs相对于低环数小粒径的PAHs更难以进入生物体内并在其体内积累。
通过公式(1)计算不同暴露时间和石油烃暴露浓度下伴随的PAHs在蚯蚓体内的BCF,结果如表3所示。结果表明,在6种不同浓度石油烃污染的土壤中,不同培养时间对蚯蚓体内总PAHs及各环PAHs富集量的影响均表现出显著性(P<0.05)差异(如对于1 g·kg-1石油烃污染的土壤,7 d总PAHs BCF为23.58;对于2.5 g·kg-1石油烃污染的土壤,28 d 5环PAHs BCF=106.03;对于20.0 g·kg-1石油烃污染的土壤,21 d 2环PAHs BCF为5.19)。除了3环PAHs在7~21 d时BCF<1外,其他所有石油烃的处理组中BCF都>1,说明蚯蚓可以较好地富集PAHs。在同一浓度石油烃暴露下,随着染毒时间的增加,蚯蚓体内总PAHs及各环PAHs的BCF总体呈增大趋势,这可能因为PAHs在蚯蚓体内的富集,而使土壤中的含量降低,使得BCF增大。对同一暴露时间而言,随着石油烃染毒浓度的增加,蚯蚓体内总PAHs及各环PAHs的BCF呈现先增大后减小的趋势,这主要是因为当石油烃染毒浓度较低时,蚯蚓对其适应性较强,可以较好地对PAHs进行富集,并且富集量很快达到阈值,使得蚯蚓PAHs中毒或者抗氧化酶活性降低,从而对PAHs的富集量保持不变或者下降,导致BCF呈下降趋势[6, 35]。通过对比不同环数PAHs的BCF发现,在1 g·kg-1石油烃污染的土壤暴露28 d后5环PAHs的BCF最大(191.03),表明蚯蚓可以很好地富集5环PAHs。
2.4 石油烃暴露浓度与蚯蚓体内PAHs生物富集特征相关性分析
已有研究表明,经过11 d,不同浓度石油烃污染物在污染土壤和蚯蚓之间均达到了动态分配稳态平衡[36],所以在富集的第28天,蚯蚓对土壤中的石油烃的PAHs富集已达到平衡,基本上不再随时间变化而发生显著变化。因此,为了进一步深入揭示石油烃污染对蚯蚓PAHs生物富集特征的影响,对28 d石油烃污染后暴露浓度与蚯蚓PAHs富集量及BCF的相关性进行了分析,结果如图4所示。由图4(a)和4(b)可知,石油烃暴露浓度与蚯蚓体内总PAHs和各环PAHs富集量的关系呈良好的正线性关系。经过28 d的富集,不同石油烃暴露浓度与总PAHs、2环PAHs、3环PAHs、4环PAHs、5环PAHs和6环PAHs的相关系数(r2)分别为0.93、0.93、0.96、0.84、0.64和0.83。以上结果说明石油烃暴露浓度和蚯蚓体内总PAHs富集量之间存在着正相关关系,而且PAHs环数越低,整体的正向相关性越好。此外,在同一暴露时间28 d下,线性拟合的斜率(K)值越大,说明富集速率越大。由此可知,蚯蚓对不同环数PAHs的富集速率大小依次为:2环PAHs(K=0.059)>3环PAHs(K=0.059)>4环PAHs(K=0.049)>5环PAHs(K=0.0064)>6环PAHs(K=0.0039)。这说明蚯蚓在石油烃胁迫28 d后对PAHs的吸收速率随其环数的增加而降低。

图3 石油烃胁迫污染下总PAHs及各环PAHs在蚯蚓体内的富集量Fig. 3 Accumulation of total PAHs and cyclic PAHs in earthworms under petroleum hydrocarbon stress
暴露28 d后,不同石油烃浓度与蚯蚓体内总PAHs和各环PAHs的BCF线性相关关系如图4(c)~4(d)所示。在低浓度(0.5 g·kg-1和1 g·kg-1)石油烃暴露下,蚯蚓对总PAHs与各环(除6环)PAHs的BCF呈显著的正相关,随着石油烃暴露浓度增加,BCF值逐渐增大。在1 g·kg-1石油烃暴露下,蚯蚓对总PAHs、2环PAHs、3环PAHs、4环PAHs和5环PAHs的BCF都达到最大值,分别为28.78、52.19、16.25、43.53和191.03(表3和图3(c)~3(d))。与之相反的是在高浓度石油烃暴露(2.5~20 g·kg-1)下,暴露浓度与BCF之间的关系呈现负线性相关关系,随着暴露浓度的增大,总PAHs和各环PAHs的BCF值呈不断减小趋势。而且,当暴露石油烃浓度>10 g·kg-1,蚯蚓对总PAHs和各环PAHs的BCF趋向缓慢降低至无明显变化。以上结果表明,随着石油烃暴露浓度的增加,在石油烃胁迫下蚯蚓对各环PAHs的富集水平具有一定的选择性,且随着高浓度石油烃暴露的浓度增加,蚯蚓对总PAHs和各环PAHs的富集能力也下降。此外,对比富集量和BCF与暴露浓度之间的关系(图4),还发现蚯蚓对总PAHs和各环PAHs的富集量与BCF的线性相关性不大,这与之前其他研究报道的结论类似[37]。
综上,本实验通过对蚯蚓在不同浓度石油烃(0~20 g·kg-1)和暴露时间(7~28 d)下对PAHs在体内的富集量和BCF进行分析,得出蚯蚓对于PAHs具有很强的富集效应,且对不同环数PAHs具有较好的选择性富集能力,因而,蚯蚓能够成为研究采油区土壤PAHs污染的指示生物。
综上可知,本研究表明:(1)蚯蚓能从石油烃污染土壤中吸收PAHs,与无石油烃污染空白对照组相比,蚯蚓对总PAHs和各环PAHs的富集作用有显著提升。(2)通过对蚯蚓对总PAHs和各环PAHs富集量研究发现,随着石油烃暴露浓度和暴露时间不断增加,蚯蚓对其中伴随的总PAHs和各环PAHs的富集量也显著性增加。此外,蚯蚓对不同环数PAHs具有明显的选择性富集特征,相比于高环数(5~6环)PAHs,低环数(2~4)PAHs更容易被蚯蚓富集。而且暴露28 d后,蚯蚓对PAHs的富集速率随其环数的增加而降低。(3)通过对蚯蚓对总PAHs和各环PAHs的BCF研究发现,在同一浓度石油烃暴露下,随着染毒时间的增加,BCF值增大;对同一暴露时间而言,BCF的值随着石油烃染毒浓度的增加呈现先增大后减小的趋势。然而,蚯蚓对总PAHs和各环PAHs的BCF与其富集量之间没有特别明显的线性相关关系,未来研究中,有关富集量和富集系数的关系有待进一步研究。

图4 总PAHs及各环PAHs在蚯蚓体内的富集量和BCF与石油烃浓度的相关性分析Fig. 4 The correlation analysis between petroleum hydrocarbon concentration and the enrichment and BCFs of total PAHs and various cyclic PAHs in earthworms

