姜黄素/茜素pH敏感蛋白纤维膜的制备及对金枪鱼鲜度的指示作用
李秋莹,于昕睿,刘 铮,林 洪,孙 彤,郭晓华,王明丽,周小敏,励建荣*
(1 渤海大学食品科学与工程学院 辽宁锦州 121013 2 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013 3 中国海洋大学食品科学与工程学院 山东青岛 266100 4 山东美佳集团有限公司 山东日照 276800 5 蓬莱京鲁渔业有限公司 山东烟台 265600 6 浙江兴业集团有限公司 浙江舟山 316120)
随着消费者对即食食品和高质量食品需求的不断增加,对食品新鲜度进行监测的食品智能包装逐渐成为研究热点。新鲜度指示标签作为智能包装的一种,可用于检测、监测和量化商品的新鲜度,消费者通过指示标签实时、方便地获知食品新鲜度信息[1]。指示标签中可以引入对温度、pH 或气体等敏感物质,直接检测食品储存过程中代谢产生的某一化合物或某一组化合物(如氮、胺、氨、乙醇、硫化氢、pH 值,甚至CO2)等食品腐败标志产物,直观、实时地反映食品的新鲜程度[2]。肉类腐败过程中,随着微生物的代谢和化学物质的降解,释放的挥发性胺导致包装顶空pH 值升高,因此,基于pH 敏感指示剂的新鲜度指示标签是监测生鲜肉类新鲜度的有效方法[3-4]。杜月红等[5]以甲基纤维素和聚乙二醇-6000 为基材,添加溴甲酚紫、溴百里酚蓝等酸碱指示剂,采用流延法制得6 种方便、无损的新鲜度指示标签,用于生鲜猪肉在4 ℃条件下贮存的新鲜度监测。Zhang 等[6]基于蒽醌和偶氮发色团,采用打印技术制备2 种pH 敏感智能变色纸,用于熟蟹的新鲜度检测试验。Chen 等[7]制备了含有姜黄素和花青素的新型pH 敏感性流延膜,用于鱼肉新鲜度的监测。
pH 敏感色素的新鲜度指示效果与其膜基质有关,与普通浇筑法或流延法制备的混合膜基质相比,纳米纤维膜基质具有更大的优势。静电纺丝技术是一种制备纳米纤维的有效技术,其制备的纤维膜利于负载活性物质,具有孔隙率高、比表面积大等优良特性,更利于色素与挥发性物质的接触,灵敏度增加,是制备pH 敏感智能包装的良好材料[8]。在鱼肉贮藏过程中,由于包装内部水分较大,会影响纤维膜指示标签的显色,因此需要制备耐水性的静电纺丝膜用于鱼肉鲜度指示。在制备静电纺丝膜的生物聚合物中,玉米醇溶蛋白(Zein,Z)和明胶(Gelatin,G)作为天然来源的蛋白质是制备具有良好机械性能和耐溶剂性能的疏水静电纺丝纤维膜的一种可行方法[9]。
姜黄素(Curcumin,CUR)是一种从姜科植物姜黄等的根茎中提取得到的天然色素,在中性、酸性条件下呈黄色,在碱性条件下呈红褐色,对还原剂的稳定性较强,着色性强,着色后不易褪色[10]。茜素(Alizarin,ALI)是一种从茜草根部提取的天然色素,在酸性条件下呈黄色,于弱碱性条件下呈红色,强碱性条件下呈蓝紫色[11]。CUR 和ALI 都是制备pH 敏感指示标签的良好材料,然而,目前未见关于这2 种色素对鱼肉显色性能的比较及混合应用的报道。
本研究采用静电纺丝技术制备载天然色素CUR、ALI 及其混合色素的pH 敏感ZG 纤维膜。分析各纤维膜的pH 敏感度,比较不同色素对ZG 纤维膜的形貌、结构、耐热及耐水性能的影响。评价3 种ZG 纤维膜对4 ℃贮藏金枪鱼鱼片新鲜度的指示作用,为pH 敏感的ZG 蛋白纤维膜在水产品贮藏中的应用提供理论参考。
1 材料与方法
1.1 试验材料
玉米醇溶蛋白(Zein)、姜黄素(CUR)、茜素(ALI),上海麦克林科技股份有限公司;明胶(Gel),上海阿拉丁生化科技股份有限公司;PCA营养琼脂,青岛高科园海博生物技术有限公司;分析级醋酸、氨水、氯化钠、氢氧化钠、硼酸、氧化镁,天津永晟精细化工有限公司。试验所用冷冻金枪鱼,辽宁省锦州市水产市场 (冷冻总时间小于3 d)。
1.2 主要仪器
ET-2535H 型静电纺丝仪,北京永康乐业科技发展有限公司;S-4800 型场发射扫描电镜,日本日立公司;Scimitar 2000 Near FT-IR Spectrometer 型傅里叶变换红外光谱仪,美国安捷伦公司;Rigaku Ultima IV 型X 射线粉末衍射仪,日本理学Rigaku 公司;Q2000-3236 型差示扫描量热仪,美国TA 仪器公司;OCA25 型光学视频接触角测量仪,北京东方德菲仪器有限公司;CR-400 型色差仪,日本柯尼卡美能达控股公司;K9840 型半自动凯氏定氮仪,济南海能仪器股份有限公司;FE20型pH 计,METTLER TOLEDO 公司。
1.3 纺丝液的制备
1.5 g Zein 和1.5 g Gel 溶于体积分数80%的醋酸水溶液中,配制聚合物总质量浓度为300 g/L的ZG 纺丝溶液,在60 ℃磁力搅拌至完全溶解,超声脱气后备用。待ZG 溶液冷却至室温后分别加入质量分数为3%的CUR、ALI 以及CUR ∶ALI=2 ∶1(质量比)的混合色素,配制CUR/ZG、ALI/ZG、CUR/ALI/ZG 纺丝液,在室温下磁力搅拌至完全溶解,超声脱气后备用。
1.4 纺丝膜的制备
将纺丝液加入注射器,选用型号20 的纺丝针,组装后装入纺丝仪,设置纺丝参数为:温度25℃,湿度40%,纺丝速度0.5 mL/h。在15 kV 静电压,接收距离18 cm 条件下,使用铝箔纸滚动接收得到ZG 纺丝膜;在17 kV 静电压,接收距离15 cm 条件下,使用铝箔纸滚动接收得到CUR/ZG、ALI/ZG、CUR/ALI/ZG 纺丝膜。
1.5 纤维膜在不同pH 条件下的显色效果分析
应用醋酸与蒸馏水分别配制pH 2~6 的挥发性酸性溶液,应用氨水与蒸馏水分别配制pH 7~12 的挥发性碱溶液。将纤维膜裁剪成1 cm2的小片作为指示标签,粘贴在含有5 mL 不同pH 值溶液的无菌培养皿的盖子内侧,用封口膜密封培养皿。在室温条件下,静置显色30 min。采用色差计测试各组指示标签颜色的L,a,b 值。L 为亮度,取值为0~100 (纯黑~纯白);a 为从红色至绿色的范围,取值为+127~-128(红~绿);b 为从黄色到蓝色的范围,取值为+12~-128(黄~蓝)[12]。按公式(1)计算其总色差值ΔE。

式中,L1、a1、b1——白色标准品的各项色度值;L2、a2、b2——所测样品的各项色度值。
1.6 扫描电镜(SEM)
纺丝膜样品喷金处理后使用场发射扫描电镜观察纳米纤维膜的形态和直径,并使用Image J图像分析软件在SEM 图像中随机取100 根纳米纤维测量纳米纤维的平均直径。
1.7 红外光谱(FTIR)
参考Deng 等[13]的方法制备KBr 压片,将纤维膜剪碎,放入玛瑙研钵中与干燥的KBr 粉末(约80~100 mg)一起研磨后装入模具内压片,将成片固定在样品板上,使用傅里叶变换红外光谱仪对纤维膜进行4 000~500 cm-1区域的红外光谱扫描。
1.8 X 射线衍射(XRD)
使用Rigaku Ultima IV X 射线粉末衍射仪分析纤维膜的晶体性质。在实验管电压40 kV、电流200 mA 条件下扫描,扫描范围为5°~90°。
1.9 差示扫描量热(DSC)
使用差示扫描量热仪分析纤维膜的热性能。扫描速度为5 ℃/min,温度范围为25~250 ℃。
1.10 水接触角(WCA)
使用接触角测量仪测量纤维膜的水接触角。将2 μL 的液滴滴在纤维表面,在0 s 和60 s 后进行测量。在纤维膜的5 个不同位置进行测试,WCA用“平均值±标准差”表示。
1.11 纤维膜在金枪鱼鲜度指示中的应用
1.11.1 原料处理与贮藏 将纤维膜裁剪成1 cm2的小块,置于紫外下照射30 min 备用。将未开封的冷冻的金枪鱼块在4 ℃冰箱中完全解冻,在冰盘上切成薄片。将鱼片随机分成2 组,一组样品放入无菌蒸煮袋,一组样品分别放入多个无菌培养皿中(每个培养皿中10 g 鱼肉),每个培养皿均加盖附有3 种指示膜的盖子。两组样品密封后均于4 ℃条件下贮存。分别在0,3,6,9 d 测定蒸煮袋中金枪鱼片的菌落总数(TVC)、pH 值和挥发性盐基氮值(TVB-N),并拍摄记录培养皿中的纺丝膜颜色,测定色差。
1.11.2 鱼片的鲜度指标测定 采用倾注法测定鱼片样品的TVC。准确称量10 g 鱼片加入含有90 mL 0.85%无菌生理盐水的蒸煮袋中,拍打均质60 s。将均质液进行10 倍梯度稀释。并选取适当稀释倍数的稀释液1 mL 与PCA 培养基混匀。平板于28 ℃倒置培养48 h 后计数,结果用lgN 形式表示,其中N 为每克样品(CFU/g)中菌落的单位数。准确称量5 g 绞碎鱼肉加入45 mL 中性蒸馏水中,均质后静置30 min,使用FE20 型pH 计测定金枪鱼片的pH 值,每组试样重复3 次。准确称量10 g 绞碎鱼肉加入70 mL 无菌蒸馏水,均质,加入1 g 氧化镁,使用K9840 型半自动凯氏定氮仪,对金枪鱼鱼片的TVB-N 值进行测定,结果表示为mg N/100 g。
1.11.3 纤维膜颜色变化与鱼片新鲜度的相关性分析 在鱼片贮藏期间,纤维膜的色差值ΔE 值测定方法同1.5 节。使用SPSS 对纤维膜的色差值与TVC 值、pH 值和TVB-N 值的相关性和显著性进行分析。
1.12 数据分析
每个测试均做3 次重复,采用SPSS 19.0 软件进行统计学分析,计算分析获得数据的平均值和标准偏差,当P<0.05,数值具有显著性差异。另外,采用Origin 9 和Image J 图像分析软件生成所需图表。
2 结果与分析
2.1 纤维膜的pH 敏感性分析
CUR/ZG、ALI/ZG、CUR/ALI/ZG 纤维膜在不同pH 值条件下的颜色变化及色差值ΔE 如图1所示。随着pH 值的升高,CUR/ZG 纤维膜的颜色由金黄色逐渐变为红色,这与Yanina 等[14]制备的CUR/Gel 膜的显色结果相似;ALI/ZG 纤维膜的颜色由黄褐色逐渐变为红褐色,并在强碱性条件下变为紫灰色,Parya 等[15]的研究也发现了类似结果;CUR/ALI/ZG 纤维膜的颜色由金黄色逐渐变为红褐色,并在强碱性条件下变为黑褐色(图1a)。随着pH 值的升高,3 种纺丝膜的总色差值ΔE 整体上均呈上升趋势(图1b)。在pH 2~6 范围内,CUR/ZG、ALI/ZG、CUR/ALI/ZG 纤维膜的ΔE 变化不大,从pH 2 至pH 6,ΔE 的差值均小于6,说明3 种纤维膜在pH 2~6 范围内均无明显的颜色变化,这与视觉观察结果一致(图1)。在pH 7~12 范围内,CUR/ZG 的ΔE 值增加了18.51;ALI/ZG 的ΔE 值增加了32.48;CUR/ALI/ZG 的ΔE 值增加了28.48。以上结果表明3 种纤维膜在pH 值较高时,具有显著的颜色变化,有望应用在鱼类的新鲜度指示中,然而3 种纤维膜的性能需要进一步比较。
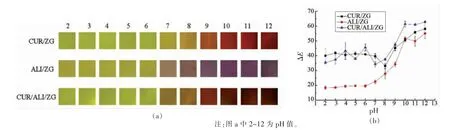
图1 纤维膜在不同pH 值条件下的颜色变化(a)及ΔE 值(b)Fig.1 The color variation and ΔE value of CUR/ZG,ALI/ZG,CUR/ALI/ZG nanofiber membranes under different pH conditions
2.2 纤维膜的形态分析
采用扫描电镜对ZG、CUR/ZG、ALI/ZG、CUR/ALI/ZG 4 种纤维膜的形态进行观察(图2)。4 种纤维均呈表面光滑的圆柱形。ZG 纤维的平均直径为 (810±240) nm,CUR/ZG、ALI/ZG 和CUR/ALI/ZG 纺丝膜的纤维直径分别为 (990±150) nm,(1 120±210)nm 和(960±140)nm。其中,CUR/ZG和CUR/ALI/ZG 的纤维直径分布较为集中,而ALI/ZG 的纤维直径不均匀。显然,CUR 和ALI 色素的添加使ZG 直径增大,然而形貌没有明显变化。静电纺丝过程中,表面张力、黏度和电导率是影响纳米纤维直径分布的关键因素[16]。ZG 纤维直径的增加可能与色素添加后纺丝液的黏度和表面张力变化有关。陈艳[17]的研究表明,CUR 的添加会使纺丝液的黏度和表面张力减小。此外纤维直径的改变也与纺丝电压有关。Zhao 等[18]研究发现降低电压会导致静电场对带电溶液射流的影响减小,从而降低了射流的飞行速度。较长的飞行时间将使纤维在沉积于收集器上之前有较长的延伸时间,因此很容易形成细纤维。CUR/ZG、ALI/ZG、CUR/ALI/ZG 纤维膜的纺丝电压较ZG 膜增大,可能使纤维直径增加。
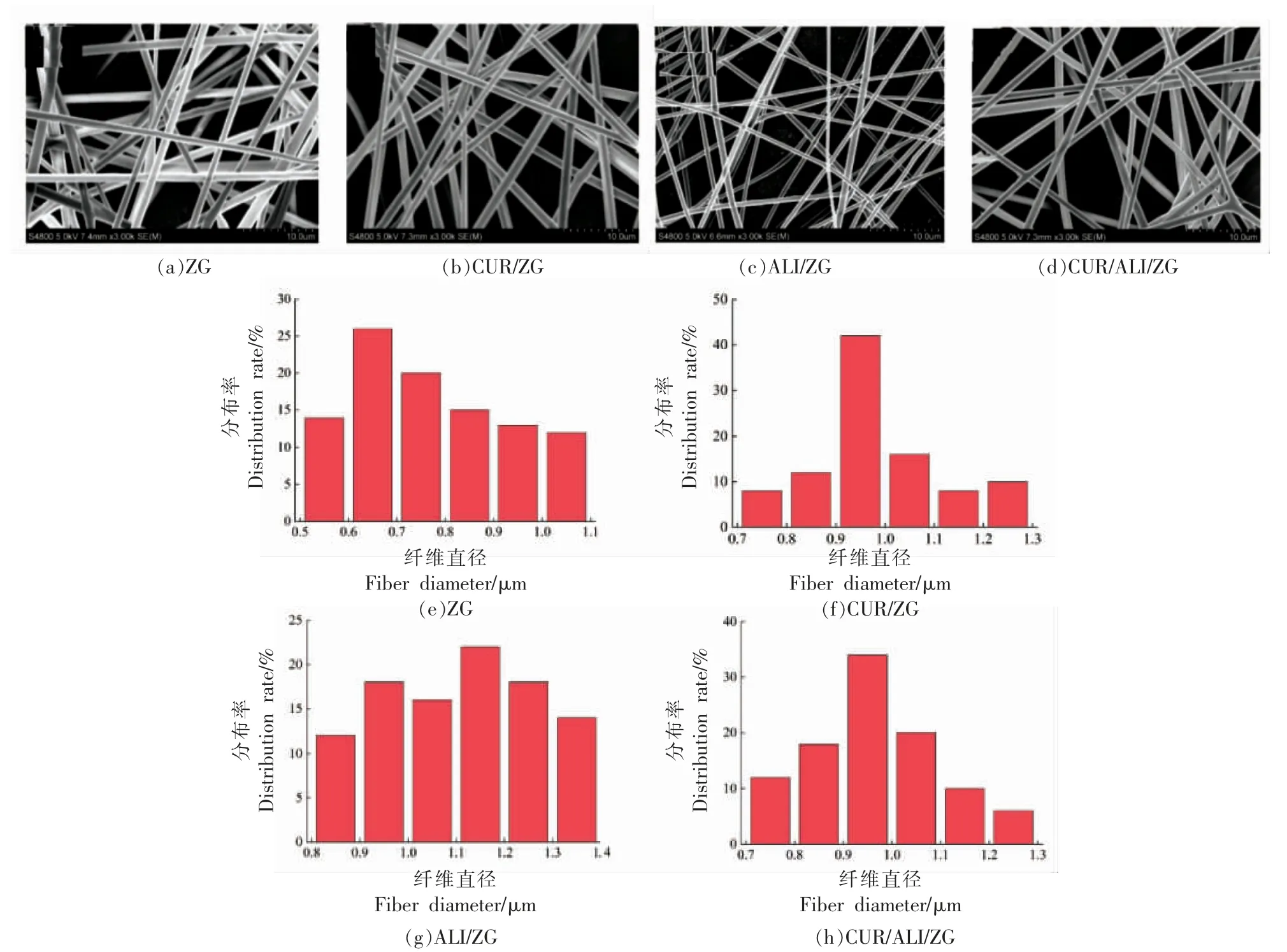
图2 ZG 纤维膜的形态和直径分布Fig.2 Morphologies and diameter distribution of the ZG nanofiber membranes
2.3 纤维膜的化学组成分析
图3a 为ZG、CUR/ZG、ALI/ZG、CUR/ALI/ZG纤维膜的FTIR 谱图。4 种纤维膜的主峰相似,而振幅有所变化,有些峰发生了位移。ZG 的FTIR 谱图显示了蛋白的特征峰:3 305 cm-1处是N-H 和O-H 的伸缩振动峰;1 658 cm-1为C-O 的伸缩振动峰,属于酰胺Ⅰ带;1 539 cm-1为N-H 平面内弯曲振动和C-N 振动,属于酰胺Ⅱ带;1 244 cm-1为N-H 弯曲振动,属于酰胺III 带[9]。CUR/ZG 纤维膜中酰胺I、酰胺Ⅱ和酰胺III 相关的峰分别由1 658 cm-1迁移到1 652 cm-1,由1 539 cm-1迁移到1 541 cm-1,由1 244 cm-1迁移到1 236 cm-1;ALI/ZG 纤维膜中酰胺I、酰胺Ⅱ和酰胺III 相关峰分别由1 658 cm-1迁移到1 653 cm-1,由1 539 cm-1迁移到1 540 cm-1,由1 244 cm-1迁移到1 241 cm-1;CUR/ALI/ZG 纤维膜中酰胺I 相关的峰分别由1 658 cm-1迁移到1 652 cm-1;这可能是由于CUR和ALI 色素的添加与ZG 膜组分之间发生了氢键等相互作用,从而引起C=O 和N-H 基团在聚酰胺结构中的弱化[19]。由于蛋白质的酰胺I 带为二级结构(如α-螺旋)相关的碱性带组成,加入CUR和ALI 色素后,CUR/ALI/ZG 的酰胺I 谱带强度降低,表明其α-螺旋结构减弱[19]。CUR/ZG、ALI/ZG、CUR/ALI/ZG 纤维膜在1 280 cm-1和1 283 cm-1处出现了ZG 膜中不存在的特征峰,表明CUR 和ALI 被添加到了ZG 膜中。
采用XRD 对ZG、CRU/ZG、ALI/ZG、CUR/ALI/ZG 4 种纤维膜的结晶性进行分析,结果如图3b所示。ZG 纤维膜在2θ=20.7°附近存在一个相对平缓的宽峰,表明ZG 纤维膜存在的是非晶态结构。添加了CUR 的CUR/ZG 和CUE/ALI/ZG 纤维膜均在2θ=9.4°和2θ=17.5°两处存在尖锐的特征峰,这是由于CUR 本身具有结晶结构所致[20];添加了ALI 的ALI/ZG 和CUR/ALI/ZG 纺丝膜均在2θ=12.4°处有一个较弱的尖锐特征峰,这是由于ALI 本身的蒽醌结构具有一定结晶性所致[21];同时4 种纺丝膜均在2θ =20.7°附近存在宽峰,表明CUR 和ALI 这两种天然色素经静电纺丝成功地添加到了ZG 膜中,并保持了其原有的晶体结构。

图3 ZG 纤维膜的FTIR(a)和XRD(b)谱图Fig.3 FTIR (a) and XRD (b) spectra of ZG nanofiber membranes
2.4 纤维膜的耐热性能分析
ZG、CRU/ZG、ALI/ZG、CUR/ALI/ZG 4 种纤维膜的DSC 结果如图4所示。从图中可以看出,ZG、CRU/ZG、ALI/ZG、CUR/ALI/ZG 4 种膜在65 ℃处均有较小的吸热峰,这可能与高聚物的玻璃化转变有关。ZG 纤维膜在142 ℃附近出现明显吸热峰,CUR/ZG 的吸收峰在138 ℃,CUR/ALI/ZG 的吸收峰在130 ℃附近出现,这说明CUR 的加入降低了ZG 纺丝膜的熔融温度。CRU/ZG、CUR/ALI/ZG纺丝膜在173 ℃处有较小的吸收峰,这是由于此处为CUR 粉末的熔点[22],也说明在纺丝膜中依然存在CUR 的晶体结构,这与XRD 的结果一致。ALI/ZG 在161 ℃处出现吸收峰,相对ZG 纺丝膜发生了明显的偏移,这可能是由于ALI 与Zein/Gel 的疏水性基团相互作用结合在一起,形成了纳米结合体结构从而提高了纤维膜的熔融温度[21]。
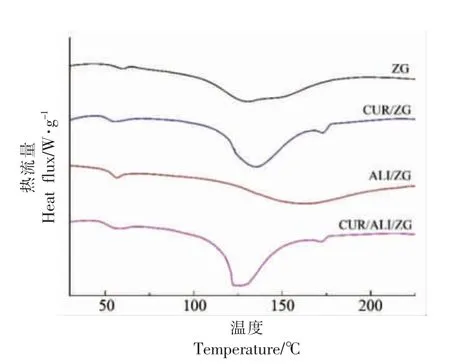
图4 ZG 纤维膜的DSC 图Fig.4 DSC graphs of ZG nanofiber membranes
2.5 纤维膜的表面疏水性分析
图5为ZG、CRU/ZG、ALI/ZG、CUR/ALI/ZG 4种纤维膜的水接触角测量结果。ZG 纤维膜的水接触角从141.16°±4.47°在60 s 下降到136.53°±5.57°,说明其水溶性较低,耐水性较好,这与陈霞[23]的研究结果相似。CRU/ZG 纤维膜的水接触角从134.46°±3.27°降低到110.68°±5.22°,ALI/ZG 纤维膜的水接触角从135.78°±4.16°在60 s 后下降到105.14°±4.37°,两种纤维膜的耐水性均有所降低,这可能是由于CUR 和ALI 的添加增加了大量的亲水基团(-OH),从而导致纤维膜耐水性的降低[21,24]。CUR/ALI/ZG 纤维膜的水接触角从140.23°±3.82°下降到116.36°±3.67°,其耐水性较ZG 纤维膜明显下降,然而相对CRU/ZG 和ALI/ZG 提升。结果表明,CRU 和ALI 的添加会降低ZG 纤维膜的疏水性,然而CRU 和ALI 复合添加可以降低这种影响。较好的耐水性可以防止纤维膜在应用中被水蒸气润湿而导致的显色效果不佳,因此纤维膜的耐水性越高其应用价值越高。

图5 ZG 纤维膜的水接触角图Fig.5 Water contact angle graphs of ZG fiber membranes
2.6 纤维膜对金枪鱼新鲜度指示作用
2.6.1 金枪鱼片4 ℃贮藏期间的品质变化 采用TVC、pH 值和TVB-N 等鲜度指标来评价金枪鱼片4 ℃贮藏期间的品质变化。鲜鱼TVC 水平为2.52±0.25 lg (CFU/g),4 ℃条件下贮藏6 d 后为6.36±0.10 lg(CFU/g),超过国际食品微生物委员会(ICMSF)的规定鲜度限值106CFU/g,表明此时金枪鱼开始腐败(表1)。金枪鱼鱼片在贮藏期间的pH 值呈先降低后升高的趋势(表1),在第3天时pH 值最低,这是由于鱼类死后酸性化合物的生成和乳酸、磷酸等积累,使得pH 值下降[25],而后随着微生物和内源酶的作用,分解蛋白质产生碱性物质,导致pH 值升高,表明贮藏后期鱼类腐败程度加重。从表1数据可知,金枪鱼鱼片的TVB-N 值随着贮藏时间的延长而逐渐增加。初始TVB-N 含量为(10.19±0.21)mg N/100 g,表明此时鱼肉是新鲜的。贮藏6 d 后,TVB-N 值增加到(15.03±0.16)mg N/100 g。虽然6 d 后TVB-N 值尚未超过Giménez 等[26]提出的25 mg N/100 g 的可接受上限,而贮藏6 d 时的样品出现了腐败和变质。有时,TVB-N 值不能准确地反映鱼的新鲜度,有些研究发现感官评价拒绝的样品TVB-N 值仍然在可以接受的范围[27]。因此,金枪鱼在4 ℃下的货架期为6 d 左右。
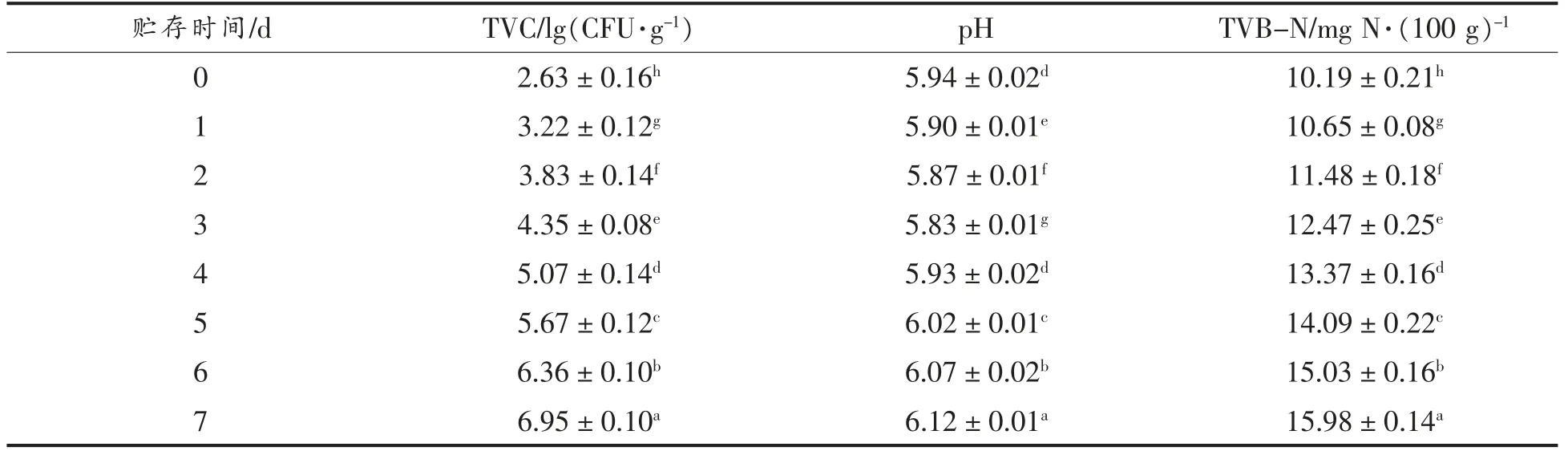
表1 TVC、pH 值、TVB-N 在金枪鱼片4 ℃贮藏期间的变化Table 1 Changes in TVC,pH value,and TVB-N of tuna fillets during 4 ℃storage
2.6.2 金枪鱼鱼片贮藏过程中纤维膜的颜色变化 如图6a 所示,在0~5 d,3 种纤维膜未发生明显的颜色变化,而在第6 天和第7 天发生了显著的颜色变化,CUR/ZG 指示标签由金黄色变为橙色,ALI/ZG 指示标签的颜色由暗黄色变为紫色,CUR/ALI/ZG 指示标签的颜色由金黄色变为黄褐色。由于金枪鱼从第6 天开始发生腐败变质,表明指示标签的颜色变化与金枪鱼鱼片的腐败密切相关。
指示标签在金枪鱼片4 ℃贮藏期间的色差值变化如图6b 所示。在0~2 d,CUR/ZG、ALI/ZG 和CUR/ALI/ZG 指示标签的ΔE 值波动较大,然而其感官上此时颜色并未发生明显变化,这可能是由于指示标签在鱼片贮藏初期被包装内散发的水蒸气润湿,从而改变了指示标签的亮度所致,其中ALI/ZG 指示标签所受影响最大,这与前文讨论其耐水性不佳的结果相符。在2~5 d,3 种指示标签的ΔE 值变化不大,根据新鲜度指标测定结果,此时金枪鱼片仍保持较新鲜的状态,包装内pH 值变化不大。在5~6 d,CUR/ZG 和ALI/ZG 指示标签的ΔE 差值均小于CUR/ALI/ZG 指示标签的ΔE差值,表明CUR/ALI/ZG 指示标签在金枪鱼鱼片腐败时发生的颜色变化更显著。
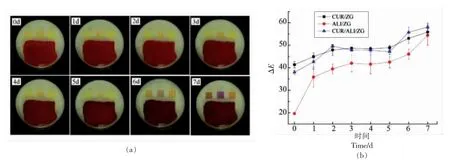
图6 指示标签在金枪鱼鱼片4 ℃贮藏期间的颜色变化(a)及ΔE 值(b)Fig.6 Color variation (a) and ΔE value (b) of the indicator labels during 4 ℃storage of tuna fillets
2.6.3 纤维膜的颜色变化与金枪鱼鱼片品质变化的相关性分析 金枪鱼鱼片贮藏过程中纤维膜的颜色变化与TVC、pH、TVB-N 值变化之间的相关性分析如表2所示,其各新鲜度指标与总色差值ΔE 均为显著相关(P<0.05)。其中各指示标签ΔE与TVC 和TVB-N 值之间的Pearson 相关系数绝对值均为高度相关(≧0.08),随着TVC 和TVB-N的增加,颜色变化更加明显。这可能由于TVC 与TVB-N 的变化均为线性增长,而pH 值的变化为先下降后升高。3 种指示标签均对TVB-N 和TVC值有高度相关性,表明纤维膜颜色变化可以反映金枪鱼鱼片品质变化。
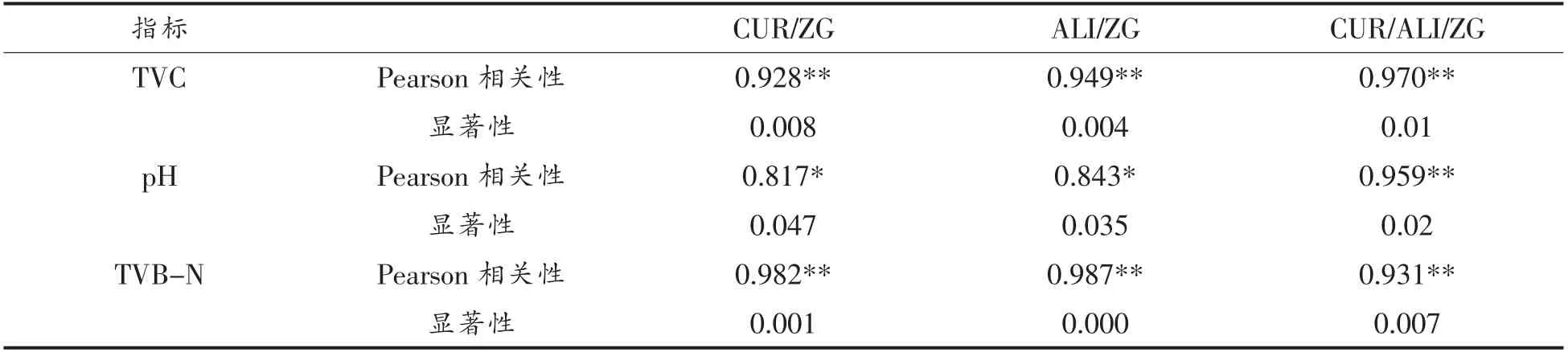
表2 3 种指示膜的色差值与TVC、pH、TVB-N 变化的相关性和显著性分析Table 2 Correlation and significance analysis between color difference and TVC,pH,TVB-N change of three kinds of indicator labels
3 结论
本研究采用静电纺丝技术,成功制备了可用于金枪鱼贮藏过程中新鲜度指示的载CUR 和ALI 的pH 敏感ZG 蛋白纤维膜。CUR 和ALI 的添加使ZG 的纤维直径略有增大,然而未对纤维形态造成其它不良影响。将CUR 和ALI 经静电纺丝成功地添加到了ZG 蛋白膜基质中,并保持了其原有的晶体结构。CUR 和ALI 对ZG 膜的耐热性和耐水性具有一定影响,其中CUR 和ALI 均降低了ZG 膜的耐水性,而CUR/ALI 复合添加对耐水性的影响更小。CUR/ZG、ALI/ZG 和CUR/ALI/ZG均可以通过显著的颜色变化指示金枪鱼鱼片的腐败情况,且与TVC 和TVB-N 的新鲜度指标的变化有良好的相关性。其中,CUR/ALI/ZG 耐水性更强,在鱼类鲜度指示中具有更广阔的应用前景。

