一个白质消融性白质脑病家系新基因突变及临床表型研究
班婷婷林彩梅 张 琰 郑小兰 吴玲玲 谢 昆 魏春苗 苏惠红
(复旦儿科厦门医院(厦门市儿童医院),厦门 361006)
白质消融性白质脑病(leukoencephalopathy with vanishing white matter,VWM)是一种罕见的新生儿至成年均可起病的常染色体隐性遗传的脑白质病变,其特点为慢性进行性脑白质功能障碍,可由发烧或外伤等诱发神经系统功能迅速恶化[1]。VWM的临床表型差异大,可表现为共济失调、运动障碍、视神经萎缩、认知障碍、癫痫等。VWM可累及所有年龄段人群,根据发病年龄和病程特点,可分为5种类型,分别为先天型、婴儿型(发病年龄≤1岁)、早期儿童型(发病年龄2~4岁)、青少年型(发病年龄5~15岁)、成人型(发病年龄>15岁)[2]。其中早期儿童型最常见。VWM的致病基因为编码真核细胞翻译启动因子2B(eukaryotic translation initiation factor 2B,EIF2B),EIF2B5个亚单位所对应的编码基因EIF2B1~5中任一基因突变均可导致发病[3]。目前EIF2B5个基因突变中,EIF2B5突变最常见(63%)[4]。VWM的临床诊断依赖于临床特点及典型的头颅磁共振成像(magnetic resonance imaging,MRI)表现,确诊则需进行基因检测[1]。现将厦门市儿童医院确诊的一白质消融性脑病家系报道如下。
1 材料与方法
本研究回顾性分析一同卵双胎VWM患儿家系,该家系患儿2021年7月于厦门市儿童医院就诊并完善基因检测后确诊,本研究收集患者的病史(随访数据为电话获得)、体格检查及头颅MRI影像资料、基因检测数据等,并对患儿进行随访,随访时间为首次就诊后1年。MRI检查采用德国Sienens Skyra3.0T超导型碰共振扫描仪扫描,8通道相控阵头颅线圈。检查序列包括轴位T1WI、T2WI、T2-FLAIR、DWI,矢状位T1WI。具体扫描序列及扫描参数如下。T1WI:TR 2 000 ms,TE 9.0 ms,矩阵512×512,FOV 23 cm×15 cm;T2WI:TR 4 330 ms,TE 10 ms,矩 阵512×512,FOV 23 cm×16 cm;T2-FLAIR:TR 9 000 ms,TE 81 ms,TI 2 500,层厚5 mm,层间距1.0 mm。本研究由厦门市儿童医院伦理委员会批准,患儿家属同意并签署知情同意书。
2 结 果
2.1 临床资料
先证者1,女,4岁10月,因“步态异常2月”就诊,表现为下肢步态异常、会交叉腿、易摔倒、逐渐加重、上下楼需扶栏杆、无肢体疼痛、无关节肿痛、无发热、无抽搐、无智力倒退。既往史无特殊。出生无窒息缺氧病史。发病前生长发育同正常同龄儿。父母非近亲结婚。查体:神志清楚,精神反应可,全身皮肤无牛奶咖啡斑、色素脱失斑,头颅无畸形,颅神经查体阴性,各关节无红肿,活动自如,四肢肌力、肌张力正常,双侧腱反射活跃,踝阵挛阳性,脑膜刺激征、共济失调征阴性。辅助检查:头颅MRI(2021.7.28)显示双侧大脑半球、小脑及胼胝体压部广泛脑白质异常(图1)。
先证者2,为先证者1同卵双胎的妹妹,女,4岁10月,因“步态异常1.5月”就诊,临床表现为下肢步态异常,查体:双侧腱反射活跃,踝阵挛阳性,余无阳性体征,头颅MRI表现亦为双侧大脑半球、小脑及胼胝体压部广泛脑白质异常(图1)。
持续电话随访,目前先证者1年龄5岁10月,因“半年前于滑梯上摔倒后运动功能倒退明显”,目前不能独走,不能独站,可扶站,可独坐,智力尚与同龄儿无明显差异。先证者2运动功能近1年无明显倒退。
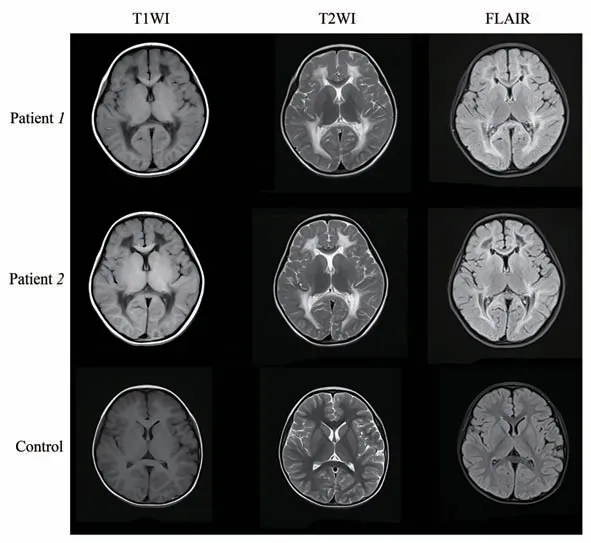
Fig.1 The brain MRI of patient 1,patient 2 and control
2.2 基因检测结果
对患儿及家长进行全外显子测序及Sanger验证,发现EIF2Bδ亚单位的编码基因EIF2B4存在基因变异C.1544 T→A(p.Leu515Gln)和C.1445 G→T(p.Arg 482Leu),均为尚未报道的错义突变。患儿父亲携带C.1544 T→A,患儿母亲携带C.1445 G→T(p.Arg 482Leu)。根据ACGM评级指南,C.1544 T→A(p.Leu515Gln)和C.1445 G→T(p.Arg 482Leu)变异为致病性变异,支持生物学意义致病等级判断的依据如下:该变异在ExAC、gnomAD、千人基因组亚洲人群数据库中的发生频率极低或没有收录;多款变异预测软件提示该变异可能有害;该基因关联疾病为常染色体阴性遗传病,患者及有相似病史的妹妹两位点均为杂合,符合复合杂合,合子类型可以解释患者临床表现。故先证者1和先证者2均确诊白质消融性白质脑病(图2)。

Fig.2 The sequence of EIF2B4 in the family
3 讨 论
白质消融性白质脑病是一种常染色体隐性遗传的脑白质病,1997年Van Der Knaap等[5]报道了首例临床诊断病例。从2001年到2002年,它被发现是 由EIF2B的5个 亚 基(EIF2B1、EIF2B2、EIF2B3、EIF2B4、EIF2B5)中的任何一个突变引起的[6]。本病主要临床特点为进行性的运动智力倒退,以运动为主,可表现为小脑共济失调,肢体痉挛等,可伴视神经萎缩及癫痫发作[7]。病程中遇发热、轻微头部外伤等应激事件后发作性加重,最后因反复加重而导致死亡。本病临床表型差异较大,根据起病年龄及病程特点可分为先天型、婴儿型、早期儿童型、青少年型及成年型。其中以早期儿童型又称经典型最为常见,且起病年龄与疾病严重程度呈负相关[8],发病年龄和疾病的严重程度从新生儿期到成年期有很大的差异,该疾病的早期发病通常与快速进展和不良预后相关。本报道患儿均为4岁左右发病,发病表现均为运动功能倒退,但无智力受损表现,无抽搐,无意识障碍等,值得注意的是先证者1在头部外伤后出现运动功能的明显倒退,这与文献提及的发作性加重现象相符,这也为此类患儿的护理指导提供了理论依据。
虽然VWM的发病机制被越来越多的认识,但广泛表型的原因尚不清楚。一个明确的基因型表型相关性尚未建立。EIF2B1~5是在真核细胞中发挥重要作用的管家基因。它们编码EIF2B,这是启动蛋白质翻译的关键因素。因此本病导致EIF2B蛋白无法合成和翻译起始功能的丧失。目前认为EIF2B5突变最为常见[5],约占61.9%,其中大多数为错义突变,本文中2例为EIF2B4基因突变,突变致病性尚未见国内外文献报道。
在VWM中,应激是触发或加重倒退的因素,包括头部创伤、急性惊吓和发热性感染[9]。本研究报道了一对确诊患有白质消融性脑白质病的同卵双胎姐妹,该姐妹有相同的遗传背景及大致相同的生长环境,因此其有着相似的发病时间与表现,但由于先证者1发病后经历了1次外伤的打击,致其运动功能倒退更为明显与迅速,而先证者2近1年运动功能相对稳定,是其完美躲过了发作性加重的诱发因素还是另有其他原因?还需要进一步的研究证实,而该研究可进一步揭示基因型与表型的关系。有研究显示不同的细胞应激导致EIF2α磷酸化,然后作为EIF2B的竞争性抑制剂,抑制mRNA的翻译。细胞应激反应的一个中心机制是抑制蛋白质合成,这被称为未折叠蛋白反应[10]。这一过程的目的是通过转录特殊的开放阅读框(ORF),减少mRNA的积累,逃避翻译抑制,从而保持细胞能量,提高细胞在应激下的存活。然而,如果细胞应激状态仍未纠正,使蛋白质反应过度激活,它可能导致过度翻译抑制和可能的多器官功能障碍,这可能是VWM恶化的原因[11]。因此,所观察到的相当大的表型变异性表明,基因型并不是决定表型的唯一因素[12]。
虽然头颅MRI显示白质受累管广泛,但星形胶质细胞增生却很少,且受累区域白质星形胶质细胞形态异常,这提示VWM患者星形胶质细胞功能不足[13],由此提出了一个假说的观点,即星形胶质细胞是承受功能冲击最大的白质细胞类型,从而驱动了VWM神经病理学的其他方面。研究发现,VWM患者白质星形胶质细胞成熟障碍,且表达过多的中间丝巢蛋白(intermediate filament nestin)及胶质纤维酸性蛋白(GFAP)的异常剪切[14];VWM患者的星形胶质细胞还可以影响少突胶质细胞,不成熟的星形胶质细胞没有能力支持少突胶质祖细胞向髓鞘形成细胞的成熟[15];目前发现其他相关疾病机制包括激活未折叠蛋白反应、星形细胞-小胶质细胞交流的失败,以及可能对氧化磷酸化的继发影响等[16-17]。
VWM头颅MRI表现具有特征性,起病时MRI表现明显重于临床症状是此症的特征之一:大脑白质弥漫对称的异常信号,始于侧脑室周围白质及其边缘的深层白质,逐渐扩展至外周的深层白质和皮质下白质,最终全部大脑白质受累。因此中央白质表现为弥漫受累时,皮质下白质可以仅表现为部分受累[18]。本报道的2例患儿发病时的影像均符合以上特点,目前尚未对患儿进行头颅MRI影像学随访。
本病目前尚无有效治疗方法,只能对症治疗以及避免感染、头颅外伤、过度惊吓等。一些研究仅为该病的治疗提供基础知识,但还没有动物实验及临床试验的出现。
4 结 论
本研究报道了一同卵双胎的VWM家系中2个新的错义突变,扩大了对于EIF2B家族基因在疾病中的认识,并通过复习相关文献进一步熟悉了该病的头颅MRI表现及临床特点,初步认识了其发病机制,从而为后续临床及基础研究提供线索。

