神经胶质细胞转分化为神经元的研究进展
赵晓初 罗兆莉 杨 菲 李 纤*
(1)首都医科大学基础医学院,北京 100069;2)首都医科大学基础医学院生物化学与分子生物学学系,北京 100069;3)首都医科大学基础医学院神经生物学学系,北京 100069)
神经元(neuron)在胚胎发育中由神经祖细胞(neuroepithelial cells,NEs)经过神经元发生相转变为放射状胶质细胞(radial glial cells,RGs),通过不对称分裂直接产生,也有一些神经元通过中间祖 细胞(neural progenitors,NPs)间 接 分 化 产生[1]。出生后,中枢神经系统(central nervous system,CNS)中的神经元再生能力十分匮乏,仅侧 脑 室(lateral ventricle)的 室 管 膜 下 区(subventricular zone,SVZ)和 海 马 齿 状 回(dentate gyrus,DG)的 颗 粒 下 区(subgranular zone,SGZ)等几处保留少量来自放射状胶质细胞系的胶质源性纤维酸性蛋白(glial fibrillary acidic protein,GFAP)阳性细胞,在内源性条件与外源性因素的共同作用下,缓慢生发少量神经元,迁移至所需位置并整合入神经网络发挥功能[2]。
在神经系统疾病中,不可逆的神经元丢失是疾病发生发展过程中一个关键且共有的环节。帕金森病(Parkinson’s disease,PD)患者出现运动障碍/运动迟缓、震颤、僵硬和姿势不稳等运动症状,主要源自于黑质致密部中的多巴胺(dopamine,DA)能神经元的丢失[3];阿尔茨海默病(Alzheimer’s disease,AD)患者不同大脑区域中都能观测到神经元数量的减少,且海马CA1区和内嗅皮质中神经元的丢失与记忆缺陷的严重程度呈正相关[4];在脑卒中(stroke)发生后,每晚1 min得到救治,患者神经系统就丢失1.8亿个神经元[5],从而导致不可逆的感觉缺失、运动障碍和精神后遗症等。因此,寻找能够进行神经元补充、神经网络整合和功能恢复的科学手段,对神经系统疾病的临床改善是十分迫切且必要的。
中枢神经系统的固有细胞主要包括神经元、神经胶质细胞(glia)以及巨噬细胞等[6]。神经胶质细胞在神经组织中数量庞大、功能复杂,人脑中胶质细胞的数量占人类全部中枢神经系统细胞的90%[7]。位于中枢神经系统的神经胶质细胞主要包括星形胶质细胞(astrocytes)、少突胶质细胞(oligodendrocytes)和小胶质细胞(microglia)等。小胶质细胞产生于胚胎时期的卵黄囊并迁入中枢神经系统[8],其他的神经胶质细胞与神经元均起源于神经外胚层(neuroectoderm)[7](图1)。在胚胎神经发生的过程中,RGs在神经发生后期向胶质细胞发生相转变,主要生成星形胶质细胞和少突胶质细胞[1,9]。其中,星形胶质细胞是脑内最丰富的细胞群之一,约占中枢神经系统细胞总数的50%[10]。在健康的中枢神经系统中,星形胶质细胞参与突触的形成,去除细胞外液中多余的神经递质以实现神经信号的精准传递,并通过与神经元的双向交流来调节突触与神经系统功能、行为和信息处理;还能够通过调节局部血流增减葡萄糖与氧气供应,并为神经元提供葡萄糖或乳酸等作为能量底物[7,11]。少突胶质细胞由RGs经少突胶质前体细胞(oligodendrocyte progenitor cells,OPCs or NG2 cells)分化而来[12],在中枢神经系统不同部位占比不同。其在脊髓背侧柱中占总细胞数的37%~42%,其中脊髓灰质后角占13%~16%,但在大脑皮层和海马灰质仅占4%~5%[13]。少突胶质细胞能够包裹轴突,在维持轴突的完整、提供支持与缓冲等保护、辅助神经元沿轴突快速有效地进行电信号传导中发挥关键作用,并通过自身糖代谢为神经元轴突提供诸如葡萄糖、乳酸和糖酵解产物等能量底物,支持其电活动[14]。小胶质细胞属于单核细胞系统,约占中枢神经系统细胞总数的5%~10%[15]。小胶质细胞是中枢神经系统内再生能力最强的胶质细胞,在合适条件下可达每日新增20%的增殖速度[16-17],在中枢神经系统中清除碎片和吞噬细胞、维持神经系统稳态[18],并为其他中枢神经系统细胞的发育等提供支持[16]。总的来说,由于神经胶质细胞数量众多,易于增殖,与神经元空间位置相近,这为神经胶质细胞向神经元的转分化提供了得天独厚的条件。
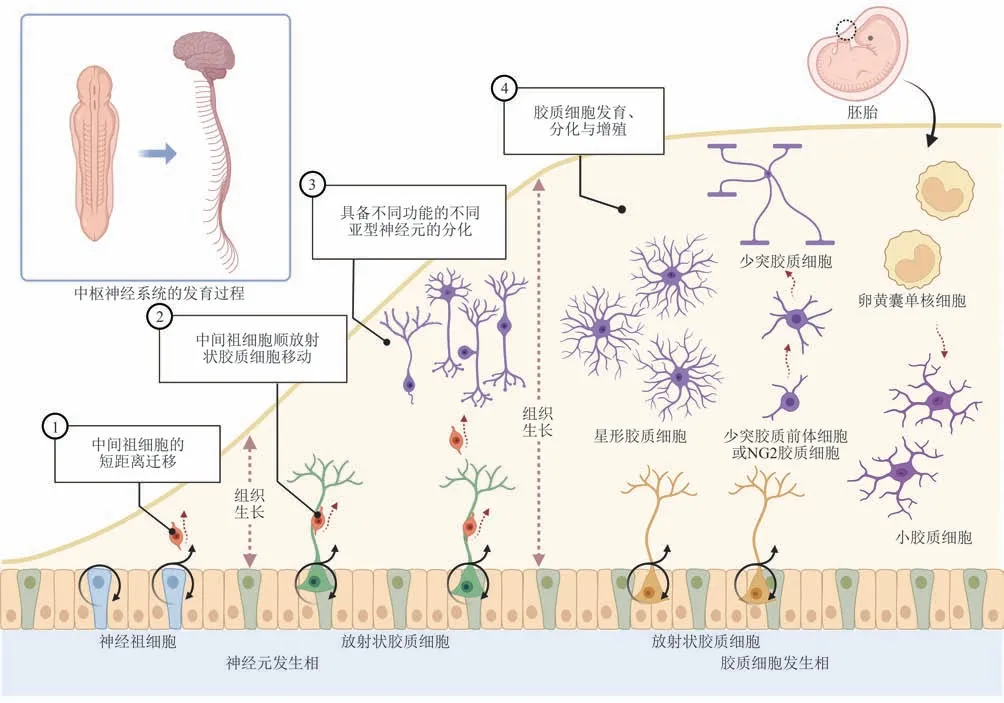
Fig.1 The development of neuronal and glial cells in the central nervous system图1中枢神经系统神经元与神经胶质细胞发育过程
为改善神经元丢失这一病理进程,学者们尝试将非神经元细胞在一定条件下诱导为具有以下特征的神经元:具备胞体、轴突与树突的神经元基本形态;表达Tuj1、MAP2、NeuN、Synapsin等神经元标志物;具有神经元极化特点;表面表达有功能的膜通道蛋白(如电压门控Na+通道)和能够被激活的神经递质受体(如谷氨酸受体);具备静息电位、动作电位等神经元电生理特性;具有形态(包含突触小泡等结构)和功能(具有自发的突触后电流)完整性,能够整合进入神经网络并在撤除诱导因素后仍保持神经元特性的稳定[19]。如前所述,神经胶质细胞与神经元位置相近、谱系相同,因而胶质细胞-神经元转分化以其原位、直接等优点,成为逆转神经元丢失的潜在有效手段[20],因而作为这一领域中的热点问题之一,受到了广泛的关注与期待。
所谓转分化(cellular conversion),指通过各种手段对细胞进行基因重编程,使某种细胞跳过诱导多能干细胞状态,直接转变为另一种细胞并表达其特征的过程[21]。如能成功实现神经胶质细胞向神经元的转分化,并整合入神经网络,则中枢神经系统疾病病理过程中的神经元丢失就可能得到逆转,神经系统功能就可能得到改善,神经系统疾病的临床治疗可能因此产生新的希望。
1 星形胶质细胞-神经元转分化的研究进展
中枢神经损伤后,受损处原本处于静止状态的星形胶质细胞被表皮生长因子(epidermal growth factor,EGF)、纤维生长因子(fibroblast growth factor,FGF)、内皮素1(endothelin 1)和三磷酸腺苷(adenosine triphosphate,ATP)等激活为反应性星形胶质细胞(reactivated astrocytes),并重新进入细胞周期增殖增生[22-23]。反应性星形胶质细胞因所受刺激不同,能够通过不同信号通路改变自身功能并影响其他细胞,导致神经功能障碍[23]。此外,星形胶质细胞长时程激活会形成难以降解的胶质瘢痕(glial scar),虽然限制了神经炎症的扩散,但其在神经损伤修复的过程中会通过多种复杂的信号级联反应产生细胞毒性分子,抑制突触与髓鞘的再生、对附近的神经通路造成长期负面影响,导致慢性炎症或神经性疼痛[23]。由于其在刺激下能够增殖甚至去分化并获得部分神经干细胞的特性[24-25],星形胶质细胞作为可能向神经元转分化的一种理想原料成为研究者们的关注对象。另一方面,将星形胶质细胞转分化为神经元可能减少胶质瘢痕对神经修复的长期负面影响,可能为神经损伤后的修复带来积极影响。
研究者们首先将目光聚集在体内自然状态下的神经发生过程中、对细胞命运改变起到关键作用的转录因子上,诸如配对框基因6(paired-box 6,Pax6)[26]、少突胶质细胞转录因子2(oligodendrocyte lineage transcription factor 2,Olig2)[27]、原神经基因2(neurogenin 2,Ngn2)[28]、神经母细胞特异性转移因子1(achaete-scute homolog 1,Ascl1)[29]、无 远 端 同 源 盒2(distal-less homeobox 2,Dlx2)[30]、神 经 分 化 因 子1(neurogenic differentiation 1,NeuroD1)[31]等,希望通过对其转录活性进行操纵,以达到胶质细胞转分化为神经元的目的(图2)。
2002年,德国马克斯·普朗克研究所Magdalena Götz教授课题组首次发现,如果使用包含Pax6 cDNA的逆转录病毒,感染出生后5~11 d分离培养的小鼠皮层Pax6-的星形胶质细胞,则能够成功诱导其转分化为具有神经元胞体与突起的形态、表达Tuj1和NeuN等标志物、并对谷氨酸和γ-氨基丁酸(γ-amino butyric acid,GABA)有反应的神经元[26]。经该团队探索,Pax6在自然状态中是一种在发育的皮层RGs中表达的神经元命运因子[32],在小鼠胚胎皮层中能够通过上调Ngn2、下调Ascl1促进神经元命运的决定[26],在星形胶质细胞[26]与反应性星形胶质细胞[26]中亦能够诱导表达部分早中期神经元发育标志物,而这些神经元是否具有功能仍待探索[27]。在成年体内神经发生中,Olig2是一种与Pax6相互拮抗的转录因子[33],且Olig2基因和原神经基因的不同组合对神经外胚层谱系向神经元、少突胶质细胞或星形胶质细胞的发育有决定性意义[34]。在局部缺血和AD模型小鼠皮质内,使用能够拮抗内源性Olig2功能的逆转录病毒感染反应性星形胶质细胞,可以将其转分化为表达双皮质素(doublecortin,DCX)的未成熟神经元[27]。接着,Götz教授团队又使用编码GFP、Ngn2-IRES-GFP或Ascl1-IRES-GFP的VSV-G假 性逆转录病毒感染从出生后5~7 d小鼠的大脑皮层中分离培养的星形胶质细胞,成功将其转分化为具有基本神经元形态特征、GFP与Tuj1双阳性、能够接受输入性刺激并可产生电活动的突触后神经元[35],通过膜片钳等电生理手段对转分化而来的神经元的膜电位、突触活动进行检测,通过免疫荧光染色检测能够代表神经元功能活性的标志物Tuj1,首次验证了星形胶质细胞能够转分化为具备神经元电生理特性的、有功能的神经元,并提出了不同转录因子诱导星形胶质细胞向不同神经元亚型转分化的可能性。随后学者们陆续发现,应用逆转录病毒转染从出生后早期(2~7 d)的小鼠皮层中分离培养的星形胶质细胞,过表达Ngn2可通过上调T盒脑1(T-box brain 1,Tbr1)诱导谷氨酸能神经元的产生[36],同时过表达Dlx2和Ascl1诱导GABA能神经元的产生[36],而同时过表达Ascl1、LIM同 源 框 转 录 因 子1(LIM homeobox transcription factor 1 beta,Lmx1b)或核受体相关因子1(nuclear receptor related factor 1,Nurr1),则使星形胶质细胞转分化为DA能神经元[37]。更重要的是,通过适当的表达神经外胚层谱系细胞向神经元分化的命运决定因子能够诱导出具备功能性突触前输出、能自发形成神经网络的诱导神经元[36],解决了转分化神经元无法整合进入神经网络的问题[35]。此外,胶质细胞转分化为神经元的效率也从原本的较为低下[26,35],通过一定比例转录因子的搭配提高到了较高的水平[37]。
在过表达神经元命运决定相关转录因子介导的星形胶质细胞-神经元转分化中,NeuroD1引起了最为广泛的关注。NeuroD1是一种具有基本螺旋-环-螺旋(basic helix-loop-helix,bHLH)结构域的转录因子,仅在胰岛、肠内分泌细胞、胃与神经元、神经干细胞中表达[38-39],对诸如腺苷酸激酶同工酶1(adenylate kinase isozyme 1,AK1)、肌醇1,4,5-三磷酸受体1(inositol 1,4,5-triphosphate receptor 1,IP3R1)、早 期B细 胞 因子3(early B-cell factor 3,Ebf3)和POU结构域转录因子脑3d(brain 3d,Brn3d)等神经分化有关基因的转录激活十分重要[40],在胚胎神经发生(尤其是海马和小脑中颗粒细胞的生成[41])以及成年神经发生、成熟和存活中均起到决定性作用[42],并能诱导神经元的终末分化[43]。通过向1~14个月龄的小鼠脑内立体定位注射VSV-G假型逆转录病毒,在小鼠脑内星形胶质细胞中过表达NeuroD1,在脑外伤、AD模型小鼠皮质中星形胶质细胞转分化为功能性谷氨酸能神经元[44],首次完成了体内星形胶质细胞向神经元的转分化[44]。这些新生神经元能够整合入局部神经环路,修复神经元丢失造成的功能丧失[44]。而后,有学者发现,利用腺相关病毒9(adeno-associated virus 9,AAV9)穿过血脑屏障,在纹状体等部的非反应性星形胶质细胞中过表达NeuroD1,在生理状态下也能够成功将其转化为神经元[45]。以上成果为过表达NeuroD1诱导星形胶质细胞-神经元转分化提供了基础,使学者们开始尝试将NeuroD1应用于更多疾病模型与临床转化(表1)。针对神经元丢失导致的中枢神经系统疾病,陈功教授团队使用AAV在缺血性脑卒中小鼠与猴的皮质中实现了过表达NeuroD1,成功将星形胶质细胞转分化为神经元[39,46];在亨廷顿舞蹈症(Huntington’s disease,HD)模型小鼠纹状体中,实现了同时过表达NeuroD1和Dlx2将星形胶质细胞转分化为神经元[47];在脊髓挫伤、刺伤(stab wound lesion)小鼠模型脊髓背角中实现了过表达NeuroD1或同时过表达NeuroD1和Dlx2,将星形胶质细胞转分化为脊髓神经元亚型,并能整合入脊髓神经环路中[48]。针对以神经元过度兴奋和突然同步放电为特征的癫痫[49],陈功教授团队成功运用基于NeuroD1过表达的胶质细胞-神经元转分化的神经再生型基因疗法,将颞叶癫痫模型大鼠的海马脑区的星形胶质细胞原位转分化为抑制性中间神经元,有效地降低了癫痫发作,为难治性颞叶癫痫的治疗带来了新希望[50]。针对星形胶质细胞来源的恶性胶质母细胞瘤(glioblastoma,GBM),陈功教授团队通过NeuroD1在体外将人胶质母细胞瘤细胞转分化为VGluT3+的谷氨酸能神经元,为胶质母细胞瘤的治疗提供了新的可能[51]。
众多研究结果展现了通过过表达NeuroD1操纵星形胶质细胞命运,使其高效转分化为神经元的可能性,以及这一手段在临床应用中的巨大潜在前景。然而近期,过表达NeuroD1诱导星形胶质细胞-神经元转分化的可能性受到了质疑与广泛讨论。德州州立大学西南医学中心张春立教授认为,由于基因编辑技术的缺陷,仅仅依据病毒表达的荧光报告基因(例如GFP或mCherry)作为判定新生神经元来源,并不能作为转分化的金标准:AAV病毒携带的基因可能串联或重组,导致NeuroD1序列对于荧光报告基因原本应有的顺式调节作用变成一种类似于反式调节作用,导致荧光报告基因的异常表达[52];同时由于AAV、慢病毒会发生泄漏,因此报告基因能够表达在原位神经元中,而非被基因编辑的星形胶质细胞中[52]。张春立教授团队还通过谱系追踪法等多种手段证明,“转分化的神经元”在谱系追踪中无法追溯至过表达NeuroD1的星形胶质细胞,而是来源于本就存在的原位神经元[53]。面对质疑,陈功教授团队通过转录组测序(RNAsequencing)等手段发现NeuroD1在星形胶质细胞向神经元转分化的过程中发挥出强大的驱动力,并触发了快速的转录组学变化[54]。同时他们利用双光子活体成像展示了星形胶质细胞(包括谱系追踪胶质细胞)逐步转化为神经元的过程,并发现NeuroD1在不同脑区中诱导转分化形成不同类型的神经元,再次验证了过表达NeuroD1可以诱导星形胶质细胞向神经元转分化的结论[55]。陈功教授认为,张春立教授团队未能成功将星形胶质细胞转分化为神经元有多种可能原因,包括:a.AAV滴度超过安全剂量导致神经元泄漏与胶质细胞损伤;b.转分化现象观察窗口期过短导致现象未出现;c.NeuroD1表达量不足以克服tdTomato标记的星形胶质细胞的转分化阻力等[56]。目前,尽管通过过表达NeuroD1诱导星形胶质细胞向神经元转分化这一手段表现出令人期待的潜力,但NeuroD1过表达能否使星形胶质细胞向神经元转分化的问题仍在探讨,且NeuroD1如何介导星形胶质细胞-神经元转分化的分子机制也未被明确解答,再加上AAV、慢病毒、逆转录病毒的使用可能导致一系列临床安全问题,NeuroD1距离真正应用于临床仍然道阻且长。
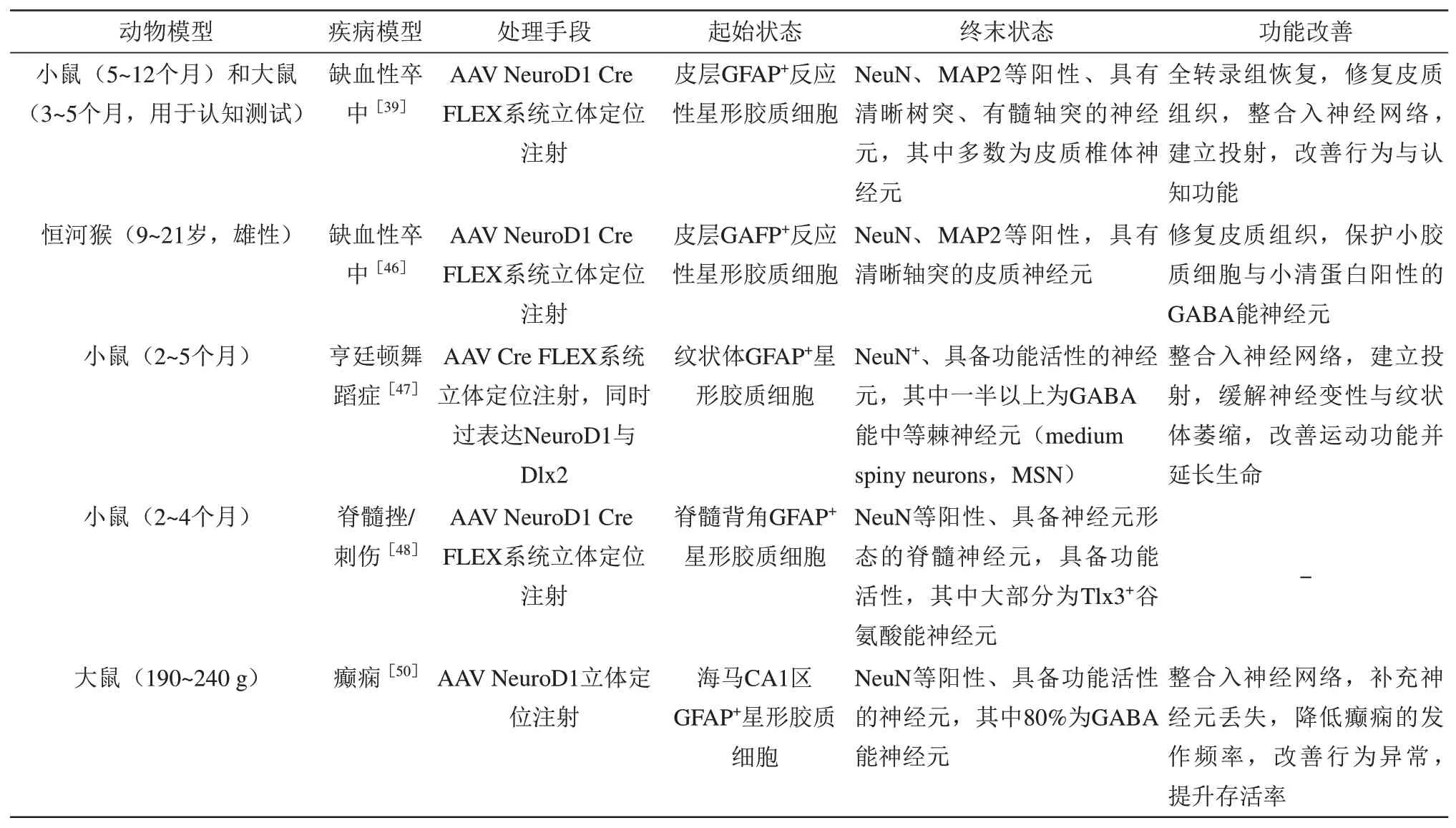
Table 1 Results of neuroregenerative therapy based on overexpression of NeuroD1 in disease models表1基于过表达NeuroD1的神经再生疗法在疾病模型中的研究成果
不同于上述将神经元命运决定相关转录因子上调的“加法”策略,“减法”策略旨在通过在非神经元细胞中敲低在神经分化过程中自然下调的关键抑制性转录因子来诱导生成神经元。“减法”策略中备受关注的转录因子是多嘧啶区结合蛋白(recombinant polypyrimidine tract binding protein,
Ptbp)。Ptbp是一类核糖核酸(ribonucleic acid,RNA)聚嘧啶区结合蛋白,在哺乳动物中包括Ptbp1~3三个成员。其中Ptbp1在哺乳动物除神经元外的大多数组织细胞中表达,能够调节可变剪接、信使RNA(messenger RNA,mRNA)翻译与mRNA稳定性等,从而维持神经元基因主要抑制因子的活性,抑制细胞向神经元分化的倾向[57]。敲减Ptbp1是将成纤维细胞转分化为神经元的充分且必要的条件[58],利用小发夹RNA(short hairpin RNA,shRNA)在星形胶质细胞中敲减Ptbp1,也能够将其转分化为功能性神经元,并可在PD小鼠模型中诱导产生新的有功能的DA能神经元、重建受损神经环路、恢复纹状体多巴胺水平,并有效挽救DA能神经元损失,减轻PD小鼠模型的运动功能障碍[59-60],在老年小鼠中也完成了神经元的转分化和功能整合[61]。使用CRISPR-CasRx系统将Müller胶质细胞中的Ptbp1基因敲减,也被证明在完整和受损的成熟视网膜中将胶质细胞在体转分化为视网膜神经节细胞,并建立中央投射,在药物性视网膜损伤的小鼠模型中部分恢复了视觉功能[60]。这些研究为胶质细胞转分化为神经元提供了新的思路、手段与证据,为PD及其他神经退行性疾病提供了极具前景的治疗策略和方法。
针对Ptbp1,许多团队亦发文表示需要重新审视通过敲减Ptbp1诱导星形胶质细胞转分化的可能。在两种谱系小鼠皮层中运用CRISPR-CasRx进行敲减时,未观测到内源Ptbp1表达量的明显降低,也没有在谱系追踪时观察到胶质细胞转分化为神经元的现象[53];使用shRNA进行敲减时,虽然观测到内源Ptbp1敲减,但未观测到谱系标记的星形胶质细胞转分化为神经元[53];通过CRISPRCasRx或shRNA敲减Ptbp1都无法将Müller胶质细胞转分化为视网膜神经节细胞[62];星形胶质细胞特异性谱系追踪下通过shRNA和反义寡核苷酸(antisense oligonucleotide,ASO)敲减Ptbp1均无法在生理或PD病理状态下,将星形胶质细胞直接转分化为DA能神经元并改善小鼠运动障碍[63];利用遗传谱系示踪和单细胞测序谱系追踪,通过传统基因编辑方法进行Ptbp1敲除,同样未能观测到视网膜Müller胶质细胞或皮层、纹状体的星形胶质细胞向神经元转分化[64]。约翰·霍普金斯大学Seth Blackshaw教授认为,之前研究成果中观察到的失明小鼠的视觉恢复和PD小鼠的行为恢复可能是特异性启动子GFAP在内源性神经元中的异位表达或在Ptbp1的脱靶效应所致[65]。针对Ptbp1的讨论仍在继续,尽管质疑声频起,但Ptbp1在胚胎发育的过程中的确对神经分化表现出十分有力的抑制作用[66],故而敲减Ptbp1诱导星形胶质细胞向神经元转分化具备一定的理论可行性,此后的实验中应秉着更加审慎的态度持续探究与探讨。
2 小胶质细胞-神经元转分化的研究进展
尽管星形胶质细胞数量多,且与神经元同为神经外胚层谱系的成员,但其再生能力相对较弱[67]。相较而言,小胶质细胞是分布在整个中枢神经系统的常驻免疫细胞,再生能力十分强大,且脑外伤、脑卒中、神经退行性疾病等病理改变均能够引起其大量的激活和增殖[68]。另外,小胶质细胞的消除基本不会在健康成年小鼠引起明显的副作用,反而能在病理状态下一定程度上通过减轻小胶质细胞引起的炎症而缓解中枢神经系统疾病的病理改变[68]。因此,近两年学者们将目光投向了小胶质细胞,对其是否具备转分化为神经元的潜能进行了研究和探讨。
2019年,九州大学Nakashima团队实现了通过慢病毒在小胶质细胞内过表达NeuroD1,在体外、体内都成功诱导了小鼠小胶质细胞转分化为表达Tuj1与MAP2ab等神经元标志物,有神经元基本特性且与原代神经元基因表达谱一致的神经元[69](图2)。在转分化成功的神经元中,VGluT1+的谷氨酸能神经元占比约75%,GAD67+的GABA能神经元占比约25%[69]。在分子层面,NeuroD1的过表达能够通过调节组蛋白修饰与DNA甲基化水平,通过表观遗传调控神经元转录激活Scrt1与Meis3两种转录因子,再通过转录抑制Mafb与Lyl1两种小胶质细胞免疫相关基因,加速小胶质细胞特性的消失[69]。这一研究首次提出了小胶质细胞转分化为神经元的可能,使神经原位再生与细胞替代疗法有了新的潜在选择,具有较高的临床价值与转化意义。
然而也有观点认为,小胶质细胞属于单核细胞系,由胚胎早期卵黄囊髓系祖细胞分化产生[8],而神经元属于神经外胚层谱系,由RGs分化产生[70],与小胶质细胞发育谱系差别较大,小胶质细胞不具备向神经元转分化的理论可行性[68]:包括NeuroD1在内的转分化诱导因子均在神经外胚层谱系RGs分化的过程中参与决定细胞的命运[42],并不表达在小胶质细胞所在的髓系谱系中,所以髓系谱系中不一定存在支撑神经外胚层谱系细胞命运决定的下游元件。2021年,有研究通过谱系追踪和活细胞成像等技术发现,使用慢病毒过表达NeuroD1,无法诱导小胶质细胞转分化为神经元,反而表达NeuroD1的小胶质细胞发生大规模死亡[68]。这也印证了之前陈功教授团队亦无法通过NeuroD1诱导小胶质细胞向神经元转分化的结果[44]。针对NeuroD1能否诱导小胶质细胞转分化的讨论仍在继续,如若成功,小胶质细胞向神经元的转分化这一手段的临床应用前景巨大。
3 NG2胶质细胞与少突胶质细胞-神经元转分化的研究进展
少突胶质前体细胞(OPCs,也称为NG2胶质细胞),作为成年哺乳动物中枢神经系统中最常见的祖细胞,终身具备增殖分化的能力,能够随时重新激活增殖,或分化为少突胶质细胞或星形胶质细胞[71]。相较星形胶质细胞,NG2胶质细胞具备卓越的增殖分化能力,可能成为源源不断的原料;而相较小胶质细胞,NG2胶质细胞与神经元谱系一致,向神经元转分化的可行性更高。因此,NG2胶质细胞走入神经再生领域学者的视野,成为诱导向神经元转分化的优良候选对象(图2)。
学者们同样希望通过特异性高表达神经元的转录因子或拮抗NG2胶质细胞中抑制神经元命运的转录因子,诱导NG2胶质细胞转分化为神经元。性别决定区Y盒蛋白2(sex-determining region Ybox2,Sox2)在神经发育中,对神经干细胞特性的维持及神经元亚型的分化中起重要作用[72]。在刺伤后的小鼠大脑皮质中利用逆转录病毒单独过表达Sox2或同时过表达Sox2与Ascl1,可诱导NG2胶质细胞转分化为DCX+的神经元[73]。随后,Sox2的上调也被发现能在脊髓损伤中诱导NG2胶质细胞重编程为神经元,并促进新生神经元与神经通路形成突触连接与脊髓损伤后的功能恢复[74]。此外,在成年小鼠纹状体NG2胶质细胞中利用慢病毒同时过表达Ascl1、Lmx1a和Nurr1,能够将其转分化为GABA能和谷氨酸能神经元,并长时间保持稳定的功能性神经元电生理特性[75]。
在星形胶质细胞与小胶质细胞中争议颇多的NeuroD1与Ptbp1两种因子,也在NG2胶质细胞与少突胶质细胞的转分化中受到关注。通过过表达NeuroD1,可以将体外培养的小鼠皮层NG2胶质细胞和脑外伤小鼠的皮层NG2胶质细胞,转分化为有功能的谷氨酸能和GABA能神经元[44];通过慢病毒转染体外培养的小鼠皮层少突胶质细胞过表达NeuroD1,也能将其转分化为NeuN和MAP2ab双阳性的神经元[69]。在小鼠纹状体少突胶质细胞中敲减Ptbp1,成功诱导其转分化为表现出正常电生理特性的成熟神经元[76]。目前,NG2胶质细胞/少突胶质细胞-神经元转分化似乎已成为胶质细胞-神经元转分化中争议最少的部分,未来可能为中枢神经系统疾病,尤其是脊髓相关疾病带来新的希望。
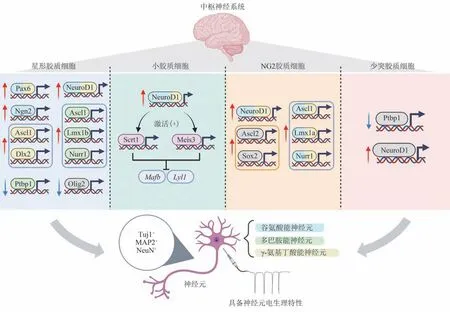
Fig.2 Glial cell-neuron conversion图2胶质细胞-神经元的转分化
4 讨论与展望
使用干细胞重编程(reprogramming)为神经元,是最早尝试的以补充丢失神经元为治疗策略的研究方向。已有研究发现,人和小鼠源的骨髓来源的间充质干细胞(bone marrow-derived stromal mesenchymal stem cells,BMSCs)可在体外、体内分化,重编程为神经元[77-78],人与小鼠源的成纤维细胞等体细胞经诱导多能干细胞(induced pluripotent stem cells,iPSCs)状态重编程为神经干/祖细胞后并最终分化为功能性神经元[79-82]。虽然这些研究成果,均为疾病状态下神经元再生的治疗策略奠定了基础[83],但体外重编程耗时长而移植窗口短,体内重编程难以实现,同时诱导多能干细胞向神经元的分化存在效率低、整合难、易癌变和高免疫原性等问题,极大地降低了其临床转化性[84-87]。
目前,使用星形胶质细胞、小胶质细胞、NG2胶质细胞等神经胶质细胞,在离体或在体模型上向神经元的转分化,均已取得一定的研究进展,也是目前神经再生领域的热门话题。就目前的研究进展而言,胶质细胞存在实现在体、原位、安全转分化为神经元的可能,一旦实现稳定高效的神经胶质细胞-神经元转分化,将为神经系统疾病的治疗带来新的希望。
星形胶质细胞和NG2胶质细胞是神经外胚层谱系分化而来的神经胶质细胞,研究者们已成功利用多种手段将其诱导为新生神经元,整合到现有的神经元回路中在体内形成正确连接,并在一些突出的神经系统疾病(包括PD、AD和HD)的小鼠模型上,实现了基于星形胶质细胞/NG2胶质细胞转分化神经元再生的可行性。与此同时,研究者们对在星形胶质细胞内过表达NeuroD1或敲减Ptbp1等部分转录因子的编辑,是否具备介导转分化的功能、对现有研究在实验设计的合理性与逻辑性等问题存疑,因此通过操纵NeuroD1和Ptbp1的表达,进而诱导胶质细胞向神经元转分化的可行性仍在探讨。
值得思考的是,在转分化的诱导过程中,使用病毒载体插入整合的手段进行转录因子的过表达或敲减,不仅存在很大的不确定性(如病毒携带基因插入方向不定、基因可能存在串联、病毒可能发生泄漏等),也可能存在巨大的安全风险(载体基因组整合入人类基因组易致瘤等)[87-88]。以上问题,为科学研究结果结论是否精准与可重复,以及临床应用是否靶向与安全带来隐患。因此,如更改转录因子的递送手段,改用细胞因子或化合物以纳米材料为载体进行定向投递等手段取代基因治疗途径,改变胶质细胞表达谱,将其诱导为神经元,或许能增加解决目前在安全性和伦理上遇到的瓶颈问题。
另外,现有研究多使用标志物共表达的实验判定新生神经元的来源,但受限于现存递送技术的高滴度依赖性与易发生泄漏等缺陷,标志物共表达也许不再是证明神经元来源的最佳判断标准。因此,使用并基于需求开发更加精准的技术,验证新生神经元的来源是平息质疑与进行进一步探索的最优选择。谱系追踪,是目前干细胞领域的“金标准”,且目前中枢神经系统内全部胶质细胞种类都可以使用基于Cre-loxP系统的报告基因进行永久追踪,因此使用谱系追踪等方式,或许能够更加严谨的论证新生神经元的来源[52]。目前,星形胶质细胞/NG2胶质细胞-神经元转分化中各因子的作用机制尚不完全明确,且大多在非灵长动物和体外培养的人胶质细胞内实践,因此,在这一领域中,以下问题亟待进一步探索:a.安全高效的因子递送手段的开发;b.胶质细胞成功转分化为神经元的判定标准的确立;c.诱导因子在转分化过程中作用机制的探索;d.在灵长动物和人脑中重复结论。
相对于与神经元同谱系的两种胶质细胞,小胶质细胞向神经元转分化则道阻且长。尽管有研究提出小胶质细胞向神经元转分化的可能,但针对小胶质细胞向神经元转分化的理论与实验证据都显得较为匮乏,只有严谨明确的谱系追踪、设计合理的对照组、明确的活体/活细胞成像证据与杀死该细胞后转分化现象的消失,才能证明胶质细胞-神经元转分化现象的真实存在[68]。目前,小胶质细胞能够通过某种诱导转分化为神经元的论断仍未得到公认。未来应设计更加严谨合理的研究思路,通过更加科学准确的技术手段,获取更加翔实确凿的实验证据,以确定小胶质细胞-神经元转分化的可能性。
总而言之,胶质细胞-神经元转分化的研究正迅速发展,并已经取得一系列显著的成果。尽管目前针对一些研究存在部分质疑,但讨论与质疑是推动科学发展的原动力,相信在未来这一领域的面纱终将揭开,胶质细胞-神经元转分化的研究也终将为中枢神经系统疾病的患者带来福音。

