半乳甘露聚糖在支气管扩张症合并肺曲霉菌病中的诊断价值
周景坤,杨彩虹,冯 涛,崔华英
(1.东营市东营区人民医院 a.医学影像科; b.药剂科; c.老年病科,山东 东营 257085;2.东营市胜利油田中心医院 呼吸与危重症医学科,山东 东营 257034)
支气管扩张症是一种常见的慢性呼吸系统疾病。目前该病在我国的发病率高达1 200/10万,给人民群众的生命财产安全造成了严重的威胁[1-3]。
支气管扩张急性加重导致患者病情急性加重、死亡风险增加。这其中,支气管扩张合并肺曲霉菌病的隐匿性高,死亡率高,是导致支气管扩张急性加重的重要原因。支气管扩张合并肺曲霉菌病的早期诊断对治疗和预后都甚为关键。近年来,检测半乳甘露聚糖(GM)水平越来越多地被应用于侵袭性肺曲霉菌病的辅助诊断[4-5]。本研究通过检测东营市胜利油田中心医院呼吸与危重症医学科住院的128例支气管扩张患者血清及支气管肺泡灌洗液(BALF)GM水平,评估血清GM和BALF-GM在支气管扩张合并肺曲霉菌病中的诊断价值。
1 资料与方法
1.1一般资料 收集2018年3月-2021年3月于东营市胜利油田中心医院呼吸与危重症医学科住院的支气管扩张症患者128例,有5例患者因为合并Ⅱ型呼吸衰竭、心力衰竭(心功能Ⅳ级),重度憋喘、大咯血等原因未完成支气管镜检查。有123例患者进行了支气管镜检查,在抗曲霉菌药物治疗前收集BALF。诊断参考《中国成人支气管扩张症诊断与专家共识》[6]和《中国侵袭性真菌感染》[7]诊断标准。①确诊:肺组织病理标本证实为曲霉菌,下呼吸道标本、无菌组织或血培养出曲霉菌;②临床诊断:患者有近3个月使用较大剂量糖皮质激素或广谱抗生素史,肺部CT出现斑片状浸润影、空洞、新月体征、多发结节、纤维化等影像学改变,痰培养出曲霉菌,血清GM试验或BALF-GM试验阳性;③非曲霉菌病:患者无曲霉菌感染的症状、体征,肺部CT检查不支持曲霉菌感染的影像学特征,病理组织检查未证实有曲霉菌。排除标准:①无支气管镜检查的禁忌证;②排除过敏性支气管肺曲霉菌病,排除烟曲霉皮肤试验阳性;③12周内均未使用抗曲霉菌药物。
根据上述标准将患者分为两组:①观察组41例,包括确诊或者临床诊断为支气管扩张症合并肺曲霉菌病患者。其中男21例(51.2%),女20例(48.8%),年龄45~75岁,中位年龄43.9(14.7)岁,其中12例患者经肺活检或纤维支气管镜检查证实为曲霉菌感染,29例患者经BALF培养或痰培养结果证实曲霉菌感染。②对照组(非肺曲霉菌病)82例,免疫学检查、微生物检查,或病理检查确定的未合并曲霉菌感染的支气管扩张症患者。其中男52例(63.4%),女30例(36.6%),年龄46~78岁,中位年龄47.8(16.5)岁。本研究已通过东营市胜利油田中心医院伦理委员会批准(16235),所有入选患者及家属均在自愿、知情的情况下签署协议参加该项研究。
1.2试剂和仪器 使用马铃薯琼脂平板培养基进行痰真菌培养或BALF真菌培养;血清GM测定采用酶联免疫夹心法, GM试剂盒(天津丹娜生物科技有限公司,试剂批号200403);TECAN酶标仪(上海贺德实验设备有限公司,型号:sunrise),隔水式电热恒温培养箱(上海贺德实验设备有限公司)。
1.3检验方法
1.3.1痰培养方法 所有患者在给予抗感染治疗前,清晨患者漱口后,嘱患者深咳,留取足量痰液置痰培养皿中。痰液中加入等量的NaOH-NaCl, 然后使用枸橼酸钠处理液处理,旋涡震荡,静置15 min后,使用磷酸盐缓冲液处理。将标本均匀接种于培养基上,置培育箱,35 ℃温箱培育48 h,取可疑菌落鉴定。
1.3.2酶联免疫夹心法 血清和BALF-GM检测采用酶联免疫夹心法,严格按照试剂盒说明书操作。酶标仪450 nm/620 nm双波长处读吸光度值。参考值区间范围:GM值<0.5 μg/L,提示检测结果阴性:GM值≥0.5μg/L,提示检测结果为阳性。
1.3.3BALF获取 依据胸部CT影像学结果,在未进行抗曲霉菌治疗前,选取病变累积最严重的部位右肺中叶或左肺舌叶,行支气管肺泡灌洗。用柔性支气管镜楔入所选的节段,将37 ℃的120 ml生理盐水按每60 ml两等份灌注。灌入支气管以及各个分支,灌入分支以后将液体进行回收,然后将注入的液体吸入一个连接在支气管镜吸引通道上的容器中。回收支气管肺泡灌洗液10 ml左右,送5 ml BALF进行GM检测。
1.3.4曲霉菌抗体IgG检测 采用酶联免疫方法检测。试剂盒购自天津丹娜生物科技有限公司。严格按照试剂盒说明进行实验操作。参考标准:①当检测数值<80 AU/ml时,判定为阴性结果;②当检测数值在80~120 AU/ml时,为观察范围区间;③当检测数值≥120 AU/ml时,判定为阳性结果。
1.4观察指标 比较两组年龄、性别、体重指数、住院时间、白细胞计数、血红蛋白、总蛋白、白蛋白等方面的基本特征;比较两组咳嗽、咯血、发热、呼吸困难等症状、肺部体征,并且根据mMRC问卷分级比较两组的评分情况及肺功能差异;比较两组曲霉菌特异性IgG抗体、痰真菌培养、BALF真菌培养、胸部CT影像等方面的差异。比较两组血清GM和BALF-GM敏感度和特异度、利用约登指数测定血清GM和BALF-GM的最佳截断值, 绘制血清GM和BALF-GM的受试者工作特征(ROC)曲线。
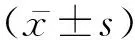
2 结 果
2.1两组临床特征比较 观察组反复咯血、发热的比例和症状持续时间均高于对照组(P<0.05)。观察组呼吸困难(根据mMRC问卷分级)mMRCⅡ、mMRCⅢ比例高于对照组(P<0.05)。观察组肺功能FEV1%pred(%)明显低于对照组(P<0.05),见表1。

表1 两组基本特征比较
2.2两组曲霉菌IgG抗体、痰培养、胸部CT结果比较 观察组曲霉菌IgG抗体高于对照组(P<0.05)。观察组4例(11.9%)痰培养中培养出曲霉菌,13例(32.1%)BALF中培养到曲霉菌,最常见的细菌是烟曲霉,明显高于对照组(P<0.05)。观察组空洞数量、新月体征、斑块状浸润影发生率均明显高于对照组(P<0.05),见表2。
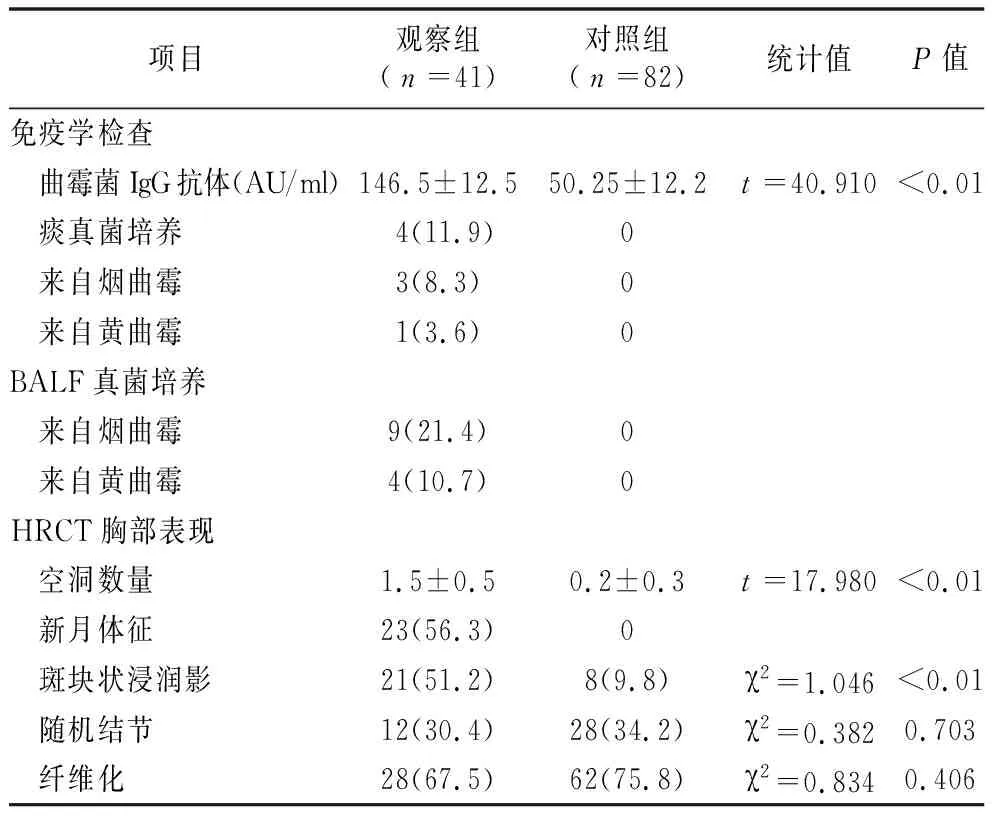
表2 两组免疫学、微生物学、影像结果比较
2.3血清GM和BALF-GM的最佳截断值 血清GM的最佳截断值为0.65 μg/L(敏感度65.4%;特异度88.5%)。当截断值为1.50 μg/L时,血清GM诊断支气管扩张症合并肺曲霉菌病的敏感度为11.5%,特异度为100%。 BALF-GM的最佳截断值为0.93 μg/L时,BALF-GM的敏感度为80.4%,特异性为95.0%。当截断值为2.0 μg/L时,BALF-GM的敏感度为19.2%,特异度为100%。在0.5、1和1.5的截断值下,血清 GM的敏感度11.5%~69.2%。对于BALF-GM,在使用0.5、1和1.5 μg/L的截断值时,敏感度50%~96.2%,见表3。
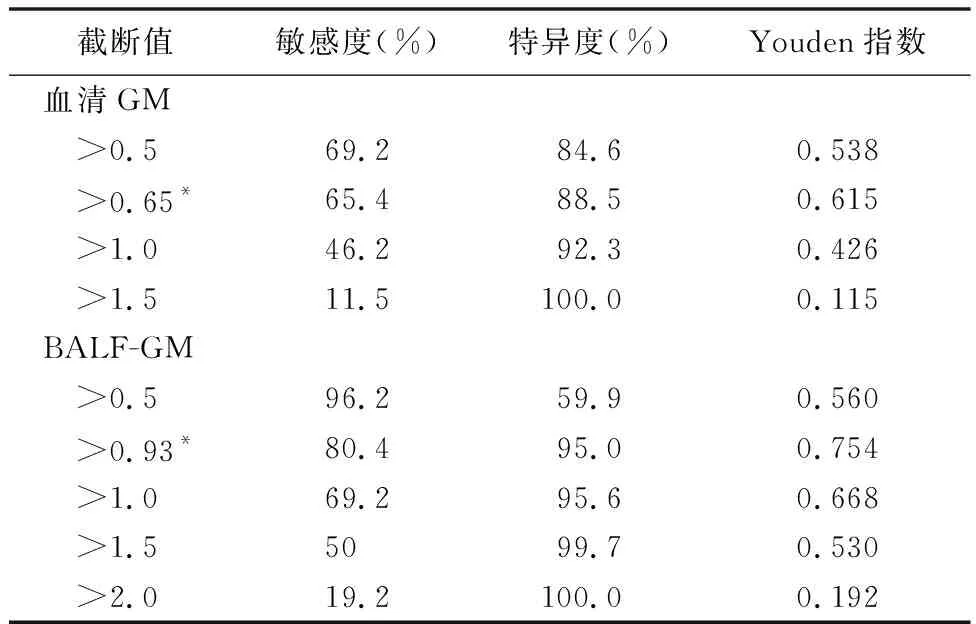
表3 不同截断值下血清GM和BALF-GM诊断支气管扩张症合并肺曲霉菌病的敏感度和特异度比较
2.4血清GM和BALF-GM的ROC曲线 血清GM的ROC曲线下面积为0.856,(标准误差[SE],0.062; 95%置信区间[CI],0.628~0.872)。约登指数测定血清GM的最佳截断值为0.65 μg/L (敏感度65.4%; 特异度88.5%)。血清GM截断值为1.50 μg/L时,敏感度11.5%,特异度100%。BALF-GM的ROC曲线下面积为0.929(SE 0.049; 95%置信区间[CI]0.757~0.950)。利用约登指数测定BALF-GM的最佳截断值为0.93 μg/L (敏感度80.4%; 特异度95.0%),见图1。
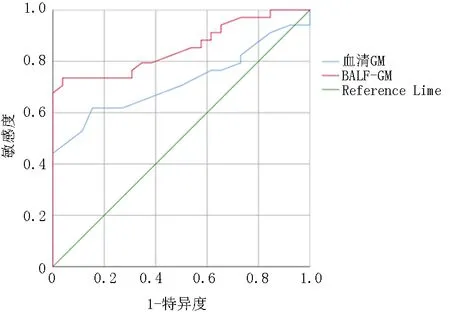
图1 血清GM和BALF-GM的ROC曲线
3 讨 论
支气管扩张症是一种慢性气道炎症性疾病。反复的呼吸道感染,导致炎症反复加重,患者出现呼吸困难,肺功能下降、呼吸衰竭而死亡。目前支气管扩张症患者出现急性加重越来越频繁,其中支气管扩张症合并肺曲霉病在支气管扩张急性加重中的比例越来越高[8]。支气管扩张症合并肺曲霉菌病,它的胸部影像学改变以斑块状浸润影为主,由于支气管扩张症患者常见咳嗽、咳痰、咯血、憋喘等症状,可掩盖合并肺曲霉菌病的症状,延误治疗,从而导致患者死亡率明显增加[9]。因此,提高支气管扩张症合并肺曲霉菌病的诊断准确性是很重要的[10]。痰培养或BALF培养曲霉菌受外界环境温度、湿度因素干扰、需要较长时间且阳性率低,因此对肺曲霉病的早期诊断价值有限。组织病理学检查对技术要求较高,有创伤性,且受标本合格率影响,限制其临床应用。
当人体肺组织受到曲霉菌感染时,在曲霉菌感染早期,患者血液GM水平增高。目前认为GM可以作为曲霉菌病的一种早期诊断的辅助检查手段[11-12]。有学者报道称GM试验的结果比影像学检查的结果早5~8 d[13],血清、BALF或脑脊液中的GM均可做为曲霉菌感染的生物标志物。
本研究结果提示BALF-GM诊断支气管扩张症合并肺曲霉菌病的敏感度和特异度均高于血清GM。血清GM的敏感度和特异度较差考虑与肺曲霉菌血液侵袭性较差有关。支气管扩张症合并肺曲霉菌病的诊断依据是综合临床症状,体征,实验室检查,胸部影像学结果判断。本文中观察组的痰真菌培养(11.9%)和BALF真菌培养(32.1%)敏感度较差,不能作为诊断支气管扩张症合并肺曲霉菌病患者的有效依据。在HRCT胸部影像检查中,支气管扩张症中空洞的存在提示感染肺曲霉菌[14]。本研究结果表明新月体征在支气管扩张症合并肺曲霉菌病中的发生率为56.3%,明显高于对照组0。观察组斑块状浸润影发生率51.2%,明显高于对照组9.8%,差异均有统计学意义(P<0.05)。胸部HRCT出现空洞、新月体征、斑块状浸润影可以提示支气管扩张症合并曲霉菌感染。观察组曲霉菌IgG抗体阳性明显高于对照组,差异有统计学意义(P<0.05)。胸部HRCT检查和曲霉菌IgG抗体检测有助于诊断支气管扩张症合并肺曲霉菌感染。
血清GM和BALF-GM有助于检测上述技术范围以外的患者。使用不同的截断值,血清GM诊断支气管扩张症合并肺曲霉菌病的敏感度和特异度分别为46.2%~69.2%和84.6%~92.3%。在本研究中,当截断值为0.65时,血清GM的敏感度为65.4%,特异度为88.5%。BALF-GM诊断支气管扩张症合并肺曲霉菌病的效果明显优于血清GM。使用不同的截断值,BALF-GM的敏感度和特异度分别为50.0%~96.2%和59.9%~99.7%。在一项回顾性研究中,Nguyen等[15]证明在BALF-GM截断值为1 μg/L时,敏感度和特异度分别为100%和88%。然而,该研究仅由6例患有侵袭性肺曲霉菌病(IPA)、亚急性侵袭性曲霉病(SAIA)和SA的受试者组成。本研究发现当截断值为2.0 μg/L时,BALF-GM的特异度为100%,敏感度为19.2%,这与之前的研究有相似之处。
另外,Zhou等[16]对GM的诊断性能进行meta分析,发现截断值为0.5、0.8和1.0 μg/L时,敏感度分别为0.75、0.69和0.68,特异度分别为0.89、0.94和0.96。当BALF截断值为0.93和1.0 μg/L时,特异度分别上升到95.0%和95.6%,与国内外报道接近[17-18]。本研究发现在12例确诊的肺曲霉菌病患者中,BALF-GM的截断值大于0.8 μg/L, 截断值大于1.0 μg/L的有10例,这可能与BALF中GM较高的敏感度和特异度有关。根据文献报道[19],血清GM检测的最佳截断值为0.5 μg/L。本研究提示利用约登指数计算的BALF-GM最佳截断值为0.93 μg/L,表明其敏感度和特异度较高,这可能与GM反应半乳糖肽抗原释放有关。中性粒细胞通过甘露糖结合受体清除血液中的GM,从而使血清GM的检出率降低。对于支气管扩张症合并肺曲霉菌病的诊断,除了血清GM、BALF-GM试验外,BALF中的病原体、微生物实验室检查,胸部影像学改变还有待进一步研究。
本研究也存在一定的局限性,例如在部分病例中未感染曲霉菌的患者中血清GM、BALF-GM有升高的现象,而在少数曲霉菌感染的患者中数值较低。可见血清GM、BALF-GM存在一定的假阳性和假阴性。分析其原因可能是患者使用了哌拉西林等半合成青霉素,而且血液透析用的纤维素膜、静脉免疫球蛋白、白蛋白、自身免疫性肝炎等指标均会影响检查结果。
综上可知,在支气管扩张症合并肺曲霉菌病的诊断中BALF-GM敏感度、特异度均优于血清GM,BALF-GM对于支气管扩张症合并肺曲霉菌病有更高的诊断价值。
——曲霉菌

