构造煤微观结构部分组成因素对CO2和CH4竞争吸附能力的影响分析
石 钰,杨晓娜,薛俊华,李树刚,阳 梦,刘 洋
(1.西安科技大学 安全科学与工程学院,陕西 西安 710054;2.西安科技大学 西部矿井开采及灾害防治教育部重点实验室,陕西 西安 710054)
煤层气又称“瓦斯”,是指赋存在煤层中以甲烷(CH4)为主要成分的非常规天然气。高效开发煤层气不仅能够遏制煤矿瓦斯事故的发生,降低甲烷排放造成的温室效应,而且对于优化我国能源结构、缓解天然气供给压力具有重要战略意义。80%~90%的煤层气以吸附态赋存于煤层及其围岩中[1]。储层开采打破了地下岩体应力平衡,导致吸附气解吸,向游离气转化。吸附气对煤层气资源潜力及游离气气源补充都具有较大贡献,明晰煤岩孔隙结构中煤层气的吸附机理对于高效开发煤层气资源具有重要意义。
气体吸附特性一直是多孔介质传热传质研究的重点[2]。目前,国内外学者针对煤中气体吸附机理开展了诸多研究。胡彪[3]、简阔[4]、张玉贵[5]等研究发现,单组分气体CH4、N2在构造煤中的吸附行为明显强于在原生结构煤中的;PAN等[6]通过单组分气体CH4等温吸附试验,发现低温条件下构造煤的变形程度对甲烷吸附能力影响显著;张庆贺等[7]开展了构造煤的损伤效应试验,得出气体吸附能力与煤体损伤程度成正比。基于压汞法、低温N2吸附法和CO2吸附法,李阳等[8]对构造煤的孔隙特征进行分析,发现构造煤中微孔演化主要受煤中芳香层片大小和排列方式的影响;KIM[9]、林海飞[10]等从热力学角度分析了单组分CO2、CH4的吸附特性,发现CO2吸附势能大于CH4;LIU等[11]基于密度泛函理论,研究了CH4与石墨晶胞表面的相互作用,发现对石墨表面进行掺杂会影响CH4吸附;降文萍等[12]使用量子化学从头计算方法,计算了单组分CO2、CH4与煤表面的吸附势阱,发现CO2在煤表面的吸附更稳定;HU[13]、周来[14]、周军平[15]等通过分子模拟研究了CO2和CH4在某一固定煤分子中的竞争吸附,发现CO2较CH4优先吸附。针对煤的微观结构,王宝俊等[16-17]采用蒙特卡洛和分子动力学方法探讨了构造煤的分子结构对单组分CH4吸附的影响;潘保龙[17]通过实验和分子模拟研究了煤的微观结构对软硬煤吸附单组分CH4的影响。
综上所述,现有关于构造煤中气体吸附的研究多限于实验方法。分子模拟方法作为实验方法的补充,在揭示纳米尺度下气—固相互作用方面具有独特的优势。虽然有学者[16]通过分子模拟获得了构造煤中单组分CH4的吸附规律,但是对于复杂微观结构构造煤对多组分气体CO2和CH4竞争吸附影响的研究鲜见报道(煤的微观结构包括分子结构和孔隙结构[18])。地质构造作用会引起煤体变质,导致煤体微观结构发生改变,主要表现为芳香单元延展度(La)、芳香单元堆砌层数(N)、狭缝孔径(d)、表面缺陷(V)及含氧官能团类型(M)产生变化。
笔者拟构建多种构造煤分子的狭缝孔模型,基于巨正则蒙特卡洛(GCMC)、分子动力学(MD)方法和密度泛函理论(DFT),详细探究La、N、d、V及M对多组分气体吸附量、平均等量吸附热、吸附选择性和径向分布函数的影响规律,分析CO2和CH4在煤表面吸附前后电子态密度(DOS)的变化规律。期望从微观角度揭示CO2和CH4在不同构造煤结构中的竞争吸附机理,为合理评价吸附气含量、高效开发煤层气资源提供理论依据。
1 模型构建与参数设置
1.1 模型构建
研究表明,煤是具有芳香环的层状结构[19],由大小不等的芳香微晶石墨片或芳核组成[20]。构造煤在形成过程中受化学作用影响,石墨化程度较高[21]。与同一时期的原生结构煤相比,构造煤具有超前演化的特征,致使煤中含氧官能团(羧基、羟基和羰基等)的形式发生变化[22]。基于姜波[23]、JU[24]和LI[25]等实验得到的煤微晶结构参数,笔者构建了一系列构造煤分子模型。模型命名方式为N-La-d(芳香单元堆砌层数-芳香单元延展度-狭缝孔径)、N-La-V/M-d(芳香单元堆砌层数-芳香单元延展度-表现缺陷/含氧官能团-狭缝孔径),如3-5×5-10表示芳香单元堆砌层数为3、芳香单元延展度为5×5、狭缝孔径为1 nm。部分构造煤分子模型如图1所示,模型的微晶结构参数见表1。

(a)3-8×8-V1-10 (b)3-8×8-V2-10
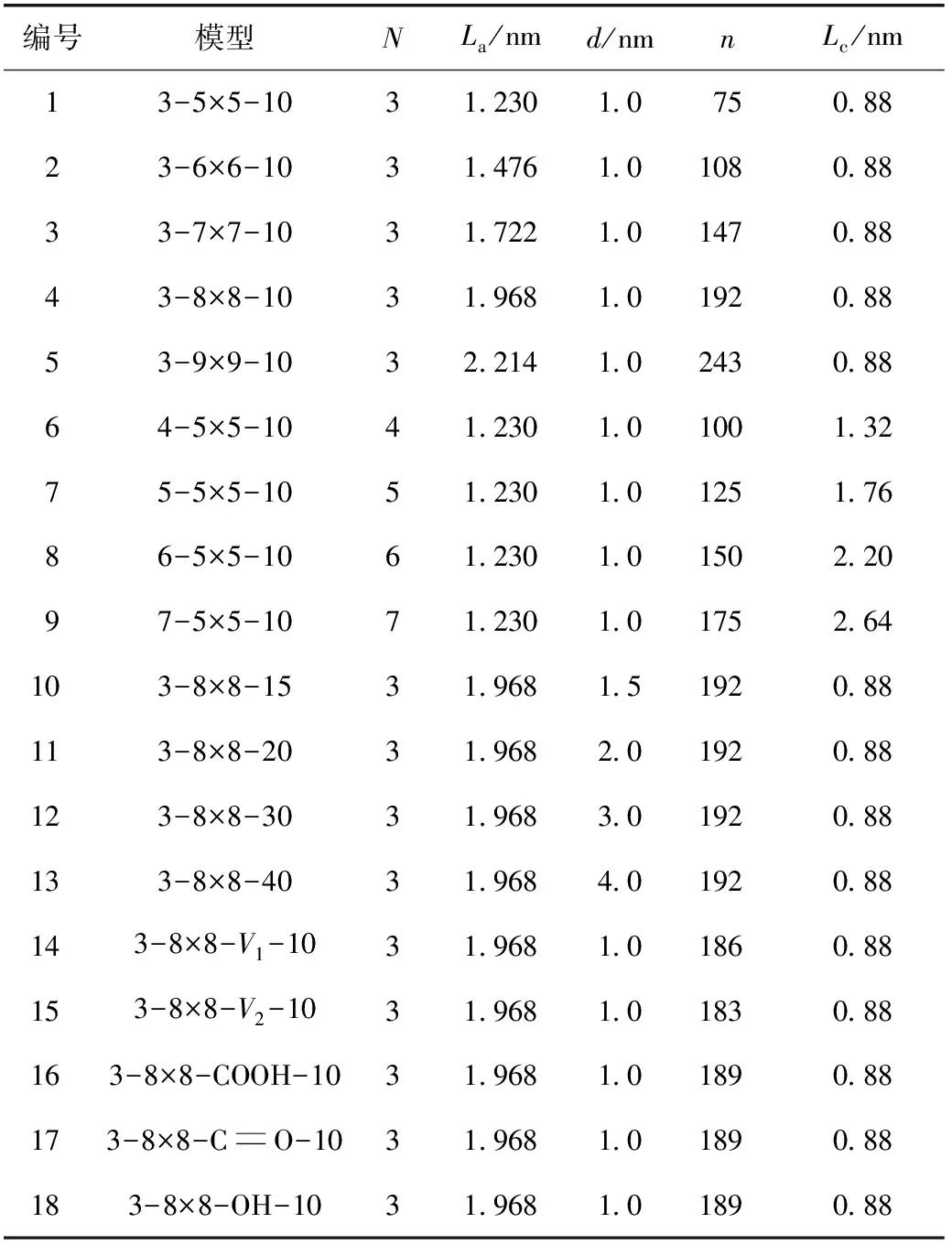
表1 构造煤分子模型的微晶结构参数
表1中显示了不同La变量的模型5个,N变量的模型5个,d变量的模型5个,V变量的模型2个(V1表示单缺陷,V2表示次生缺陷),M变量的模型3个(COOH表示羧基,CO表示羰基,OH表示羟基)。构造煤分子模型共5+5+5-2+2+3=18个。
1.2 计算方法
整个模型计算通过分子动力学软件Materials Studio(MS)进行:
1)使用Forcite模块下的Geometry Optimization任务,对CO2和CH4分子及上述18个构造煤分子模型进行优化,使其体系能量最小化。
2)使用Sorption模块下的Fix Pressure任务模拟每个构造煤分子模型对CO2和CH4的竞争吸附,得到CO2和CH4的饱和吸附量。模拟过程中,选用COMPASS力场,精度级别为Ultra-fine,方法为Metropolis,分子间范德华力作用和静电力作用分别采用Atom Based和Ewald求和处理,平衡步数和生产步数分别为1×106和1×107。
通过Locate任务获取稳定的饱和吸附构型,再选用Dynamics任务下的NVT系综和Nose控温方法对上述构型进行动力学计算。计算过程中,模拟步数和模拟时间分别为1×106和1 000 ps,时间步长为1.0 fs,每1 000步进行一次数据采集,方便后续分析。
3)使用Dmol3模块下的Energy任务分析CO2和CH4在煤表面吸附前后的电子态密度,交换相关泛函采用局域密度近似(LDA)的PWC方法。
2 模型验证
2.1 亨利常数与吸附热
亨利常数定义为当压力趋于0时,吸附量与吸附质分压的比值[26],即:
(1)
式中:K为亨利常数;q为吸附量,N·u.c.-1(N·u.c.-1表示一个晶胞里吸附的分子个数);p代表吸附质分压,MPa。
吸附热Qst由van’t Hoff方程式求得[27]:
(2)
式中:R为气体常数,其值为8.314 J/(mol·K);T为温度,K。
对公式(2)进行积分,可得:
(3)
式中C为一个常数。
2.2 气体在构造煤中的吸附热
采用Sorption模块中的Henry Constant任务,计算温度298~338 K条件下,3种构造煤3-8×8-10、3-8×8-15、3-8×8-V1-10对CH4吸附的亨利常数,结果如图2所示。对lnK与1/T进行线性拟合得到CH4在构造煤中的吸附热(直线斜率乘以R),分别为13.531 9、13.390 9、13.419 7 kJ/mol,这与卢守青等[28]实验测得构造煤中CH4的吸附热较为吻合。

图2 298~338 K时构造煤对CH4吸附的亨利常数
3 结果与讨论
3.1 逸度与自由体积
3.1.1 逸度
由于MS软件使用逸度来表示压力,为了获取逸度,采用Aspen Plus软件计算不同温度和压力下气体的逸度系数,再进一步通过公式(4)推导其逸度[29]:
fi=φipi
(4)
式中:i代表不同组分气体序号;fi为逸度,MPa;φi为逸度系数;pi为压力,MPa。
在温度298 K、压力10 MPa条件下,CO2和CH4的逸度系数与逸度计算结果见表2。

表2 CO2和CH4的逸度系数与逸度
3.1.2 自由体积
使用MS软件的Connolly Surface任务,计算不同芳香单元延展度、芳香单元堆砌层数、狭缝孔径、表面缺陷及含氧官能团下构造煤分子模型的自由体积。
选用吸附性能较弱的He原子[30]作为探针分子(He的分子动力学直径为0.26 nm),得到构造煤分子模型的自由体积见表3。由表3可以看出:模型自由体积随芳香单元延展度及狭缝孔径的增加而显著增大(如从3-5×5-10到3-7×7-10,自由体积增加1.295 83 nm3);表面缺陷、含氧官能团的存在,以及增加芳香单元堆砌层数对构造煤分子模型的自由体积影响较小(如从3-5×5-10到4-5×5-10,自由体积仅增加0.001 54 nm3)。

表3 构造煤分子模型的自由体积
3.2 芳香单元延展度对CO2和CH4竞争吸附的影响
研究了温度为298 K、压力为10 MPa条件下,CO2和CH4在不同芳香单元延展度构造煤分子中的竞争吸附规律。
图3展示了CO2和CH4的吸附量与芳香单元延展度La的关系:气体吸附量与La成正比。这是因为增加La,会使构造煤分子模型自由体积增大(见表3),煤表面所提供的气体吸附点位增多,导致CO2吸附量从18.994 N·u.c.-1增加到80.384 N·u.c.-1,CH4吸附量从1.971 N·u.c.-1增加到9.061 N·u.c.-1,分别增加了3.23倍和3.60倍。
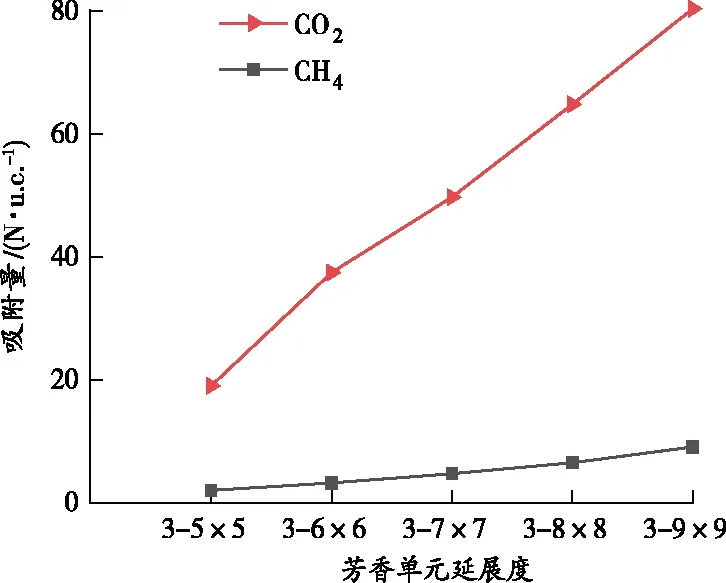
图3 CO2和CH4的吸附量与芳香单元延展度的关系
由图3对比发现,CO2吸附量始终高于CH4吸附量,表明在CO2和CH4竞争吸附过程中,CO2较CH4优先吸附。这主要归因于:①气体吸附能力与吸附质分子量成正比,CO2分子量大于CH4分子量,使CO2吸附量始终高于CH4吸附量;②气体吸附数量与吸附质分子的动力学直径成反比,相比CH4,CO2的分子动力学直径较小(CH4为0.38 nm,CO2为0.33 nm);③静电作用对具有四极矩和极化率的分子影响显著[31],而CO2具有较强的四极矩和极化率,因此静电作用提高了CO2的吸附能力。
3-5×5-10和3-9×9-10两种芳香单元延展度下,CO2和CH4竞争吸附的吸附构型如图4所示,明显看出,La由5增加到9时,红色和绿色区域面积均增大,CO2和CH4的吸附点位增多,吸附量增加。
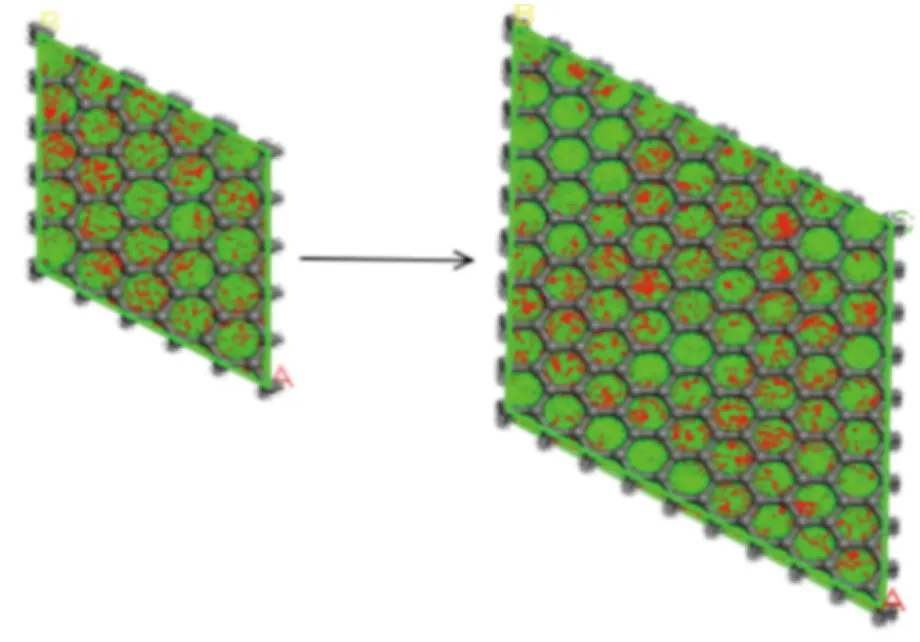
(a)3-5×5-10 (b)3-9×9-10
3.3 芳香单元堆砌层数对CO2和CH4竞争吸附的影响
在温度为298 K、压力为10 MPa条件下,芳香单元堆砌层数为4和7时,CO2和CH4竞争吸附的吸附构型如图5所示,可以看出随着堆砌层数增加,CO2和CH4的吸附量并无明显变化。
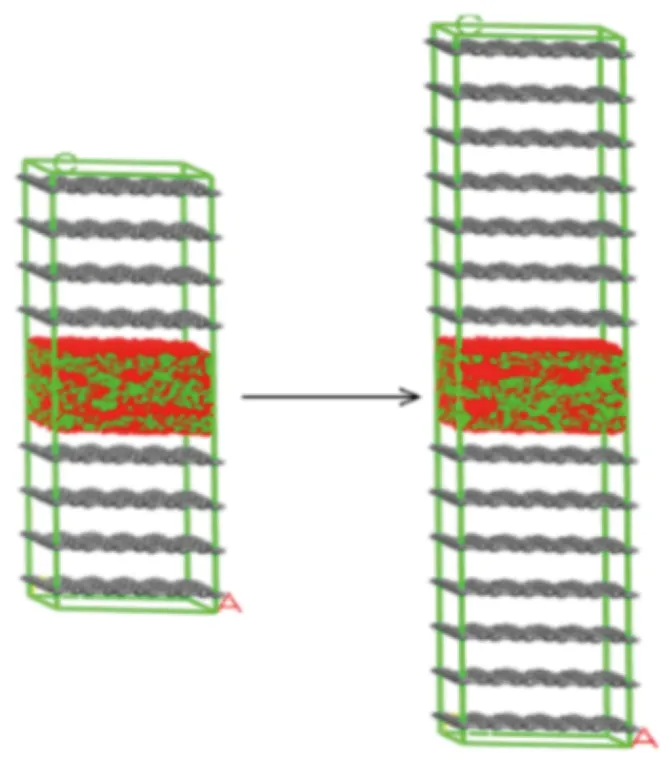
(a)4-5×5-10 (b)7-5×5-10
CO2和CH4吸附量与芳香单元堆砌层数N的关系如图6所示,可以看出:随着N增加,气体吸附量略有减少,CO2吸附量从18.994 N·u.c.-1降低到18.772 N·u.c.-1,CH4吸附量从1.971 N·u.c.-1降低到1.699 N·u.c.-1,分别降低了1.17%和13.80%。分析原因:范德华力作为煤吸附甲烷的主要作用力,其范围为0.3~0.5 nm,而堆砌层数间距小于0.5 nm,导致层数增加未能引起孔壁吸附力增强,这与潘保龙[17]对软硬煤中单组分CH4吸附的研究结论一致。
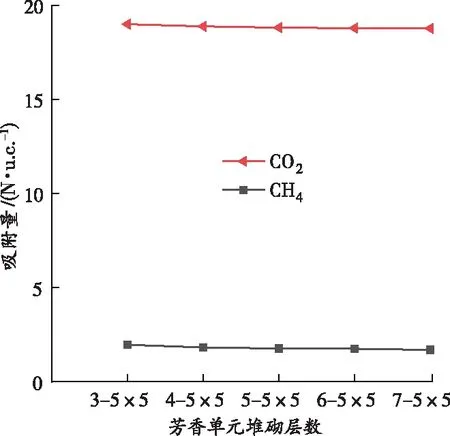
图6 CO2和CH4的吸附量与芳香单元堆砌层数的关系
不同芳香单元延展度和芳香单元堆砌层数下,CO2和CH4竞争吸附过程中平均等量吸附热计算结果见表4。

表4 不同芳香单元延展度和芳香单元堆砌层数下CO2和CH4的平均等量吸附热
由表4可知,随着芳香单元延展度增加,2种气体平均等量吸附热均增加,对比模型3-5×5-10和3-9×9-10,CO2从29.820 kJ/mol增加到32.714 kJ/mol,CH4从18.908 kJ/mol增加到19.711 kJ/mol,分别增加了9.70%和4.25%,并且CO2的平均等量吸附热始终大于CH4的。然而,随着芳香单元堆砌层数增加,煤分子吸附CO2和CH4的个数反而减少,导致CO2和CH4的平均等量吸附热有所降低。比较模型3-5×5-10和7-5×5-10的平均等量吸附热,CO2从29.820 kJ/mol降低到26.825 kJ/mol,CH4从18.908 kJ/mol降低到16.741 kJ/mol,分别降低了10.04%和11.46%。
3.4 表面缺陷对CO2和CH4竞争吸附的影响
当温度为298 K、压力为10 MPa时,不同表面缺陷煤分子中CO2和CH4竞争吸附的饱和吸附构象、吸附量和平均等量吸附热分别见图7和表5。

(a)3-8×8-V1-10 (b)3-8×8-V2-10

表5 不同表面缺陷下CO2和CH4的吸附量和平均等量吸附热
由图7、表5可知,表面缺陷导致CO2和CH4的吸附量及平均等量吸附热降低。比较不同表面缺陷下气体吸附量和平均等量吸附热情况为:无表面缺陷的煤分子大于存在次生缺陷的煤分子,存在次生缺陷的煤分子大于存在单缺陷的煤分子,即大小依次为3-8×8-10、3-8×8-V2-10、3-8×8-V1-10。这是因为,表面缺陷的存在减少了CO2和CH4在孔壁上的吸附点位,致使晶胞中CO2和CH4的吸附量降低,平均等量吸附热降低。缺失1个碳原子(单缺陷)时,煤表面CO2和CH4的吸附点位减少,而下层的碳环却不能为其提供吸附点位;当缺失2个碳原子时(次生缺陷),尽管“缺口”增多,但是下层的碳环可为煤表面提供吸附位,因此存在次生缺陷的煤表面气体吸附量反而高于单缺陷煤表面气体吸附量。
3.5 狭缝孔径对CO2和CH4竞争吸附的影响
CO2和CH4在不同狭缝孔中竞争吸附的吸附等温线如图8所示。
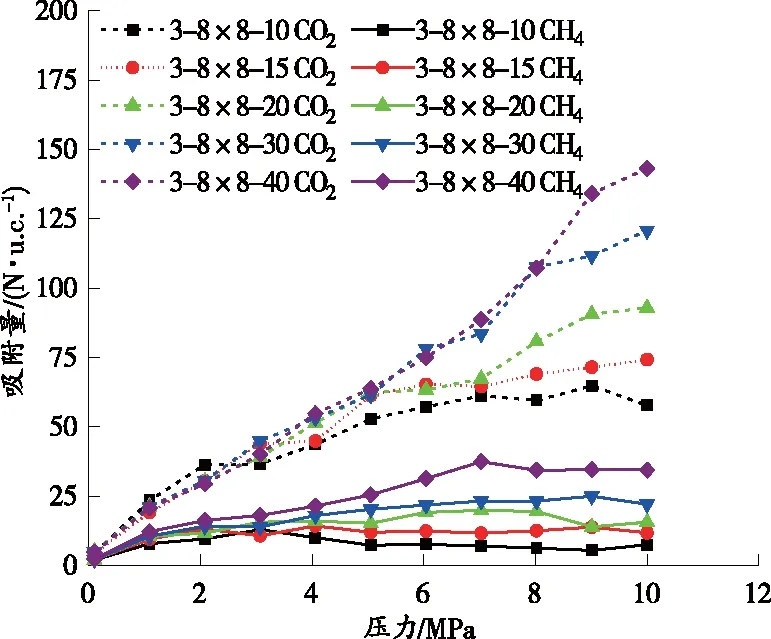
图8 CO2和CH4在不同狭缝孔径中竞争吸附的吸附等温线
由图8可知,随着狭缝孔径增大,构造煤中CO2和CH4吸附量均增大,这是因为构造煤分子模型的自由体积随狭缝孔径增大而增大,致使煤中CO2和CH4的吸附点位增多。
从吸附构型上看,当狭缝孔径从1 nm增加到4 nm时,红色和绿色区域面积均增大,CO2和CH4吸附量增加,如图9所示。
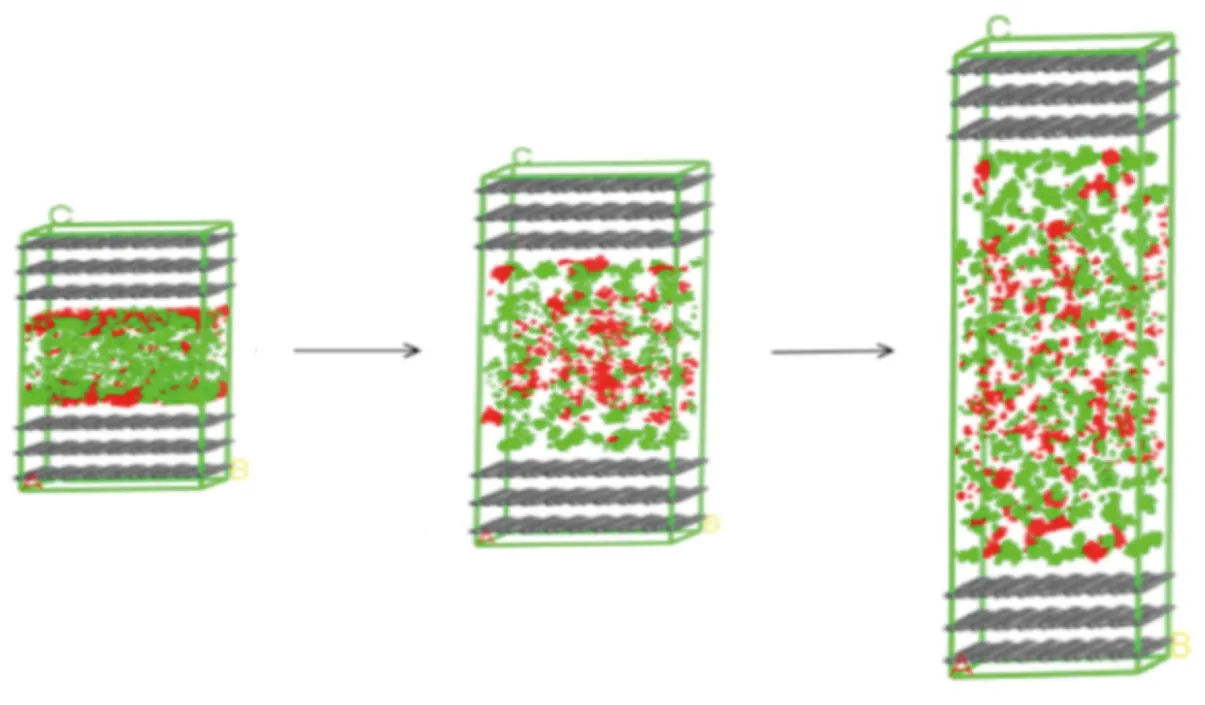
(a)3-8×8-10 (b)3-8×8-20 (c)3-8×8-40
选择性系数S通常被用来表征多组分吸附体系中吸附质分子吸附性强弱。CO2和CH4在狭缝孔中竞争吸附的吸附选择性系数表示为[32]:
(5)
式中:xCO2和xCH4分别为CO2和CH4在吸附气体中所占的摩尔分数;yCO2和yCH4分别为CO2和CH4的吸附比例。
当SCO2/CH4>1时,说明狭缝孔对CO2的吸附能力强于CH4。
CO2和CH4在不同狭缝孔径中竞争吸附的选择性系数如图10所示。由图10可以发现,选择性系数始终大于1,说明CO2在与CH4竞争吸附过程中始终占据优势地位。另外,选择性系数与狭缝孔径大小成反比,狭缝孔径为1 nm的选择性系数远高于孔径为1.5、2、3、4 nm时的选择性系数,说明孔径越小,CO2竞争吸附优势越显著。
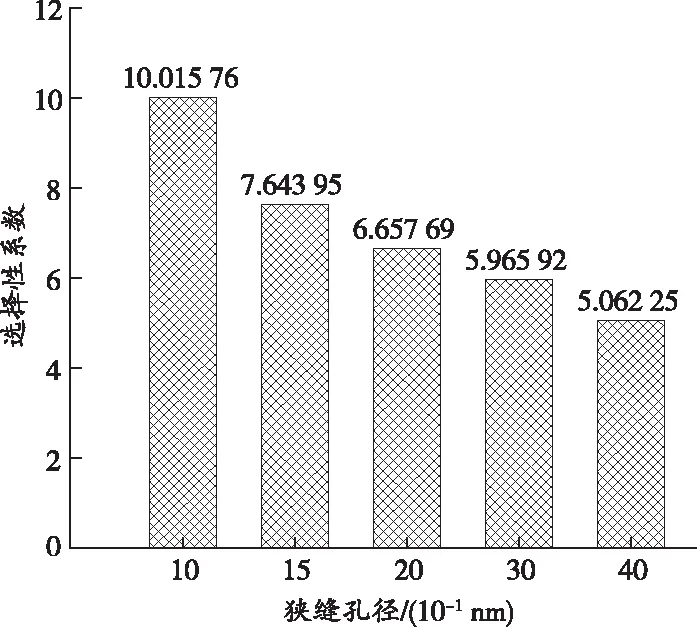
图10 CO2和CH4在不同狭缝孔径中竞争吸附的选择性系数
3.6 表面含氧官能团对CO2和CH4竞争吸附的影响
CO2和CH4在表面含氧官能团煤分子中竞争吸附的饱和吸附构象如图11所示,表面含氧官能团对混合气体的吸附量和平均等量吸附热影响结果见表6。
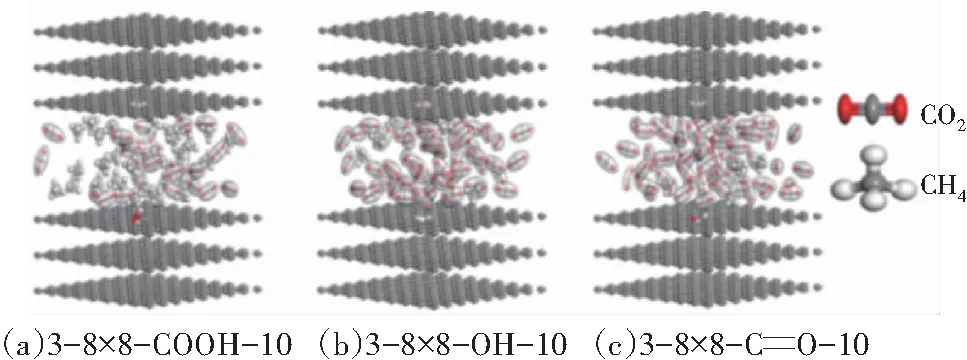
图11 CO2和CH4在表面含氧官能团煤中竞争吸附的饱和吸附构象

表6 不同表面含氧官能团下CO2和CH4的吸附量及平均等量吸附热
通过与表5中无官能团(3-8×8-10)的吸附量和平均等量吸附热比较发现,表面含氧官能团降低了煤的吸附能力,CO2和CH4的吸附量及平均等量吸附热均明显降低。这是因为含氧官能团占据了煤表面吸附点位,但官能团自身物理化学性质不利于CO2和CH4吸附。另外,含氧官能团的碱度越大,CO2吸附越强,CO2在3种表面含氧官能团上的吸附能力大小关系为CO>OH>COOH;含氧官能团的疏水性越强,CH4吸附越强,CH4在3种表面含氧官能团上的吸附能力大小关系则为CO>COOH>OH。羟基和羧基官能团氧含量较高,不利于CO2和CH4的吸附。
通过径向分布函数(RDF)进一步阐明表面含氧官能团对CO2和CH4竞争吸附的影响。RDF为表征粒子微观结构的物理量,能够反映粒子聚集特性,定义为系统局部密度与平均体密度的比值[33],计算公式如下:
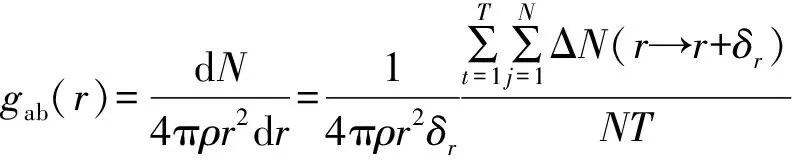
(6)
式中:gab(r)表示粒子的聚集程度;r为含氧官能团上氧原子a之间的距离,nm;N为分子的总数目;ρ为b的密度,粒子数/nm3;t为步序;j为分子序数;ΔN为分布在含氧官能团氧原子a周围r→r+δr范围内的b(CH4和CO2)粒子数;δr为设定的距离差,nm;T为计算的总时间(步数)。
CO2和CH4与不同表面含氧官能团的径向分布函数如图12所示。可以看出,CO2与含氧官能团分别在0.331 nm(CO)、0.387 nm(OH)和0.427 nm(COOH)时出现峰值,峰值大小关系为2.53(CO)>1.86(OH)>1.25(COOH);而CH4与含氧官能团分别在0.444 nm(CO)、0.752 nm(COOH)和0.797 nm(OH)时出现峰值,峰值大小关系为1.50(CO)>1.46(COOH)>1.37(OH)。峰值越高表示CO2、CH4与含氧官能团之间的相互作用越强烈,原子之间联系越紧密。相比CH4,CO2与含氧官能团之间的相互作用更强,即在竞争吸附中处于优势地位。
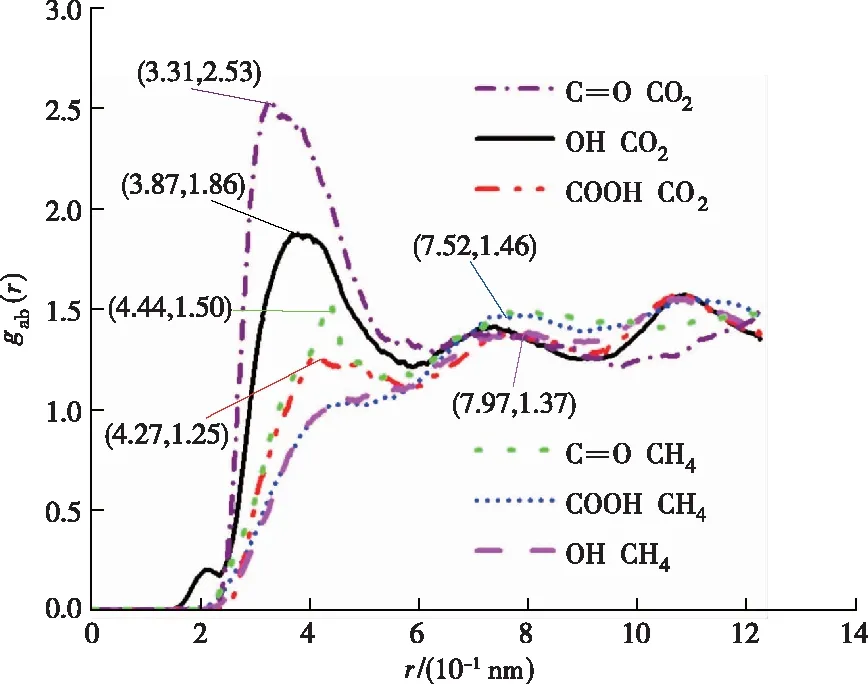
图12 CO2和CH4与不同表面含氧官能团的径向分布函数
3.7 CO2和CH4在煤表面吸附前后电子态密度(DOS)变化规律
为进一步揭示CO2和CH4竞争吸附规律,对煤表面吸附CO2和CH4前后电子态密度(DOS)变化进行分析,以芳香单元延展度8×8的煤表面为例。煤表面吸附CO2和CH4前后,DOS的分布情况如图13所示。
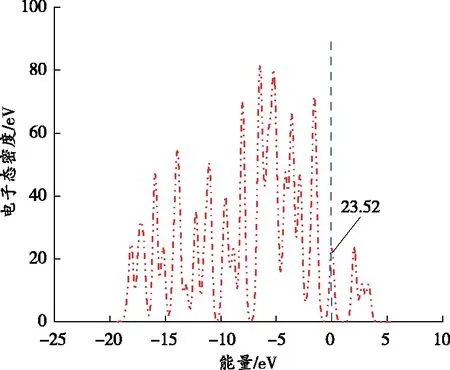
(a)无CO2和CH4吸附
由图13(a)可知,煤表面单独存在时,DOS跨过费米能级(蓝色虚线位置),在费米能级前后有很多尖峰,表明煤表面的共价键性能较强,尖峰处容易吸附气体。由图13(b)和13(c)可以看出,当CO2和CH4吸附于煤表面后,费米能级处的电子态密度峰值分别为23.62、23.58 eV,说明煤表面对CO2的吸附能力较强,在与CH4竞争吸附过程中,CO2处于优势地位。
4 结论
探究了构造煤微观结构对CO2和CH4竞争吸附的影响规律,获得的主要结论如下:
1)CO2和CH4的吸附量及平均等量吸附热随煤的芳香单元延展度增加显著增大;增加煤的芳香单元堆砌层数,CO2和CH4的吸附量有所减小且平均等量吸附热降低。
2)煤表面缺陷导致气体吸附量及平均等量吸附热减小,存在次生缺陷的煤分子中CO2和CH4的吸附量及平均等量吸附热大于存在单缺陷时煤分子中的情况。
3)随着狭缝孔径增大,煤中CO2和CH4吸附量均增大。与CH4相比,CO2吸附始终占优,且狭缝孔径越小,CO2竞争吸附优势越显著。
4)与CH4相比,CO2与煤表面含氧官能团的吸附能力较强,羰基(CO)最有利于CO2和CH4吸附,而羟基(OH)和羧基(COOH)含氧量较高,不利于CO2和CH4吸附。
5)煤表面吸附CO2和CH4后,费米能级处CO2的电子态密度峰值大于CH4的电子态密度峰值,说明CO2在与CH4竞争吸附过程中,处于优势地位。

