谷子茎尖诱导愈伤的品种筛选及分化条件探究
祁东梅,史慎奎,王玉芳,王春芳
(河北民族师范学院生物与食品科学学院,河北 承德 067000)
谷子(Setaria italica(L.)P.Beauv.)属禾本科植物,一年生草本,原产于中国,在我国北方地区广泛种植,具有抗旱、耐瘠、抗逆性强、适应性广等特点,是干旱半干旱地区的重要粮食作物之一,具有较好的种植前景[1]。但是谷子作为小作物其研究力量相对薄弱,优质品种的培育和种业发展方面的新技术研发和平台构建缺乏[2]。随着世界人口的增长,对粮食的需求量也越来越大,作物的改良显得尤为重要,而建立一套高效稳定的谷子组织培养再生体系,是谷子遗传转化和改良的重要前提。广义的植物组织培养是在无菌条件下将部分组织接种到培养基中,在合适的条件下将组织再生为完整植株的过程[3]。在该过程中,愈伤的培养是组织培养顺利进行的基础,愈伤的再生体系建立是现代生物技术在谷子上展开应用的前提和关键,影响优质高效品种培育、抗逆性品种的选育和种业发展。此外,提高谷子的遗传转化效率,构建谷子现代育种技术体系,提升作物育种水平,也是目前谷子产业发展的重要任务[2]。
谷子的组织培养方面已经开展了大量工作。许智宏等较早研究谷子的组织培养,利用谷子幼穗作为外植体获得了再生植株[4];赵连元、董云洲和刁现民等在谷子原生质体和体细胞无性系的组织培养中均获得成功[5-7]。近年来,许多学者利用胚、幼穗、侧芽等外植体均成功培养出了愈伤组织及再生植株[8,9],包括陈倩楠等利用谷子幼穗进行胚性愈伤组织的诱导[10],李颜方等利用成熟胚对谷子的再生和转化体系进行优化[11],贺榆婷等利用成熟胚筛选出高效再生的谷子基因型[12],尹艺臻等利用种子建立愈伤组织的再生体系[13]等。目前在谷子的组织培养中,选用的材料以胚胎和花药居多[14],但花药取材受季节和种植时间的限制,而利用茎尖作为外植体的研究较少。茎尖由种子萌发获得,研究材料不受季节、环境和生长阶段的限制,更加方便易得。王寒玉等[15]和杨澜等[16]都利用茎尖对转化体系进行探究,但两者对分化体系中激素使用条件的探究较少。
本研究利用试验田中种植的31 个品种,从中筛选出农艺性状较优良且更适宜在承德本地播种的品种作为实验材料,取其茎尖为外植体进行组织培养,筛选出芽率高、愈伤组织诱导率高、染菌率低的谷子品种。后续选定师院-1 作为实验材料,探究不同激素对谷子愈伤组织诱导和分化的影响,优化茎尖再生体系的条件,为谷子茎尖组织培养和遗传转化研究提供参考。
1 材料与方法
1.1 植物材料
本研究中所用的谷子品种共31 个,由河北民族师范学院杂粮产业协同创新中心提供,品种名称见表1。
1.2 实验方法
1.2.1 种子消毒及外植体的获得
种子消毒过程在超净工作台中进行。取适量的种子于小烧杯中,75%乙醇洗3~5 次,再用0.1%升汞浸泡5 min,消毒过程中不断摇晃使其更彻底,然后用无菌水清洗5~10 次,洗去残留升汞。用灭菌的镊子将消毒后的种子接种在培养基上。每个培养皿接种50~70 粒种子,25 ℃光照恒温培养箱中暗培养2~3 d,待茎尖长到1.5 cm 左右将其切下接种到愈伤诱导培养基上。
1.2.2 愈伤的诱导和分化
将长好的茎尖用镊子和小刀在滤纸上切下后放入50 mL 小烧杯中,75%的乙醇浸泡两次,每次30 s,再用2%的次氯酸钠浸泡15 min,最后用无菌水清洗3 次后接种于含不同激素的愈伤组织诱导培养基中。培养基主要成分如下:
①在培养基MS+10 g/L 琼脂+30 g/L 蔗糖中,添加不同浓度的2,4-D(0.4、0.8、1.0、1.2 mg/L),探究不同浓度的2,4-D 对愈伤组织诱导的影响。
②在培养基MS+10 g/L 琼脂+30 g/L 蔗糖+1.0 mg/L 2,4-D 中,添加不同浓度的KT(0.05、0.1、0.2、0.4、0.8 mg/L),探究不同浓度的KT 对愈伤组织诱导的影响。
③在培养基MS+10 g/L 琼脂+30 g/L 蔗糖+1.0 mg/L 2,4-D 中,添加不同浓度的ZT(0.8、1.0、1.2 mg/L),探究不同浓度的ZT 对愈伤组织诱导的影响。
将诱导出的胚性愈伤组织(颜色淡黄,硬颗粒状,质地紧密)在无菌条件下分别接种到不同种激素及不同浓度的分化培养基上,各培养基主要成分如下:
④在培养基MS+10 g/L 琼脂+30 g/L 蔗糖+1.0 mg/L 2,4-D 中添加不同浓度的TDZ(0.5、1.0、1.5、2.0 mg/L)的分化培养基上,观察统计愈伤分化效果。
⑤在培养基MS+10 g/L 琼脂+30 g/L 蔗糖+2.0 mg/L 6-BA 中添加不同浓度的NAA(0.2、0.4、0.6、0.8 mg/L)的分化培养基上,观察统计愈伤分化效果。
1.3 数据分析
发芽率(%)=发芽的种子数目/接种的种子总数×100
愈伤组织诱导率(%)=形成的愈伤数/接种的茎尖总数×100
愈伤组织染菌率(%)=染菌愈伤数/接种的茎尖总数×100
愈伤分化率(%)=分化出苗数/接种的愈伤总数×100
2 结果分析
2.1 不同品种谷子的发芽率、愈伤组织诱导率和染菌率比较
为筛选出发芽率较高的品种,本研究首先将31个品种谷子的种子无菌消毒后接种到MS 培养基上,培养2~3 d,待茎尖长至1 cm 左右,统计种子的发芽率。通过萌发实验,发现发芽率超过50%的有19 个品种(表1),其中鲁2115、鲁2181、鲁7034、大悲无名谷、龙山红谷、朝鲜小黄谷、9115、8 月-62、黑粘谷、红粒谷、2 月-20、师院-1、跑死马、4 月64 这14 个品种的发芽率均在70%以上。
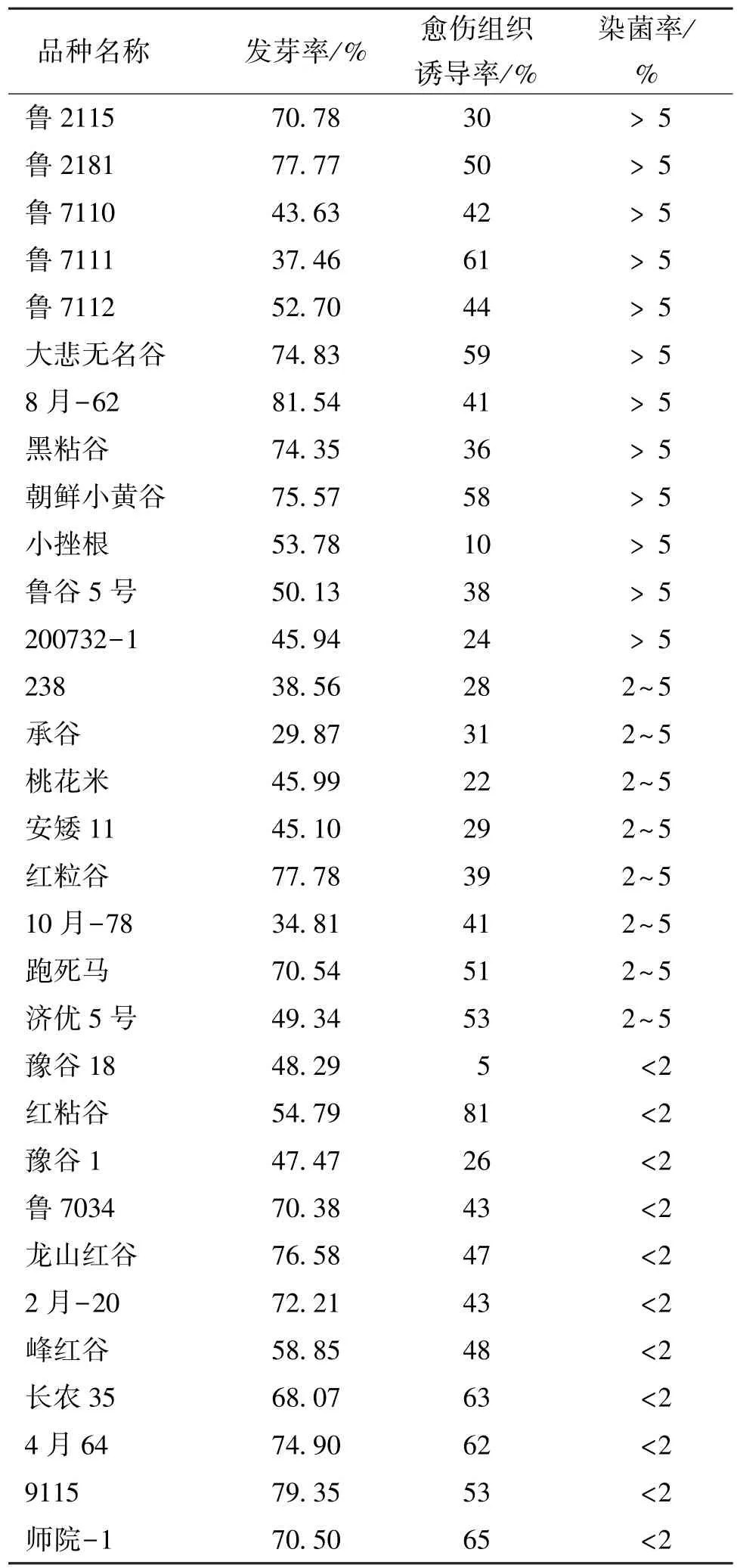
表1 31 个谷子品种的发芽率、愈伤组织诱导率、染菌率Table 1 Statistics of germination rate,callus induction rate and bacterial infection rate of 31 varieties of millet
然后,将不同品种的谷子茎尖接种在MS 诱导培养基中,其中2,4-D 浓度为0.6 mg/L,培养25 d,观察愈伤组织的状态并统计愈伤诱导率。结果显示,31 个谷子品种中,红粘谷、鲁2181、鲁7111、大悲无名谷、济优5 号、朝鲜小黄谷、9115、师院-1、跑死马、长农35、4 月64 这11 个品种的愈伤组织诱导率较高,均超过50%,其中红粘谷的愈伤组织诱导率最高,可达81%;师院-1 愈伤组织诱导率为65%。而豫谷18 和小挫根的愈伤组织诱导率较低,不足20%,其余品种的愈伤组织诱导率处于20%~50%范围内。
在愈伤诱导的同时还统计了各品种的染菌率,31 个品种中有12 个品种的染菌率较高,染菌率在5%以上,其中鲁2115 的愈伤组织染菌率最高,可达21.5%;有11 个品种的染菌率较低,在0~2%之间,豫谷1 的染菌率最低,为0;还有8 个品种的染菌率在2%~5%之间。
通过对比分析,不同品种的谷子在进行组织培养过程中,其种子的发芽率、愈伤组织诱导率和染菌率差别较大。综合比较,红粘谷、9115、长农35、4 月64、师院-1 这5 个品种相对优势较大,符合实验筛选条件。在后续实验中选择师院-1 进行外植体系的构建。
2.2 谷子愈伤组织诱导条件的探究
2.2.1 不同浓度2,4-D 对愈伤诱导的影响
常用的植物激素包括生长素和细胞分裂素,其中生长素有2,4-D、NAA、IAA 等,细胞分裂素有TDZ、6-BA、KT 等。为探究诱导愈伤最适的2,4-D浓度,将师院-1 的种子萌发后取茎尖组织接种到诱导愈伤的①号培养基中(图1,a-b),其中2,4-D 的浓度分别设置为0.4、0.8、1.0、1.2 mg/L。观察结果显示,含有2,4-D 的培养基上培养3 d 初级愈伤形成(图1,d-g),经过继代形成质地较致密块状胚性愈伤组织(图1,h),当2,4-D 的浓度为1.0 mg/L时,愈伤率最高为87.5%(表2)。
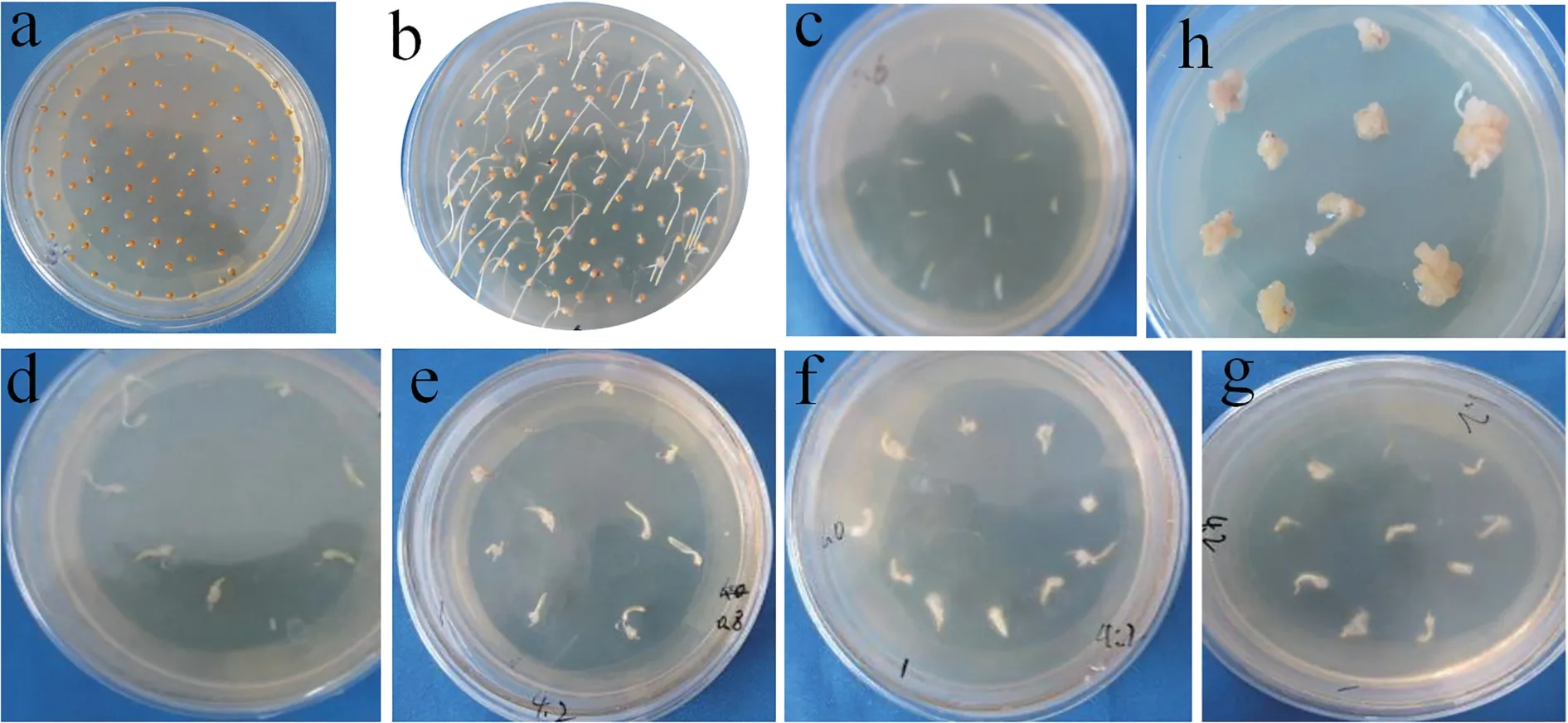
图1 不同浓度2,4-D 下师院-1 茎尖愈伤组织的诱导表达Fig.1 Induction and expression of stem-tip callus of Shiyuan-1 at different concentrations of 2,4-D

表2 不同2,4-D 浓度下培养两周的愈伤诱导率Table 2 The induction rate of callus under different 2,4-D concentration for two weeks
2.2.2 不同浓度KT+2,4-D 对愈伤诱导的影响
在确定该体系中2,4-D 的最适浓度为1.0 mg/L后,探究诱导愈伤过程中最适的KT 浓度。采用含有1.0 mg/L 2,4-D 的②号培养基,KT 浓度分别设置为0.05、0.1、0.2、0.4、0.8 mg/L。茎尖转移到培养基后25 ℃暗培养。一周后观察显示,KT 浓度较高时茎尖愈伤诱导率极低,分化率很高。KT 浓度较低时茎尖可诱导形成愈伤(图2)。诱导22 d 的结果显示,当KT 为0.1 mg/L 时,愈伤诱导率为50%(表3),但相对于只使用2,4-D 时愈伤诱导率降低。

表3 不同浓度的KT 培养基中愈伤诱导率Table 3 The induction rate of callus under different KT concentration
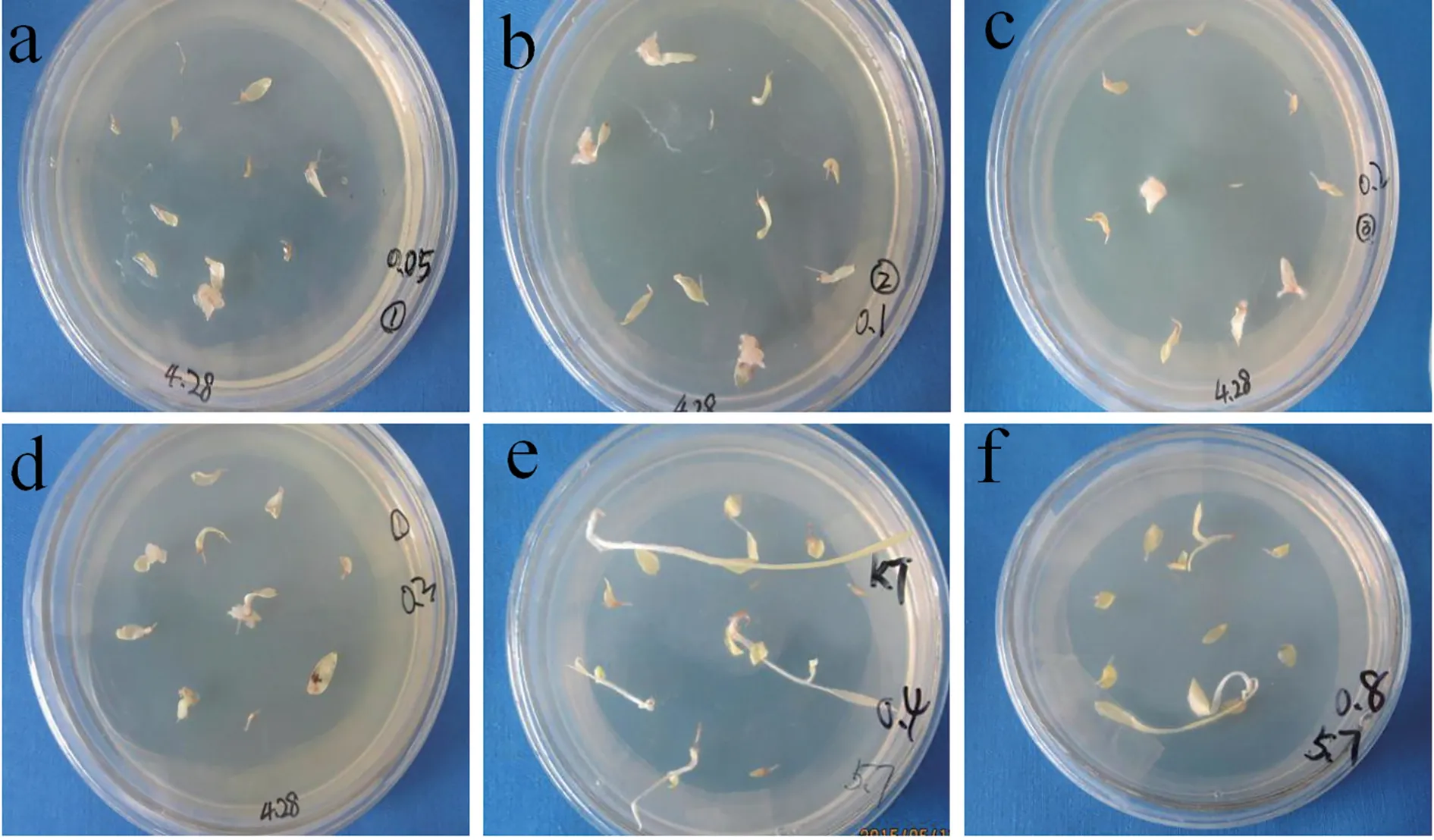
图2 不同浓度的KT 培养基上诱导的愈伤状态Fig.2 Callus induction under different concentration of KT medium
2.2.3 不同浓度ZT+2,4-D 对愈伤诱导的影响
为探究诱导愈伤过程中最适的ZT 浓度,采用含有1.0 mg/L 2,4-D 的③号培养基,其中ZT 浓度分别设置为0.8、1.0、1.2 mg/L。茎尖在该培养基中25 ℃暗培养,28 d 后观察各ZT 浓度培养基对茎尖的诱导效果。经对比分析,ZT 浓度为0.8、1.0、1.2 mg/L 时均有白色略透明的愈伤组织形成,诱导效果明显(图3)。同时,也发现添加ZT 后诱导的茎尖愈伤褐化现象明显增多。根据数据统计,ZT 浓度为1.0 mg/L时,愈伤诱导率最高,诱导效果最好,0.8 mg/L 时次之,1.2 mg/L 时最弱(表4)。因此,对师院-1 茎尖的诱导效果最佳的ZT 浓度为1.0 mg/L。
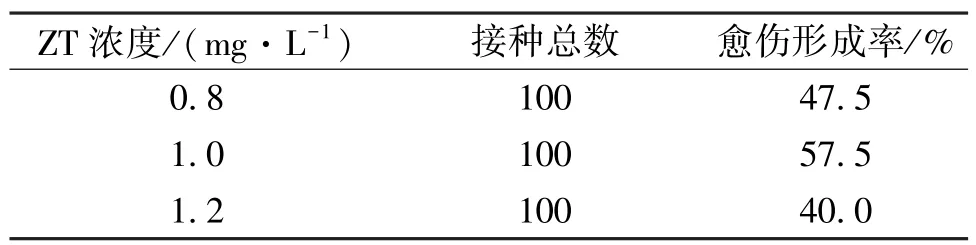
表4 各浓度ZT 培养基中愈伤诱导率Table 4 The induction rate of callus under different KT concentration
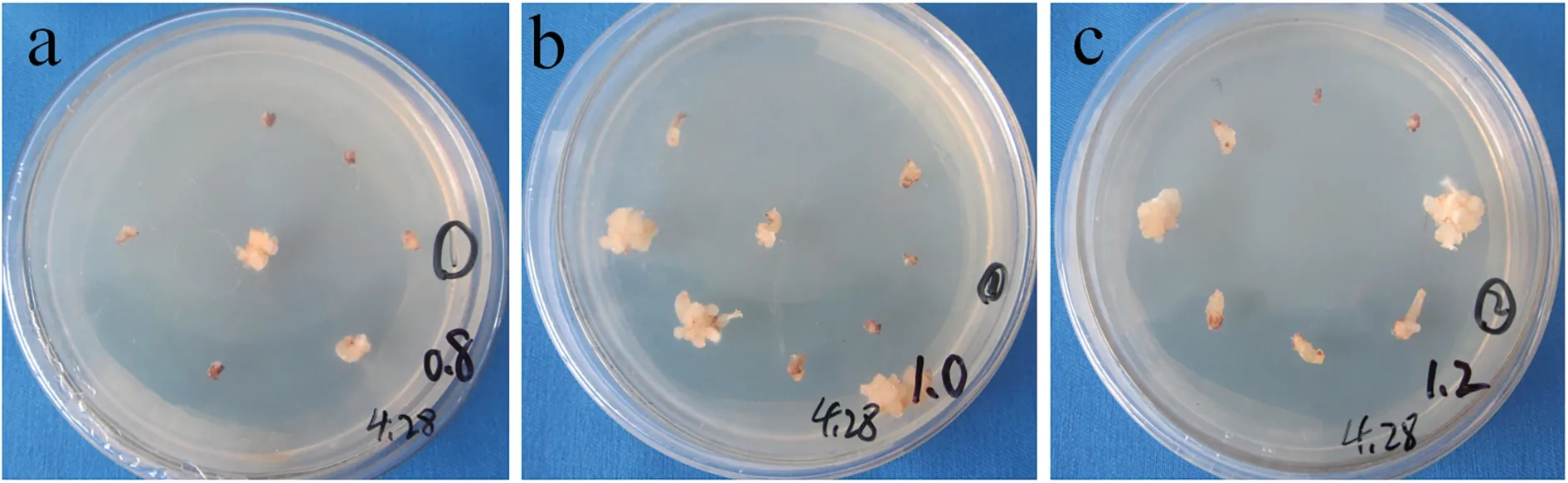
图3 不同浓度ZT 对师院-1 茎尖愈伤组织的诱导Fig.3 The callus induction of foxtail millet Shiyuan-1 under different ZT concentration
2.3 谷子愈伤组织再分化条件探究
2.3.1 不同浓度TDZ+2,4-D 对愈伤诱导芽的影响
设计生长素和细胞分裂素的比例进行愈伤组织的分化条件探究。将愈伤组织接种于不同浓度的2,4-D+TDZ 培养基上,2,4-D 浓度固定为1.0 mg/L,TDZ 浓度设置为0.5、1.0、1.5、2.0 mg/L 时,观察统计愈伤分化情况(图4)。结果显示,当TDZ 浓度为1.0 mg/L 时愈伤分化生苗率最高为35%(表5),其转绿、出芽和生根现象明显。同时也发现部分已分化愈伤转绿后绿点消失,逐渐褐化死亡,死亡后愈伤周围出现颗粒状、松散、较干燥的细胞团,其中残留的绿点一段时间后仍无法分化出丛生苗(图4)。
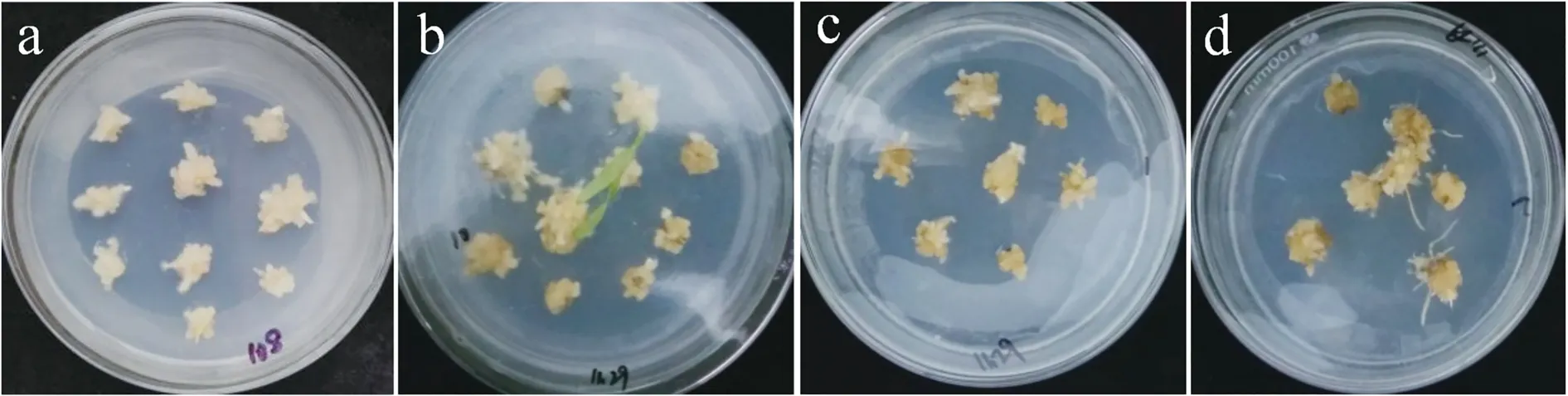
图4 2,4-D 与不同浓度TDZ 组合的愈伤组织出芽Fig.4 2,4-D callus budding in combination under different concentrations of TDZ

表5 2,4-D 与不同浓度TDZ 组合的愈伤组织分化情况Table 5 Callus differentiation of different concentrations of TDZ in combination with 2,4-D
2.3.2 不同浓度NAA+6-BA 对愈伤诱导芽的影响
将愈伤组织接种于不同浓度的NAA+6-BA 培养基上进行愈伤分化条件探究。将6-BA 的浓度设置为2.0 mg/L,NAA 浓度分别为0.2、0.4、0.6、0.8 mg/L,观察愈伤分化情况。结果显示,添加6-BA为2.0 mg/L,NAA 为0.6 mg/L 时,愈伤转绿、出芽和生根现象明显(图5),分化率最高为28%(表6),并且愈伤组织褐化较轻,质地紧密,生长状况良好。由愈伤组织分化得到的再生植株,经过炼苗后,移栽入试验田。
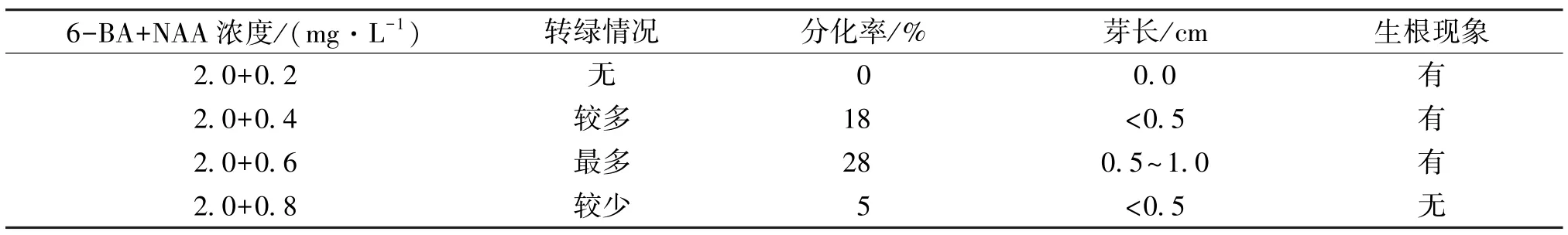
表6 6-BA+不同浓度NAA 的愈伤组织分化率Table 6 Differentiation rate of callus under different concentrations of 6-BA+NAA
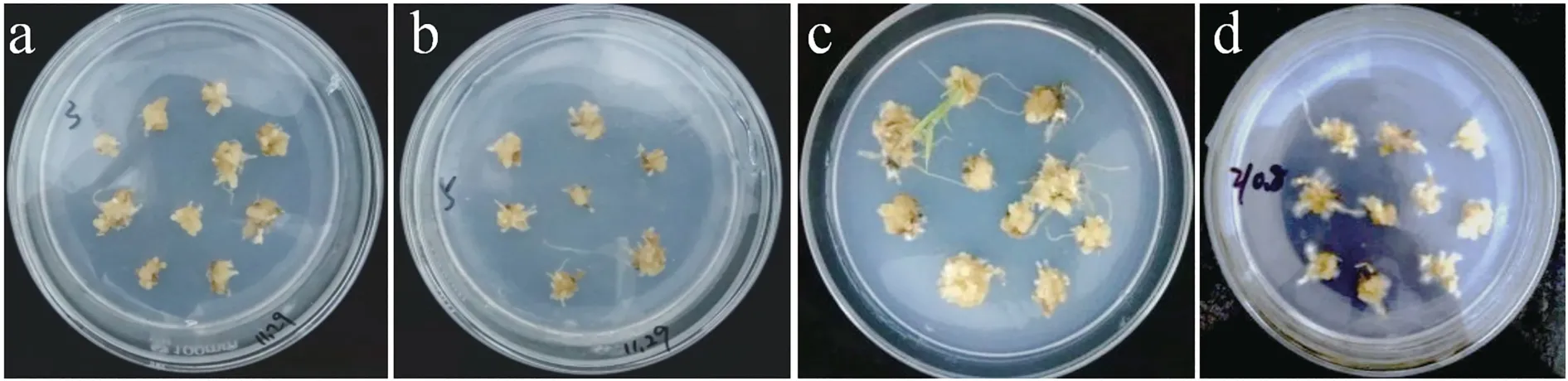
图5 不同浓度6-BA+NAA 的愈伤诱导芽分化Fig.5 Bud differentiation of callus induced by 6-BA+NAA at different concentrations
3 讨论
目前关于谷子组织培养中愈伤诱导及再生体系的建立均有报道,但其转化效率远低于水稻和拟南芥[17]。基因型在一定程度上决定了愈伤的诱导率和愈伤状态[11,18-19],因此筛选合适的基因型建立谷子组织培养体系仍是重点。本研究选取了适宜在承德地区种植的31 个不同基因型谷子,取茎尖进行愈伤诱导,筛选出5 种萌发率和愈伤诱导率较高、染菌率低的品种,其中部分谷子品种萌发率较低,甚至低于50%,这可能是由于当年的种子成熟度不够或者是成熟之后没有及时收获,增加了雨水浸泡概率,使种子活力受到影响所致。
在报道的愈伤诱导研究中,王寒玉等[15]以长生06、晋谷21 和长农35 作为供试材料,2,4-D 的浓度设置范围在0.5~2 mg/L,探究谷子茎尖愈伤组织的诱导条件,发现不同品种对2,4-D 的浓度需求不同,随2,4-D 浓度变化,愈伤诱导率变化也不同。本研究在31 个品种的出愈率筛选中将2,4-D 浓度确定为0.6 mg/L,不同基因型的茎尖愈伤诱导率不同,这与王寒玉等[15]结果相似。而在后续探究最适2,4-D 浓度时,其浓度范围又设置为0.4~1.2 mg/L,因此,对于其他浓度下另外30 个品种的出愈率是否会变化还有待验证。在愈伤诱导过程中,除了2,4-D的加入,还可引入细胞分裂素KT、ZT 或TDZ,也可能会增加愈伤的诱导率[15]。本文结果显示,在添加KT 或ZT 后师院-1 的愈伤诱导率并没有增加。这其中除了基因型起主导作用外,还可能与培养基组分不同有关,但是对其他谷子品种茎尖的出愈率影响还有待验证。
对于分化体系中激素的配比,文献报道的有NAA 和KT 组合[12],IAA 和KT 组合[20],TDZ[15]等。本研究探究其他激素的组合对愈伤分化的影响,结果显示在添加2 mg/L 6-BA 的前提下,添加0.6 mg/L NAA 时愈伤分化率最大。在2,4-D 浓度设置为1 mg/L,TDZ 浓度为1.0 mg/L 时愈伤分化生苗率最高。而激素的组合和浓度的配比在品种间的差异性还有待研究。此外,在水稻、玉米等作物中研究表明,多效唑可提高愈伤组织的分化率[21-22],是否对谷子愈伤分化有促进作用需进一步验证。研究过程中还发现,谷子的愈伤诱导和分化过程中存在水质化、褐化现象,而对于褐化的抑制也有研究报道[23-26],今后可参考进行改进。
4 结论
本实验选取31 个品种进行萌发率、愈伤诱导率、染菌率的统计,不同品种之间存在一定的差异,综合3 方面结果,选出红粘谷、9115、长农35、4 月64、师院-1 这5 个品种。以师院-1 的茎尖进行愈伤组织诱导,当2,4-D 浓度为1 mg/L 时诱导率最高。在2,4-D 存在的条件下添加KT 或ZT,愈伤诱导率最高时对应的KT 浓度为0.1 mg/L,ZT 为1.0 mg/L。在愈伤分化条件的探究中,激素浓度组合分别为1.0 mg/L 2,4-D+1.0 mg/L TDZ 或2.0 mg/L 6-BA+0.6 mg/L NAA 时,分化率较高。本研究结果为谷子的转基因体系建立奠定了一定的理论基础。

