植物耐盐机理研究进展
王瀚祥 李广存 徐建飞 王万兴 金黎平
(中国农业科学院蔬菜花卉研究所/农业农村部薯类作物生物学和遗传改良重点实验室,100081,北京)
土壤盐渍化导致的耕地土壤退化是全球农业最具破坏性的非生物胁迫之一。据统计,全世界有9.54亿hm2土地受盐渍化影响[1]。盐胁迫对植物生长的影响体现在植株生长势下降、衰老甚至死亡[2]。生理上,高盐引起渗透胁迫,表现为植物根系摄水困难、叶面水分流失加速[3],随后引发植物体内多种生理变化,如离子紊乱、质膜损伤和光合速率下降等[4]。盐胁迫还会导致植株体内过量活性氧(reactive oxygen species,ROS)积累,即氧化胁迫。ROS化学性质活泼,对细胞结构和生物功能产生破坏,包括引起膜质过氧化和膜质脱氧化,破坏蛋白质、叶绿素和核酸分子[5]。
植物为适应高盐环境,进化出了一套复杂的响应机制(图1)。几十年来,关于植物耐盐胁迫的研究主要集中在以下方面:(1)盐胁迫的信号转导;(2)渗透保护剂及溶质的生物合成;(3)离子稳态及区域化;(4)抗氧化系统;(5)植物激素;(6)其他方式。本文将从这6个方面综述前人研究。

图1 植物对胁迫信号的转导Fig.1 Stress signal transduction in plants
1 盐信号的早期感知
盐胁迫发生后,植物最先感知盐信号的分子机制还没有明确的结论,通常存在3种猜测。一是植物最先感知盐引起的渗透变化,二是根系中存在Na+感受器,三是盐诱导的细胞壁变化可以通过受体型激酶(FER)感知。
1.1 渗透感知
高盐引起的渗透胁迫造成细胞膜或细胞壁上的机械张力,激活了某些钙离子通道蛋白,使胞质Ca2+浓度迅速增加。OSCA1(reduced hyperosmolalityinduced[Ca2+]iincrease 1)被鉴定为导致这种Ca2+信号的关键蛋白[6],是渗透感受器候选蛋白。基于这种蛋白的结构推测,渗透压力在脂质双分子层产生张力,导致其构象改变并激活Ca2+通道,允许Ca2+进入[7]。虽然这种信号的转导途径还不清楚,但是OSCA1的鉴定为了解植物细胞感知渗透胁迫的途径开启了一扇新的大门。
1.2 Na+感受器
MOCA1(monocation-induced[Ca2+]iincrease 1)的鉴定是植物细胞外盐信号感知的突破性进展。moca1突变体缺乏对Na+、K+和Li+的早期Ca2+信号反应[8]。MOCA1作为葡萄糖醛酸转移酶,在质膜上产生糖基肌醇磷酸化神经酰胺(GIPC)鞘脂。这些GIPCs可以结合单价阳离子(如Na+)打开Ca2+通道,随即形成Ca2+波动诱导下游胁迫应答通路的响应[8]。
1.3 细胞壁信号感受器
膜内固有蛋白(如离子通道)可在双层膜内进行一定程度的运动,这种运动主要受到细胞壁的影响[9]。盐胁迫和渗透胁迫会引起细胞壁的机械张力产生应激信号,FER通路感知该信号防止细胞破裂[10]。该通路还引发短暂的Ca2+增加,但下游调控模式仍然未知。
1.4 胁迫信号的转导
植物感受到胁迫信号后,体内出现了3种调控信号因子:3′,5′环鸟苷酸(cGMP)、ROS 和 Ca2+。cGMP抑制Na+内流和K+外流,并促进胞质中Ca2+的增加[11];盐胁迫会迅速导致质外体ROS分子水平升高,ROS最初与多胺相互作用增加胞内游离Ca2+,并在后续Ca2+的转运过程中发挥关键作用[12-13]。上述调控信号因子主要引起体内Ca2+波动,随后钙调磷酸酶B型蛋白(CBLs)结合Ca2+,通过CBLs-蛋白激酶(CIPKs)互作引起蛋白磷酸化,激活耐盐调控通路。
2 渗透调节物质的合成
植物为应对高盐引起的渗透胁迫,体内合成脯氨酸(proline,Pro)、可溶性糖、甜菜碱(betaines)和多元醇(polyhydric alcohols)等渗透调节物质,在细胞水平促进渗透平衡,保持细胞膨压和正常的新陈代谢活动[14]。
Pro作为一种重要的渗透调节物质,以自由状态存在于植物细胞中,在生理pH范围内具有分子量小、水溶性高、无净电荷等特点。Pro作为渗透保护剂维持盐胁迫下植物的生长,保护光合系统,维持离子稳态,增强抗氧化系统[15-16]。Pro在植物体内主要由谷氨酸(Glu)通路合成,Glu在吡咯啉-5-羧酸合成酶(P5CS)催化下生成谷氨酸-1-半醛(GSA),GSA自发环化为吡咯琳-5-羧酸(P5C),在吡咯琳-5-羧酸还原酶(P5CR)的作用下还原为Pro。Pro在植物体内的降解基本上是合成过程的逆反应,首先发生在线粒体中,Pro在线粒体中由脯氨酸脱氢酶(ProDH)催化生成P5C,P5C在吡咯琳-5-羧酸脱氢酶(P5CDH)作用下生成Glu。盐胁迫下植株体内Pro积累的分子机制已被阐明,在非胁迫环境下,磷酸酶D(PLD)是Pro积累的反向调控因子;盐胁迫下,钙信号和磷脂酶C(PLC)触发P5CS转录和Pro积累[17],Pro的积累反馈抑制P5CS的活性[18]。胁迫结束后,Pro的分解代谢被激活,主要控制基因为PDH与P5CDH[17]。
可溶性糖主要包括葡萄糖、蔗糖和海藻糖,主要功能是稳固质膜和原生质体,保护可溶性酶[19-20],为有机物的合成提供能量。盐胁迫环境下,土壤渗透势的增大导致植物吸水困难,此时植物通过积累一些小分子可溶性糖来缓解这种渗透压力[21]。
甜菜碱主要包括甘氨酸甜菜酯(glycine betaine)、β-丙氨酸甜菜碱(β-alanine betaine)和脯氨酸甜菜碱(proline betaine)。甘氨酸甜菜酯的研究最广泛,它在植物应对非生物胁迫方面起到提高细胞的渗透压、保护细胞、稳固蛋白质、保护光合系统和提高抗氧化酶活性等作用[22-23]。甘氨酸甜菜碱在调控基因表达方面也有重要作用,它可以诱导特定基因(尤其是抗氧化酶)和转录因子的表达[24-25]。甘氨酸甜菜碱主要由胆碱合成,胆碱经胆碱单加氧酶(CMO)和甜菜碱醛脱氢酶(BADH)的先后酶促作用转化为甘氨酸甜菜碱,这2个基因可以通过其顺式调控元件(CREs)参与不同生物过程的转录调控,如胁迫和激素反应[26]。研究[27-28]发现,敲除CMO基因的甜菜植株比野生型甜菜植株更容易受到盐胁迫,BADH也在诸多转基因试验中被证明对植物耐盐性有促进作用。
多元醇是具有多个羟基的化合物,可作为有机反应原料。多元醇的积累,无论是甘露醇和山梨醇等直链代谢物,还是肌醇及其甲基化衍生物等环状多元醇,都与耐旱或耐盐有关,这是基于多元醇在许多物种中的分布情况而得出的结论[29]。植物遭受胁迫时,会激活依赖NADPH的甘露糖-6-磷酸还原酶,生成甘露醇,这类渗透调节物质发挥着保护质膜及酶活性的功能[30]。
3 离子稳态
植物暴露在高盐环境中时,除了面临上述渗透胁迫导致的摄水困难外,还面临着如Na+积累造成的离子毒害。植物通过离子转运蛋白将体内多余的Na+转出或区域化,模式植物中关于这类蛋白的研究较多。
3.1 NHX型Na+/H+反转运蛋白与Na+区域化
NHX蛋白(NHX Na+/H+antiporters)是离子区域化的重要转运器,所有已测序的植物基因组都含有NHX转运蛋白。拟南芥中有8种NHX亚型(AtNHX1-AtNHX8),其中4种亚型(AtNHX1-AtNHX4)定位于液泡膜,2种亚型(AtNHX5和AtNHX6)定位于核内体,其余2种亚型(AtNHX7/SOS1和AtNHX8)定位于质膜[31-32]。其中一些液泡NHX的过表达和异种表达导致植物的耐盐性增强[33]。AtNHX1蛋白C端以Ca2+依赖的方式与液泡内的钙调蛋白(CaM)相互作用,这种相互作用抑制AtNHX1的转运活性,说明离子区域化受Ca2+信号调控[34]。另外,NHX还参与维持植物体内K+稳态[31]。该通路调控模式如图2。

图2 离子区域化示意图Fig.2 Schematic diagram of ionic separation
3.2 SOS通路与Na+转运
高等植物体内存在一个高度保守的盐过敏感(salt overly sensitive,SOS)通路,SOS通路主要由SOS1、SOS2、SOS3和类SOS3蛋白(SCaBP8)组成。SOS1是植物质膜上的Na+/H+反转运器,主要负责将细胞内的Na+外排[35]。SOS2是一种丝氨酸/苏氨酸激酶,该酶会被盐胁迫引起的Ca2+信号激活[36]。SOS3/SCaBP8 是 Ca2+接收器[37-38]。SOS1在正常情况下处于自抑制状态[39],ABI2、14-3-3、GI和SOS2类似蛋白PKS5,作用于SOS2并抑制其活性[40]。盐胁迫下,胞外盐离子结合到植物细胞质膜外侧GIPC,引起细胞表面电势变化,打开质膜的Ca2+通道,细胞内Ca2+浓度增加形成Ca2+信号[8],14-3-3蛋白解码盐诱导的Ca2+信号后与PKS5相互作用抑制其活性[41],SOS2蛋白被释放,SOS3及SCaBP8结合Ca2+并与SOS2相互作用,增强SOS2活性并将其带到质膜,激活SOS1,促进Na+外排[37-38]。
Li等[40]发现糖原合成酶激酶类似物(BIN2)在盐胁迫结束后恢复期对于SOS通路的关闭起到关键作用,BIN2在盐胁迫过程中抑制BZR1/BES1等转录因子,从而抑制植物生长,在胁迫后恢复阶段BIN2与SOS3/SCaBP8形成复合物共同抑制SOS2活性并释放BZR1/BES1,使植物恢复生长。
3.3 HKT型转运器
HKT型转运器在植物Na+转导中的重要性最早在拟南芥上报道,研究[42]表明,拟南芥AtHKT1参与根系中Na+内流,AtHKT1通过韧皮部将茎、叶、花中大量Na+转运到根部以减少Na+在地上部的积累。其他作物如水稻有2类7种HKT转运器,第1类为Na+转运器,第2类则为Na+/K+通用离子转运器,在盐胁迫下离子稳态中都有重要作用[42]。
4 活性氧及抗氧化系统
4.1 活性氧
ROS是一种信号分子,参与代谢、抗病、细胞凋亡和消耗过剩光能等过程。遭遇非生物胁迫时,植物光能利用和碳同化受抑制,光合链中电子传递给O2的几率变大,在线粒体、叶绿体和过氧化酶体中产生大量的ROS,包括超氧阴离子(O2-)、羟基自由基(-OH),单线态氧(1O2)和过氧化氢(H2O2)。O2-造成脂质过氧化,危害细胞膜,还能氧化组氨酸、甲硫氨酸和色氨酸等特定氨基酸,在细胞中富集的O2-还会通过梅勒反应生成更多有害的ROS[43];H2O2在植物细胞中大量积累会氧化一些酶的硫醇基,使酶失活[44];-OH是ROS中最活跃、危害最大的物质,它对其生成点上的生物分子有很高的亲和力,氧化反应几乎与扩散同步。
ROS不仅损害质膜和光系统,甚至参与植物某些基因的表达,引起DNA剪切、损伤和修饰,致使蛋白质合成减缓或降解,在细胞水平和分子水平产生不可逆的损伤,导致细胞死亡[45-46]。植物为了抵抗ROS的毒害作用,进化出一套包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalases,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)和谷胱甘肽还原酶(glutathione reductase,GR)等抗氧化酶系统,以及依赖谷胱甘肽(glutatbione,GSH)、脱落酸(abscisic acid,ABA)、生育酚等非酶抗氧化剂的非酶抗氧化系统[47],共同参与植物体内多余ROS的清除。
4.2 抗氧化系统
SOD是细胞内最有效的透明质酸抗氧化剂,广泛存在于所有易受ROS侵害的细胞中。SOD在植物抗逆中的主要功能是降低体内O2-含量,它为植物抵抗高水平ROS的毒害提供了第1道防线,SOD因其辅酶因子的不同分为3类:铜/锌-超氧化物歧化酶(Cu/Zn-SOD)、锰-超氧化物歧化酶(Mn-SOD)和铁-超氧化物歧化酶(Fe-SOD)[48]。
CAT将H2O2还原为水和O2,CAT是所有酶中转化效率最高的酶类,每分钟大约可以将600万个H2O2分子转化成水和O2。CAT可以抵消盐胁迫的不利影响,提高叶绿素荧光参数和光合色素含量,避免叶绿体聚集[49]。
APX被认为是高等植物中清除活性氧并保护细胞最重要的酶。APX家族至少由4种不同的亚型组成,包括类囊体形式(tAPX)、乙醛酸循环体膜形式(gmAPX)、叶绿体基质可溶性形式(sAPX)和胞质形式(cAPX)[50]。盐胁迫下APX调节是一种后发性反应,盐处理下萝卜叶片和根中APX活性均增强,并且这种增强是在盐胁迫几天后才变得明显[51]。
GPX是机体内广泛存在的一种重要的过氧化物分解酶。GPX的活性中心是硒半胱氨酸,其活力大小反映机体硒水平。硒是GPX酶系的组成成分,它能催化GSH变为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构和功能。
GR是一种黄素蛋白氧化还原酶,存在于原核生物和真核生物中。GR是抗坏血酸-谷胱甘肽(ASA-GSH)循环的潜在酶,通过维持GSH低含量,在ROS防御系统中发挥重要作用。GR主要分布于叶绿体,少量分布于线粒体和细胞质[52-53]。
单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)和脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)也是植物体内重要的活性氧清除酶体。
抗氧化酶功能和转基因工作一直在不断深化,表1列出了抗氧化酶还原活性氧的反应式,表2为抗氧化酶及其在转基因植物抗盐胁迫中的作用。
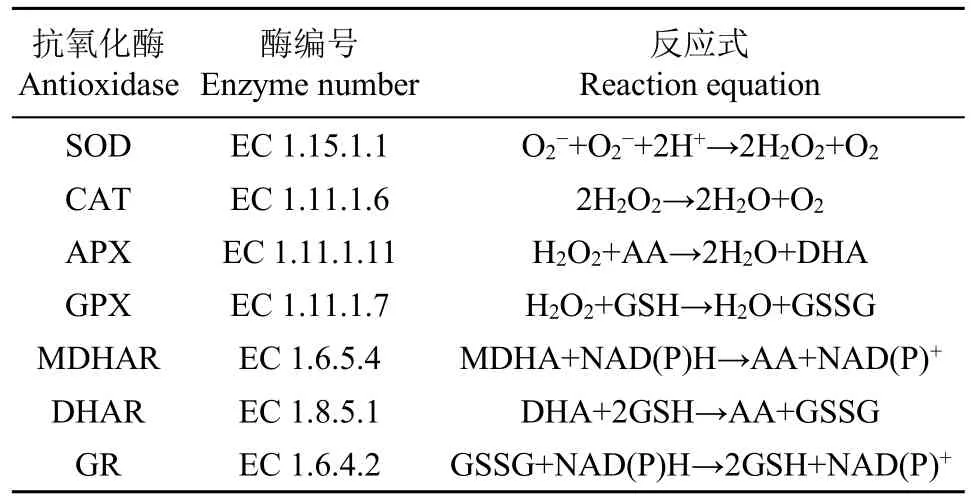
表1 抗氧化酶及抗氧化反应式Table 1 Antioxidant enzymes and antioxidant reaction equation

表2 活性氧清除酶及其在转基因植物抗盐胁迫中的作用Table 2 Reactive oxygen scavenging enzymes and their roles in salt resistance of transgenic plants

续表2 Table 2(continued)
4.3 非酶抗氧化剂
抗坏血酸(ascorbic acid,ASA)被认为是最有效的活性氧清除物质,它能够通过将酚氧(tocopheroxyl)还原为α-生育酚(α-tocopherol)的方式直接清除-OH和O2-,保护细胞膜[47]。ASA的功能在许多作物中都有报道,如小麦[73]和葫芦巴[74]的研究发现,外源ASA增加盐胁迫下植株的发芽率和幼苗长度,促进抗氧化系统,提升光合作用能力。最近一项研究[75]表明,ASA促进盐胁迫早期Ca2+积累并参与激活SOS通路。
Pro不仅是一种渗透保护剂,也是重要的非酶抗氧化剂,微生物、动物和植物都需要在体内合成Pro以减轻ROS的不利影响。Pro可以作为一个能量库来调节氧化还原电位[76],或作为一种溶质保护大分子不变性[77]。
GSH在植物受到盐胁迫时维持细胞正常还原状态,抵消ROS诱导的氧化胁迫[47]。关于大麦的研究[78]表明,外源GSH处理可明显提高大麦抗氧化酶活性以及抗氧化剂含量,降低细胞膜脂过氧化水平。
α-生育酚(α-tocopherols,vitamin E)是一种低分子量亲脂性抗氧化剂,它使细胞膜免受氧化和脂质过氧化损伤,提高细胞膜的稳定性和透性,还有助于为光合作用器官提供最佳环境[79]。盐胁迫下,外源生育酚保护光合作用器,恢复植株体内重要营养物质的平衡,最大限度保障蚕豆的生长和产量[80]。
黄酮类(flavinoids)化合物最突出的功能是赋予水果颜色,吸引种子传播者。花青素(anthocyanins)是植物体内常见的黄酮类天然色素,在植物的抗氧化胁迫中有重要作用[81],其主要功能为:(1)拦截和吸收光能,避免非生物胁迫下光能过剩对植物叶片造成光损伤;(2)保护抗氧化酶;(3)清除自由基;(4)与其他信号通路中的分子相互作用,间接清除ROS[82]。Oosten等[83]在salt overly sensitive3-1(sos3-1)突变体的第2位点抑制子的筛选中,分离出了anthocyaninimpaired-response-1(air1)突变体。在盐胁迫下,air1无法积累花青素,这是sos3-1在高NaCl水平(120mmol/L)下的关键表型。air1突变体在盐胁迫下花青素产生缺陷,而在其他胁迫如强光、低磷、高温或干旱胁迫下则没有。这一特异性表明,air1突变并不影响花青素的生物合成,而是影响其对盐胁迫的调控。该研究说明,盐胁迫下花青素的积累可能受SOS通路调控,此研究为非生物胁迫与黄酮类花青素形式的抗氧化剂积累之间的关系开辟了新的道路。
5 植物激素与耐盐调控
ABA是重要的抗逆激素。经典的ABA信号通路认为,正常生长条件下,Ca2+和ABI1/PP2C(abscisic acid insensitive 1/protein phosphatase 2C)抑制SnRK2/3/6/7/8/CDPK(蔗糖非酵解型蛋白激酶/钙依赖型蛋白激酶,sucrose non-fermenting 1-related protein kinases/calcium dependent protein kinase)活性,继而抑制下游信号[84-85]。非生物胁迫导致ABA水平升高,此时ABA信号被ABA受体PYR/PYL(pyrabactin resistance/pyrabactin resistancelike)感知并抑制ABI1/PP2C活性,诱导RCARs和H2O2水平升高,进而通过SnRKs2/3/6/7/8/CDPK将下游靶标磷酸化实现渗透调节,目前已经发现了几种SnRK2底物,包括AREB/ABF家族转录因子、RAV1(与ABI3/VP1相关)和离子通道(如SLAC1),这些基因是启动ABA下游响应基因和气孔运动的关键组分[86]。此外,在启动子中含有其他胁迫响应顺式调控元件的转录因子家族可能参与介导ABA响应基因的表达,已经鉴定的转录因子包括 NAC-、MYB-、HD-Zip、AP2/ERF-和 WRKY-型转录因子,它们在不同植物中被诱导响应盐胁迫[87]。
研究[88-89]表明,ABA通路可能与Ca2+信号通路整合,触发细胞ABA水平的应激信号也可以在植物中调用显著的细胞Ca2+信号,钙调磷酸酶b样蛋白(CBLs)/CBL-相互作用蛋白激酶(CIPKs)可感知这些信号,引发下游靶基因响应。ABA通路模型如图3。

图3 ABA通路示意图Fig.3 Schematic diagram ofABApathway
油菜素内酯(brassinosteroid,BR)是植物中广泛存在的激素,在细胞分化、植物生长和非生物胁迫应答中有关键作用[90]。棉花叶片和根系上施用BR降低了盐胁迫下棉花幼苗根、茎、叶中Na+、Cl-和丙二醛含量,提高Pro、叶绿素含量,提高棉花根系活力和总生物量[91]。BR对ROS代谢的调节作用也是明显的,它们可以诱导和调节某些抗氧化基因的表达,增加关键抗氧化酶的活性[92]。最近的一项研究[93]发现,盐胁迫早期有限度的BR信号激活或OsGSR1(BR合成调控基因)的正常表达,在低浓度ABA介导的盐胁迫耐受性中发挥关键作用,这项研究揭示了BR与ABA共同调控植物耐盐的分子机制。
乙烯是最常见的植物逆境调节激素之一,主要作用包括解除植物种子休眠,刺激植物茎、根的生长和分布,促进植物叶片和果实的脱落,影响雌雄异花植物雌性花的分化,抑制植物花的开放,促进花和叶片的衰老及果实成熟。盐胁迫下,乙烯信号元件EIN3/EIL1激活ROS清除基因表达,抑制过量ROS积累,增强拟南芥的耐盐性,也有研究[94-95]表明,乙烯信号的阻断会降低拟南芥的耐盐性。盐胁迫下乙烯维持芽和根中K+促进离子稳态,增加拟南芥盐胁迫能力[96]。该激素在盐胁迫中的信号转导模式已经被很好地总结[97]。
叶面喷施茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)的大豆细胞中Na+含量降低,K+和Ca2+含量上升,植株中甜菜碱、可溶性蛋白和叶绿素含量升高,抗氧化酶活性上调,细胞膜的稳定性和叶片含水量上升,并最终提高大豆产量[98]。
在拟南芥中发现了植物响应盐胁迫的新通路,该通路整合了JA、SA和ABA在植物响应盐胁迫的作用[99]。该通路由细胞壁富含亮氨酸重复伸展蛋白(LRX3/4/5)、快速碱化因子RALF22/23和受体激酶(FER)组成。正常情况下,LRX3/4/5蛋白与细胞壁中的RALF22/23结合,阻止RALF22/23与质膜定位的FER结合,促进植物生长,抑制胁迫反应。在盐胁迫下,LRX3/4/5和RALF22/23通过一种尚未明确的机制被分离。释放的RALF22/23肽结合FER并诱导其内化,暂停植物生长,FER的内化也会激活胁迫应激反应。另外,细胞外LRX3/4/5-RALF22/23-FER负调控JA、SA和ABA的水平[100],且这些基因的突变体植株表现出对盐胁迫的超敏感性与ROS的积累,在突变体中阻断这些通路或ROS的积累可以一定程度缓解盐的超敏感反应,说明LRX3/4/5-RALF22/23-FER通过调节激素稳态和ROS积累来控制植物的盐胁迫反应。该通路调控模式如图4。

图4 LRX3/4/5-RALF22/23-FER调控通路Fig.4 LRX3/4/5-RALF22/23-FER regulatory pathway
6 其他方式
Zhu等[101]研究表明,添加硅(Si)显著降低了盐胁迫下2个黄瓜品种叶片中电解质泄漏比例、H2O2和巴比妥酸反应物质的含量,显著提高了抗氧化酶的活性,并且这种效应随试验的进行而增强。Zhang等[102]研究了外源Si对盆栽甘草盐胁迫的影响,结果发现外源Si一定程度上恢复了甘草的生长,植株体内可溶性糖和蛋白含量显著增加,摄水困难症状得到缓解,并且体内抗氧化酶活性显著提高,细胞膜脂质过氧化程度减弱,膜透性增强。
硒(Se)在植物应对盐胁迫时也有重要作用。盐胁迫下,外源施加Se显著增加玉米生物量、根表面积和体积,提高植株内可溶性糖含量,降低叶片中 K+、Na+和 O2-含量[103]。
多胺类(polyamines,PA)是一种低分子量、普遍存在于植物界的脂族分子。在植物生长发育过程中,多胺起着调节细胞增殖、体细胞胚胎发生、分化和形态发生,打破块茎和种子休眠,促进花果发育和衰老的作用。多胺在植物盐胁迫中的积极作用体现在维持膜的完整性、调控抗氧化酶系统、减少叶绿素损失、降低ROS含量、维持植物组织和细胞中的Na+/K+、保护植物组织的完整和功能、减少地上部分Na+和Cl-含量等[104]。
一氧化氮(NO)是一种气体小分子,参与调控植物的各种生长发育过程,如根系生长、呼吸、气孔关闭、开花、细胞死亡、种子萌发等,同时也是一种胁迫信号分子。NO直接或间接触发许多氧化还原调节基因的表达。NO可以与脂质自由基反应以减轻脂质过氧化,清除超氧化物自由基和其他细胞过程生成的过氧亚硝基来保护细胞。它还有助于激活SOD、CAT和GPX等抗氧化酶[105]。NO会激活H+-ATPase,建立H+梯度,进而为Na+/H+离子反转运器提供动力,维护植物体内Na+/K+[106]。200mmol/L NaCl会抑制羽扇豆发芽,但是经过NO供体(sodium nitroprusside,SNP)预处理后,这种抑制作用会被抵消[107]。
微生物对植物耐盐胁迫也有促进作用,如耐盐性强的缓生根瘤菌可以促进柱花草在盐胁迫下的生长[108]。某些植物生长促进菌(plant growth promoting bacteria,PGPB)对促进植物耐盐性和生长具有特殊机制。这些细菌诱导植物合成植物生长素、细胞分裂素和赤霉素以及挥发性有机化合物。这些细菌也产生生长调节剂,如具有固定氮、溶解有机和无机磷酸盐的载体铁[109]。
7 问题与展望
盐胁迫是影响作物生长发育的最主要的不利环境因素之一,它通过水分胁迫、氧化胁迫、营养失衡、离子毒害、膜紊乱、细胞分裂伸长的抑制、关键代谢过程的中断以及遗传毒性影响植物发芽、生长、生活力和产量。几十年来,许多关于植物耐盐机理的关键基因和信号通路被提出,涉及盐胁迫信号的感知和转导,以及体内离子和ROS稳态的维持。但对植物胁迫应答网络的认知仍然十分有限。
第一,植物细胞最开始如何感知盐(Na+输入)的机制一直没有明确,前文提到2种可能的感知方式,一是寻找Na+感受器,通过筛选Ca2+瞬态,已经有少数候选的应激感受器,今后研究的重点应放在这些感受器的下游基因和调控网络。二是关于质膜和细胞壁界面的压力信号,LRX-FALF-FER通路已经被确定,但是LRX如何感知来自细胞壁的胁迫信号还不清楚。该通路除了通过3种植物激素调节耐盐性外还有没有其他的作用,是后续研究中应着重解决的问题。
第二,植物不同细胞和组织如何响应胁迫,不同细胞和组织的响应如何通过细胞间通讯和远距离信号协调和整合,目前尚不清楚[110]。具体表现如前文提到的Na+会在植物不同部位积累或者外排,什么因素致使植物各器官对盐的不同敏感性,敏感性是否依赖于不同的盐积累或组织特异性的信号传导,这些问题的答案会为提高植物耐盐性起到关键作用。今后的研究中,将离子转运相关基因的表达调控建立在特定组织或特定细胞水平上或许可以回答这些问题。
第三,植物耐盐胁迫应答机制在拟南芥的研究中已日渐清晰,但作物抗逆性分子机制的系统研究仍然滞后。与拟南芥相比,其他作物往往更复杂,可能有额外的机制来应对盐胁迫,不同的物种可能具有不同的应激反应机制。随着基因组测序、组装和注释技术的发展,种质资源的收集和分析,大量作物中耐盐胁迫基因甚至新的调控机制会在不久的将来被发现。此外,盐生植物的研究略显不足,过表达苏打猪毛菜NHX基因的紫花苜蓿可以在高达400mmol/L NaCl的环境中生活50d[111],盐生植物特殊的耐盐基因和分子机制可能对未来耐盐作物育种提供基因资源和理论基础。
第四,现有的研究多集中在植物本身对盐胁迫的感知与应答,但植物所处的环境空间中的其他因素如光照、温度、湿度和微生物等,这些因素之间对于植物耐盐性是否有影响,需要更多深入的研究。
第五,尽管有很好的研究前景和大量的信息积累,通过转基因手段开发既耐盐又具有优良农艺性状(如产量)的作物依然困难,没有增加耐盐性的转基因作物商业化[112]。因为植物耐盐性往往与体内离子稳态直接相关,离子稳态的改变往往会导致产量的降低[110]。一些基于田间的研究如转HAL1基因番茄T-6在盐胁迫下的产量比原品系提高了27%[113],在250mmol/L NaCl下,转P5CS基因的鹰嘴豆在种子质量和数量上均没有明显下降[114],这种在商业水平开发耐盐作物值得尝试。除传统育种和基因工程育种外,一些研究有望在未来生产实践中应用,低盐驯化或在基质中混入生物炭均能有效地提高作物耐盐性[115-116]。

