ARID1A在浸润性乳腺癌中的表达及临床意义*
张 郡,夏红蕾,杨沁惠
(兰州市妇幼保健院,甘肃 兰州 730030)
乳腺癌是女性肿瘤中发病率占第一位的肿瘤[1]。近年来,肿瘤全基因组测序发现ARID1A基因在多种肿瘤中存在大量突变[2],ARID1A基因突变导致的ARIDA亚基缺失会影响SW1/SNF复合物功能的完整性,从而影响下游靶基因的转录、DNA复制和修复。浸润性乳腺癌中ARID1A表达的研究,检索国内外文献相关报道较少。本研究中,采用免疫组织化学SP法检测ARID1A基因在浸润性乳腺癌组织中的表达情况,统计并分析ARID1A基因在浸润性乳腺癌、乳腺良性病变及正常乳腺组织中的表达及与乳腺癌患者临床病理参数间的关系。
1 资料与方法
1.1 标本收集及临床资料
收集兰州市妇幼保健院2014年1月—2017年1月病理诊断为乳腺浸润性癌的病例101例,并取其癌旁正常组织19例,收集诊断为乳腺纤维腺瘤的患者48例,收集纳入病例完整的临床资料及随访信息。以上信息获得患者的知情同意。
1.2 HE染色及免疫组织化学染色检测
组织经4%的中性甲醛固定,常规石蜡切片、HE染色。免疫组化染色抗体ARID1A购自苏州百道生物有限公司。免疫组化采用SP法。实验设置阳性、阴性对照,依据报道,ARID1A因子以细胞核呈棕黄色颗粒为阳性表达,ARID1A阳性的判定以<5%的阳性细胞为0-+,5%~10%的阳性细胞为++。>10%的阳性细胞为+++,将++、+++定义为阳性,0-+定义为阴性。经免疫组织化学染色的组织切片由2位病理科副主任医师对切片独立评估并独立评分,而不知道患者特征。最终选取其一致性结果。
1.3 统计学分析
采用SPSS 24.0统计学软件进行统计分析,使用卡方检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 临床资料
101例浸润性乳腺癌患者均为女性,年龄27~84岁,中位年龄52岁,其中浸润性导管癌98例,内分泌癌1例,粘液癌2例,有脉管侵犯1例,同侧乳腺多发病灶4例,双侧乳腺癌1例。
2.2 结果分析
根据ARID1A在乳腺癌组织中的表达情况,将101例乳腺癌患者分为阳性组和阴性组,阳性患者32例,阴性患者69例。
在101例浸润性乳腺癌中ARID1A阳性表达32例,阳性率为31.68%。对照组中乳腺纤维腺瘤及癌旁正常乳腺组织中ARID1A阳性表达率均较浸润性乳腺癌组织中增高,分别为43.75%、68.42%,两者与乳腺癌组比较差异有显著性(P<0.05)(表1)。

表1 浸润性乳腺癌组和对照组中ARID1A的表达
在浸润性乳腺癌患者组织中ARID1A的表达与是否发生淋巴结转移相关(P<0.05),且在发生淋巴结转移的患者中(阳性率18.03%)阳性表达明显低于无淋巴结转移的患者(阳性率52.50%),而与患者年龄、组织分级、肿瘤的大小及TNM分期无关(P>0.05)(表2)。
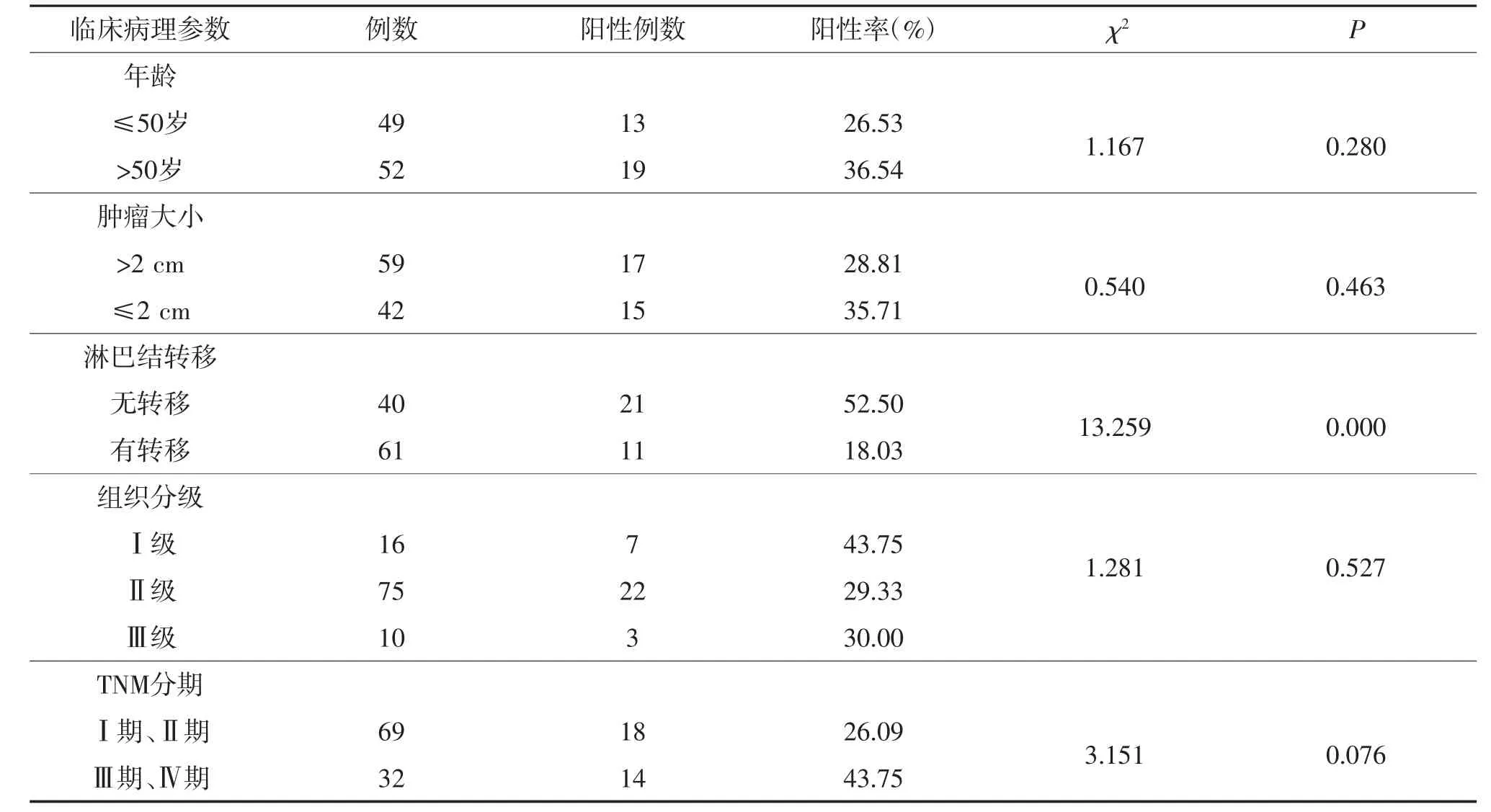
表2 ARID1A在浸润性乳腺癌中的表达及与临床病理特征之间的关系
ARID1A在浸润性乳腺癌、乳腺纤维腺瘤及癌周 正常乳腺组织中表达均定位于细胞核(见图1—图4)。
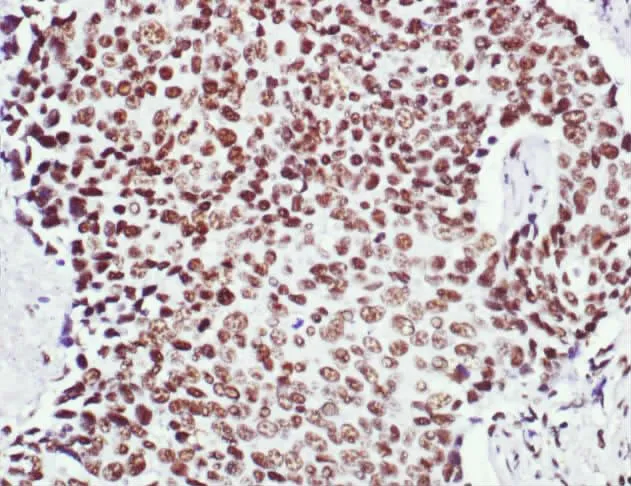
图1 ARID1A在乳腺浸润性导管癌中呈阳性表达
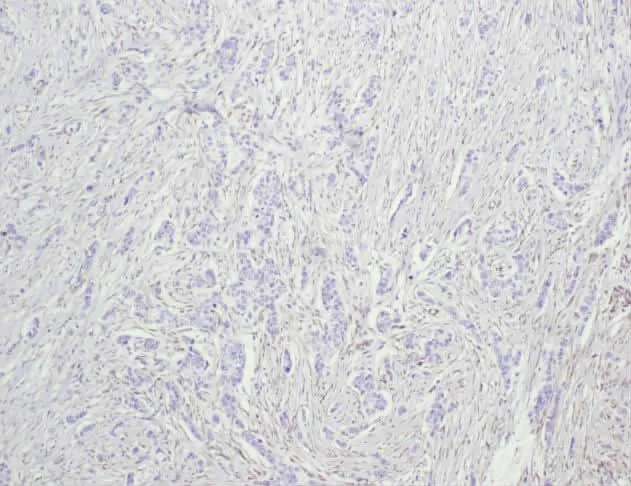
图2 ARID1A在乳腺浸润性导管癌中呈阴性表达
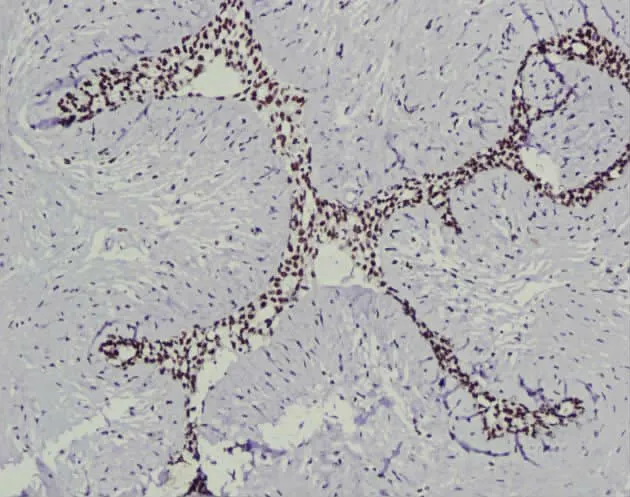
图3 ARID1A在乳腺纤维腺瘤中呈阳性表达
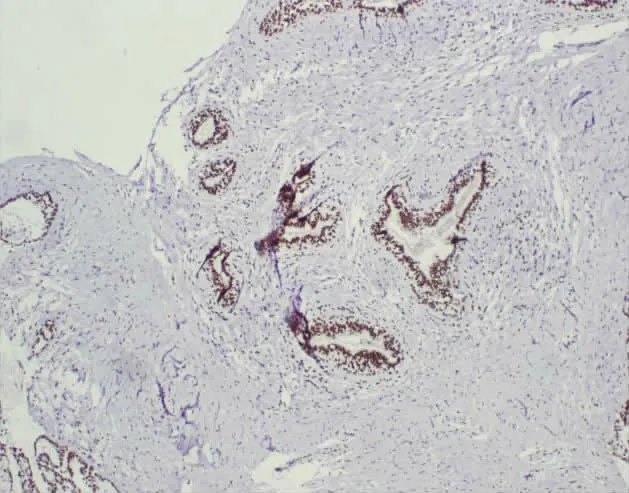
图4 ARID1A在正常乳腺组织中呈阳性表达
3 讨论
ARID1A基因又名BAF250A、SMARCF1或P270,ARID1A基因位于人染色体1P35.3,结构分析以及体外实验显示,ARID1A可以以序列非特异性的方式与富含AT的DNA序列结合发挥作用[3]。
ARID1A基因是一种肿瘤抑制基因[4],是染色质重塑复合物SW1/SNF的核心亚基,在癌细胞中具有较高的突变率[5]。SW1/SNF是一种多亚基的染色质重塑复合物,在DNA转录、复制、损伤修复中发挥重要的作用。ARID1A基因可与富含AT的DNA序列非特异性结合,通过蛋白质之间的相互作用介导相关蛋白发挥作用。在DNA复制、重组、修复及转录过程中,染色质的包装及相应DNA分子发生改变,称为染色质重塑,SW1/SNF是多亚基染色质重塑复合物,依赖ATP水解能量来重新定位核小体,以此来调节基因表达[6]。
以往研究表明,ARID1A的表达与细胞周期有关,其在G0-G1期表达最高,在S期和G2-M期明显降低,在分裂旺盛的细胞中几乎完全缺失。P21/WAF可与细胞周期蛋白CDK2/CDK4复合物结合并抑制其活性,从而使细胞周期停滞于G1期,ARID1A可调节P21/WAF1基因的表达[7]。
近年来多项研究显示,磷脂酰肌醇-3-激酶(PI3K/AKT)信号通路与肿瘤的发生有密切关系,在细胞的增殖、分化、凋亡、代谢等多种细胞功能中发挥重要作用。ARID1A在肿瘤发生中的作用与PI3K信号通路的激活相关[8]。研究发现ARID1A突变常与PI3KCA激活突变和/或PTEN表达缺失共存,这两者都可导致PI3K/AKT下游信号通路的激活。ARID1A可通过使PI3K/AKT信号通路蛋白的变化、EMT(上皮-间充质转化)、细胞周期、与原位癌基因P53等相互作用调控细胞的增殖。
近年来,有文献报道ARID1A在卵巢癌、脑胶质瘤、肝癌、胃癌、乳腺癌中发生突变,但其在乳腺癌中的研究较少。在卵巢癌中,ARID1A通过上调P21和SMAD3基因的表达来抑制肿瘤细胞的增殖,在脑胶质瘤中,ARID1A通过影响PI3K/AKT信号通路来抑制细胞增殖,但在肝癌、胃癌、乳腺癌中的作用机理还需进一步研究。
张倩等[9]通过以慢病毒为载体的RNA干扰技术,发现干扰ARID1A的表达促进了乳腺癌细胞的生长、迁移及侵袭能力。在干扰掉ARID1A后,Akt磷酸化水平升高,P21表达量下降,细胞周期S期上升,G2期下降,过表达ARID1A后,Akt磷酸化水平下降,P21表达上升,S期下降,G2期上升,细胞凋亡比例上升。乳腺癌中ARID1A可能通过调节Akt磷酸化以及细胞周期来调控细胞的增殖。
Zhang等[10]研究了112例浸润性导管癌中ARID1A的表达,结果显示,ARID1A mRNA在乳腺癌中的表达低于正常乳腺组织(P<0.001),且与肿瘤大小、较高的临床分期有关,发现低ARID1A表达是总体生存率的预测因素,而不是独立因素。Samartzis等[11]研究,ARID1A敲低后,MCF7乳腺癌细胞对AKT抑制剂MK-2206和perifosine及PI3K抑制剂buparlisib的敏感性显著增加。Uncel和Diniz[12]在292例乳腺癌标本中检测到123例存在ARID1A基因表达缺失,且ARID1A缺失与淋巴结转移之间有显著性差异(P=0.001)。
本研究结果显示,ARID1A在浸润性乳腺癌组织中的阳性表达率低于乳腺纤维腺瘤及癌周正常乳腺组织,且在发生淋巴结转移的患者中阳性表达明显低于无淋巴结转移的患者,这与之前文献报道的结论有相似之处。提示ARID1A因子的突变或缺失与乳腺癌的发生发展密切相关,进一步提示ARID1A在浸润性乳腺癌的发生发展中起保护性作用,ARID1A有望成为乳腺良、恶性病变鉴别的分子生物学参考指标之一。

