PCOS患者血清miR-320a、miR-145表达水平及其与雌孕激素的关系探讨
邹玥,刘颖
(吉林省妇幼保健院中心实验室,长春 130000)
多囊卵巢综合征(PCOS)多出现无排卵性不孕,是一种生殖内分泌紊乱性疾病,临床多表现为卵巢多囊性改变、月经失调、高雄激素血症和持续性排卵障碍等,其病理特征主要是性激素分泌紊乱、胰岛素抵抗[1]。雌、孕激素是影响子宫内膜生长发育、维持正常月经周期的重要性激素[2]。目前临床大多以补充外源性雌、孕激素来改善PCOS患者月经失调、不孕等症状[3];但其作用的有效靶点尚不明确,寻找雌、孕激素作用的内源性靶点可能为PCOS的临床诊疗提供新的思路和参考。
微小RNAs(miRNAs)作为内源性小分子单链RNA,由19~24个核苷酸构成,参与人体内分泌、代谢、生长发育以及多种疾病的发生、发展过程,并且其数量和种类也随疾病状况和生理状况而改变[4]。研究发现,卵母细胞发育与miR-320a表达水平显著相关,而miR-145可以通过调控巨噬细胞的增殖和凋亡,在胚胎着床过程中发挥免疫耐受作用[5-6],二者均可能与PCOS具有一定关系。目前,尚未有研究报道PCOS患者血清miR-320a、miR-145的表达情况,及其与PCOS患者雌孕激素水平是否相关。因此,本研究拟采用实时荧光定量PCR(Real-time PCR)检测PCOS患者血清miR-320a、miR-145的表达水平,并分析其与雌孕激素的关系,以期为临床治疗提供参考和借鉴。
资料与方法
一、研究对象
采用前瞻性研究,选取2019年5月至2021年7月于本院就诊的92例PCOS患者作为PCOS组,另招募同期在本院健康体检的90例育龄期女性作为对照组。
纳入标准:(1)年龄≥20岁;(2)对照组经B超检查卵巢形态正常,排除PCOS;(3)PCOS组符合PCOS的诊断标准[7];(4)患者均签订知情同意书。
排除标准:(1)合并子宫肌瘤、卵巢囊肿等生殖器官器质性疾病;(2)合并糖尿病等内分泌疾病或自身免疫性疾病;(3)合并恶性肿瘤及严重脏器功能障碍;(4)合并精神障碍;(5)近6个月内使用过激素类药物。
二、研究方法
1.样本采集:抽取空腹静脉血6 ml(对月经不规律者于B超检查未见优势卵泡时抽取肘静脉血,对于月经规律者在月经周期3~5 d抽取肘静脉血),静置2 h后放入离心机,以3 500 rpm离心5 min,吸取上层血清,将其均匀分为两份,置于离心管中,放入-80℃冰箱中保存。
2.Real-time PCR:使用Trizol试剂盒(Invitrogen,美国)提取血清中总RNA,用cDNA合成试剂盒(北京天根)进行反转录,最后采用Real-time PCR法检测血清miR-320a和miR-145相对表达量。miR-320a采用定量PCR试剂盒(FP411,Cell Signaling Technology,美国)进行Real-time PCR反应,反应条件:95℃ 15 min,94℃ 20 s,65℃ 30 s,72℃ 34 s,5个循环,94℃ 20 s,60℃ 34 s,40个循环。miR-145亦采用定量PCR试剂盒(FP401,北京天根)进行Real-time PCR反应,反应条件:94℃ 10 min,94℃ 15 s、60℃ 30 s,45个循环,72℃ 5 min。均以U6为内参。采用2-ΔΔCt计算miR-320a和miR-145相对表达情况。引物序列见表1。
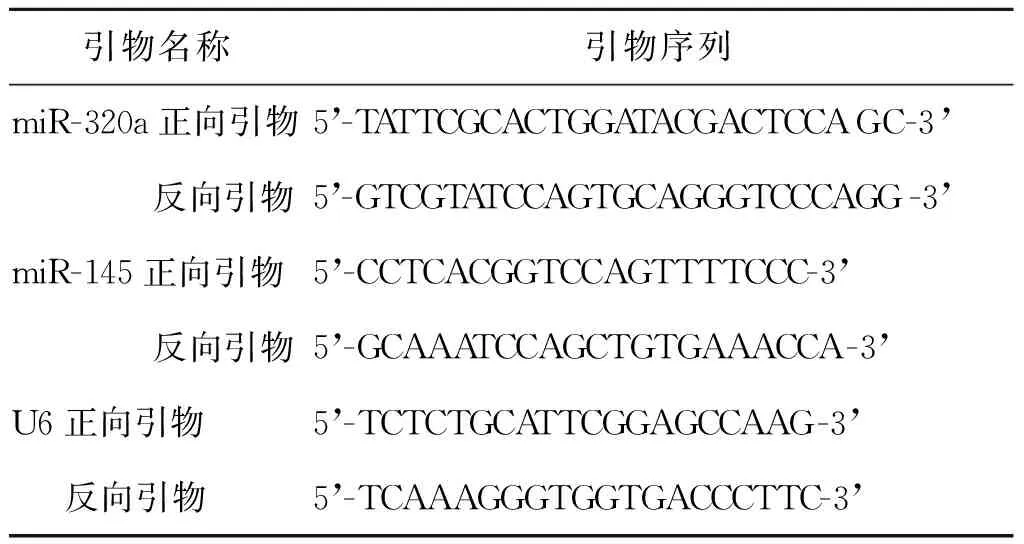
表1 Real-time PCR反应引物序列
3.雌孕激素检测:采用电化学发光法进行检测,使用全自动化学发光仪(Cobas e411,罗氏,德国)检测血清E2、孕酮水平,检测中所需的试剂盒均由德国罗氏公司提供。
三、统计学分析

结 果
一、两组患者的临床资料比较
两组患者的年龄和体质量指数(BMI)比较均无显著性差异(P>0.05);电化学发光法检测结果显示,PCOS组患者血清E2和孕酮水平均显著低于对照组(P<0.05)(表2)。

表2 两组患者临床资料比较[(-±s),M(Q1,Q3)]
二、两组患者血清miR-320a、miR-145表达水平比较
Real-time PCR结果显示,PCOS组血清miR-320a和miR-145表达水平均显著低于对照组(P<0.05)(图1)。

与对照组比较,*P<0.05。图1 两组患者血清miR-320a和miR-145表达水平比较
三、PCOS患者血清miR-320a、miR-145表达水平与雌孕激素水平的相关性分析
Pearson相关分析结果显示,PCOS患者血清miR-320a、miR-145表达与E2和孕酮水平均呈显著性正相关(P<0.05)(表3,图2、3)。
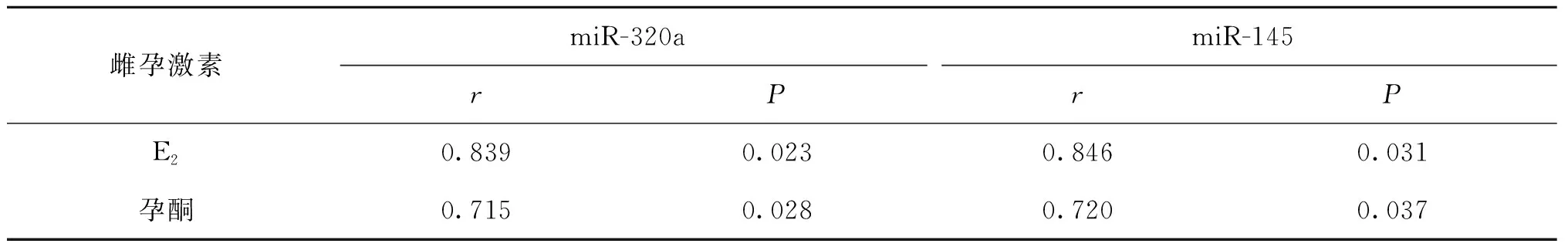
表3 PCOS患者血清miR-320a、miR-145表达水平与E2、孕酮水平的相关性分析
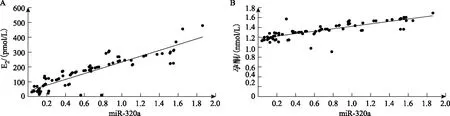
A:血清miR-320a与E2的相关性分析;B:血清miR-320a与孕酮的相关性分析。图2 血清miR-320a与E2、孕酮的相关性分析
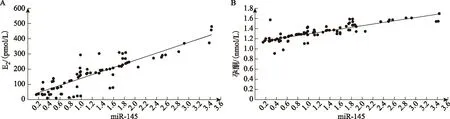
A:血清miR-145与E2相关性分析;B:血清miR-145与孕酮相关性分析。图3 血清miR-145与E2、孕酮相关性分析
讨 论
随着人民生活方式的转变和生活压力的增加,女性PCOS发病率为5%~21%,并呈现上升趋势[8]。PCOS患者多伴有闭经、不孕、多毛及肥胖等症状,增加了并发心血管疾病和2型糖尿病的风险,严重者甚至出现自然流产现象,影响患者的远期健康及生育问题[9],故需引起临床的高度重视。PCOS的发生与非酒精性脂肪肝病、环境因素、血脂异常、代谢综合征及遗传等有关,但PCOS的具体病因或发病机制尚未明确,且彻底治愈较难。目前,药物治疗是PCOS患者临床治疗的首选方式,通过外源性激素调节体内雌、孕激素水平,虽然能在一定程度上改善临床症状,但并未能从根本上解决问题,且易引发患者代谢紊乱[10]。因此,亟需寻找可以调节雌、孕激素的内在靶点,以期为治疗PCOS提供新方向。
本研究结果发现,PCOS患者血清miR-320a、miR-145表达水平显著低于对照组(P<0.05),推测miR-320a、miR-145可能参与PCOS的病理过程。PCOS患者月经周期不稳定以及不孕的重要因素是卵泡生长受抑制导致其发育异常。miRANs是内源性非编码小分子RNA,作为转录后调控的关键因子,其可以调控多种生物过程,并参与多种疾病的发生、发展。miR-320a具有抗炎、调控细胞增殖和抗氧化的作用,其表达水平与卵母细胞发育情况联系密切。既往研究发现,PCOS患者外周血miR-320a表达水平显著低于正常女性[11],本研究结果与之相符。有研究发现,miR-320a通过直接靶向SF-1和E2F-1调节卵巢颗粒细胞增殖,维持卵泡生长发育,miR-320a与PCOS的发生密切相关[12]。另有研究发现,PCOS患者血清miR-145可以通过激活细胞外信号调节激酶来抑制颗粒细胞的增殖,促进细胞凋亡进而参与PCOS的发生发展;与对照组比较,PCOS患者血清miR-145表达水平呈现显著下降的趋势[13]。此外,胰岛素受体底物(IRSI)作为miR-145的靶基因,其蛋白表达受到miR-145的抑制,进而miR-145抑制了PCOS患者颗粒细胞的增殖。
本研究结果显示,PCOS患者血清孕酮和E2水平均显著低于对照组(P<0.05),说明PCOS患者雌激素、孕激素均低于健康育龄女性。雌孕激素作为影响子宫内膜的重要因素之一,在其发挥调控作用后,会引起子宫内膜出现周期性变化,从而形成月经周期(规律的月经出现是生殖功能成熟的标志)[14]。E2作为由卵泡分泌的一种雌激素,可以促进下丘脑-垂体系统促性腺激素释放激素-垂体促性腺激素(GnRH-Gn)表达,发挥正反馈作用,进而促进排卵[15],而PCOS患者由于下丘脑-垂体-卵巢轴功能异常,故E2水平也较低。另外,E2可以刺激输卵管的发育及蠕动,促进卵母细胞或受精卵着床。此外,雌激素还可以间接反应卵母细胞的质量,而卵母细胞的质量则影响卵母细胞体外成熟,并影响PCOS患者生育及妊娠结局[16]。孕激素是由人体卵巢颗粒黄体细胞分泌产生,主要以孕酮为代表,作为一种天然孕激素,它是妊娠维持所必须的激素,具有抑制排卵,促进子宫内膜分泌的作用[17]。PCOS是一种常与无排卵相关的异质性疾病,由于PCOS患者成熟卵泡发育少,无法排卵,导致雌激素保持在低水平的阈值范围,并且卵巢不能分泌孕激素,因此PCOS患者雌孕激素水平较低,子宫内膜发育迟缓,导致正常月经周期和早期妊娠不能维持,影响生育。
Pearson相关性分析显示,PCOS患者血清miR-320a、miR-145表达与E2和孕酮水平均呈显著正相关(P<0.05),提示临床干预中可通过靶向调控miR-320a、miR-145的表达来调节PCOS患者雌孕激素水平,为临床治疗PCOS患者提供新方向。雌激素局部合成的主要场所是颗粒细胞,可以对卵泡的生长产生刺激,并给其它组织提供内分泌信号[18]。相关研究发现,miR-320a靶向作用于转录因子E2F1和SF-A,促进颗粒细胞增殖,促进雌激素合成以及孕酮产生[19]。miR-145参与炎症和免疫过程,以及细胞的分化、代谢、凋亡等,并在其中发挥重要作用,同时对IRS1具有靶向抑制作用,进而起到抑制细胞增殖的效果。另外,miR-145可以通过颗粒细胞中的P13K/AKT信号通路,使细胞代谢中的胰岛素水平得到调节,促使PCOS患者E2和孕酮表达水平升高。
综上所述,PCOS患者血清miR-320a、miR-145的表达水平显著低于正常育龄期女性,且血清miR-320a、miR-145表达水平与血清E2、孕酮水平呈正相关,提示临床干预中可通过调控miR-320a、miR-145的表达来调节PCOS患者雌孕激素水平。但是,由于本研究纳入的样本量较少,研究结果可能存在一定的局限性,后续研究仍需进一步扩大样本量加以验证,以期为临床干预提供一定参考和依据。

