阿米替林与自闭症谱系障碍潜在关系挖掘
吕艳华,武 莉,原雨阳,贺培风,卢学春,于 琦
自闭症谱系障碍(autism spectrum disorders,ASD)是一种广泛性的发展障碍,主要表现为社会交往障碍、言语和非言语发育迟缓、兴趣范围有局限性和行为僵化刻板[1]。亚洲ASD 平均患病率为1%~2%,男性儿童的患病率大约是女性儿童的5 倍。由于对ASD 的发病机制和病因尚无共识,目前ASD 的治疗通常是对症治疗[2]。研究结果显示,阿米替林对儿童、青少年和成人的易怒、攻击性、胃肠道问题和失眠有效[3],且根据所构建的“药物-靶点”关联网络对自闭症相关药物及靶点进行关系预测研究,发现阿米替林在治疗 ASD 方面表现出良好的药物价值属性[4]。通过文献检索发现,阿米替林也常被用来和其他药物(如米氮平、多奈哌齐、帕罗西汀、西酞普兰等)进行对比实验,来验证其他药物对ASD 的疗效。为进一步探明阿米替林在体内作用的分子机制,本文利用临床生物信息学方法,借助临床生物信息学表观精准治疗预测平台EpiMed,分析阿米替林对全基因组表达谱的影响,并结合 EpiMed 平台的预测结果,探讨阿米替林抗ASD 的潜在分子机制,为阿米替林治疗ASD 的方案及后续优化提供理论依据。
1 数据与方法
1.1 数据来源
Gene Expression Omnibus(GEO)数据库是由美国国立生物技术信息中心创建和维护的基因表达数据库,它收录了世界各地研究机构提交的大量高通量实验数据,也是当今最大、最全面的基因表达数据库[5]。本文分别以“amitriptyline”和“autism”为检索词在GEO 数据库中进行检索,在条目类型中选择“series”,分别得到17 条和468 条检索结果,为进一步提高基因数据检索的准确性和可靠性,根据以下筛选条件对检索结果进行二次筛选。物种:与人类基因高度同源的人类或物种(小鼠、大鼠等);实验设计:3 组或更多组的重复实验;数据类型:转录组数据或全基因组表达谱数据;数据质量:数据具有完整性且有对应的平台注释文件标准、规范。经过筛选后,选出符合条件的数据集GSE59927和GSE28521。其中,GSE59927 数据集以大鼠为研究对象,包含了600 多种不同药物或化合物样本的表达矩阵,涵盖有阿米替林作用于大鼠肾脏的全基因组表达谱数据;GSE28521 数据集的作用对象均为人类,其实验数据源自于从ASD 患者和对照组个体死后所提取的小脑、额叶皮质和颞叶皮质的脑组织,共包含79 条样本数据。本文的分析流程如图1 所示。
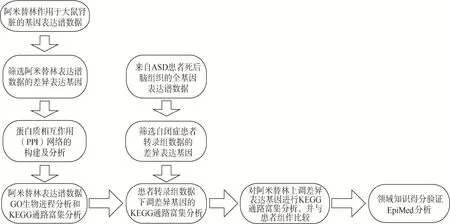
图1 分析流程图
1.2 实验设计
根据阿米替林的作用部位、作用时间及药物剂量,将筛选后的数据分为3 组(表1)。以正常大鼠肾脏为对照组,阿米替林处理的大鼠肾脏为实验组,分析基因表达丰度的差异。阿米替林作用部位、作用时间及药物剂量皆为GSE59927 数据集中的原始信息,考虑药物在不同细胞系、剂量和时间的不同效果,去除3 组差异基因中调控作用相同的非交集基因,将得到的结果用于后续分析。
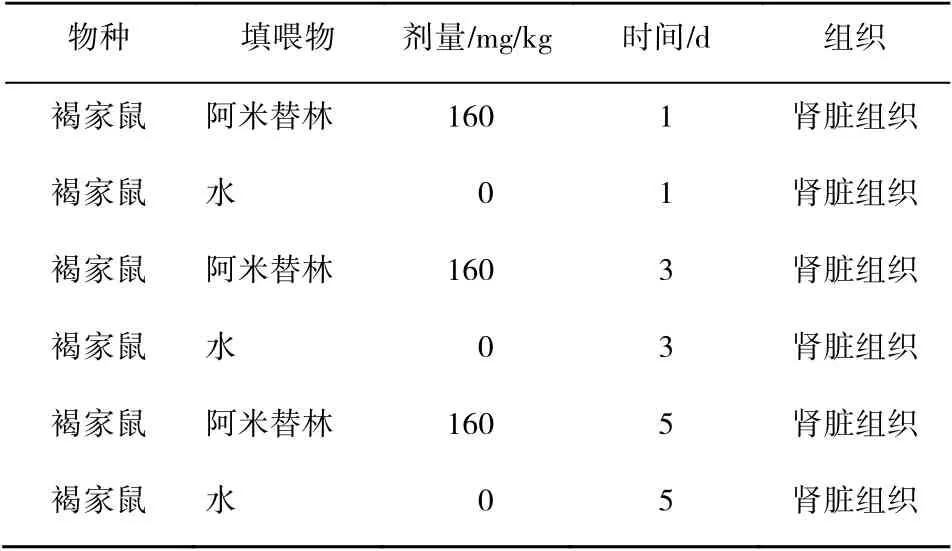
表1 数据具体样本基本描述
1.3 方法
在Bioconductor 网站(http://www.bioconductor.org/)下载R 语言程序包,用于数据处理和差异分析[6]。首先使用Impute 包估算矩阵中的缺失值[7],然后使用biomaRt 包将基因转化为同源[8],再使用limma 程序包规范数据,筛选差异基因[9],使用R 语言clusterprofiler 程序包对差异基因进行基因本体分析与通路富集分析,分析其中的Gene ontology(GO)生物进程和Kyoto Encyclopedia of Genes and Genomes(KEGG)通路富集结果,以FDR<0.05 表示具有显著性,聚类结果将使用R语言进行可视化展示。使用Venny2.1 在线工具(https://bioinfogp.cnb.csic.es/tools/venny/)[10]去除3组具有相同调控功能的非交集基因,通过R 语言程序获得3 组具有不同调控效果的基因的平均表达量。
把差异基因上传至在线分析网站 STRING v11.0(https://string-db.org/),进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析[11]。PPI 网络可用于确定阿米替林调控的重要基因编码的蛋白质之间的相互作用和通路关系。关键基因是指PPI 网络中具有高度相关性的基因。核心节点是具有重要生物功能的蛋白质,通过计算蛋白质之间的连接数量及每个节点是否与特定节点直接连接来确定。文中关键基因为在PPI 网络关系中出现频次最高的前10 个基因,使用Cytoscape 软件中的CytoHubba 插件筛选核心节点,通过Degree 算法计算出关键基因,计算出前10 个基因。
本文采用领域知识得分方法,在中英文数据库中对阿米替林作用靶点的有效性进行文本验证。将8个关键基因作为关键靶点,以“‘关键靶点’AND‘autism’”为检索词,在PubMed 中进行检索;以“‘关键靶点’AND‘自闭症谱系障碍’”为检索词在CNKI 中进行检索,记录相关检索结果并计算其累计得分值。
2 结果与分析
2.1 差异基因表达分析
将3 组阿米替林数据利用limma 程序包进行差异分析,以|log2Fc|>2,FDR<0.05 为阈值,共得到3 组差异结果,差异基因的个数分别为第一组411 个(图2-a)、第二组852 个(图2-b)、第三组907 个(图2-c),其中上调表达的差异基因个数分别为226 个、481 个、508 个,下调表达的差异基因个数分别为185 个、371 个、399 个。在上述差异基因基础上,使用Venny2.1工具和R 语言脚本,汇总3 组差异基因结果,去除非交集基因后,共得到差异基因331 个,其中上调179 个、下调152 个。
再随机抽取数据集 GSE28521 的部分数据进行差异基因筛选,差异基因筛选设定阈值为log2(Fold change)>0.5,P<0.01,共筛选出差异基因393 个,其中上调165 个、下调228个(图2-d)。

图2 阿米替林与ASD 差异基因筛选结果
2.2 蛋白质相互作用调控网络的构建
将阿米替林差异表达基因导入STRING v11.0在线分析网站进行蛋白质相互作用网络分析,图3为该差异基因的蛋白质相互作用调控网络(PPI),图中红色表示上调差异表达基因,绿色表示下调差异表达基因,共得到241 个蛋白,530 条相互关系,平均点度为4.4,蛋白质之间具有较强的相互关联性。
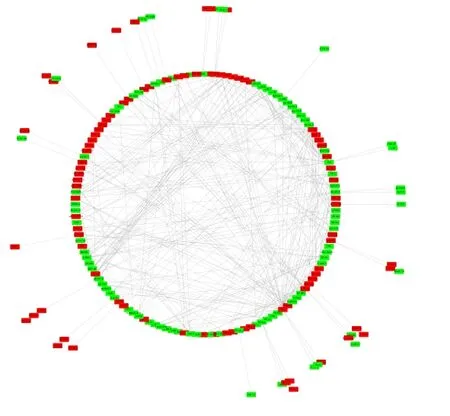
图3 差异表达基因蛋白质相互作用网络结果
利用Degree 插件根据蛋白质相互作用网络的拓扑结构计算出PPI 网络中节点的得分,其中,IL6(35 分)、SRC(33 分)、CYCS(24 分)、CD44(19 分)、TLR4(17 分)、GRM1(17 分)、SNAP25(16 分)、CCR2(15 分)、RYR1(12 分)、TFRC(12 分)等10 个关键基因在PPI 网络中占据重要地位。
2.3 阿米替林与ASD 的富集分析
2.3.1 阿米替林的差异基因富集分析
使用R 语言程序clusterprofiler 包对PPI 网络中的基因进行GO 功能富集和KEGG 通路富集分析[12]。GO 富集分析共得到319 条结果,其中包括生物学过程(biological process,BP)213 条、细胞组分(cellular components,CC)48 条、分子功能(molecular function,MF)58 条。在生物学过程方面,富集的反应大多与蛋白质磷酸化、炎症反应、免疫反应、信号转导有关,如BMP2K、CCL2、GRK1、CD40、CXCL8、TNF、IL1B 等。在细胞组分方面,富集的反应大多影响细胞膜的功能,如AP2B1、SYNJ2、HMOX1、ACP2 等。在分子功能方面,富集的反应大多与免疫反应、蛋白结合、蛋白激酶的活性有关,如BRAP、CD44、HOPX、AP2B1、SF1、EHD1、TGFB1 等。KEGG 通路富集结果中,331个显著性基因多富集在氧化磷酸化反应、代谢反应、神经受体相互作用、MAPK 信号通路、Hippo信号通路、碳代谢等通路。
2.3.2 阿米替林与ASD 共同富集分析
使用clusterProfiler 程序包分别对阿米替林上调表达差异基因和ASD 下调表达差异基因进行KEGG 通路富集分析,并借助R 语言对聚类结果进行可视化处理,图4 是二者共同富集通路的部分结果,其中图4-a 为阿米替林上调差异基因的KEGG通路富集分析,图4-b 为ASD 下调差异基因的KEGG 通路富集分析。对比两图可知,阿米替林上调差异基因与ASD 下调差异基因所共同富集到的通路有“Oxidative phosphorylation”“GABAergic synapse”“Glycolysis/Gluconeogenesis”“Vascular smooth muscle contraction”等。
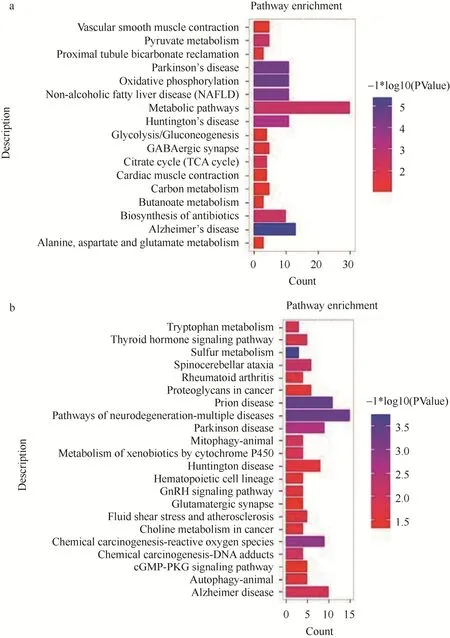
图4 KEGG 通路富集分析部分结果
阿米替林与ASD 共同富集到的信号通路如图5所示,可以看到阿米替林药物上调差异基因和ASD患者下调差异基因分别在氧化磷酸化通路、γ-氨基丁酸能突触通路、糖酵解糖异生通路和血管平滑肌收缩通路的富集。由此可见,阿米替林与ASD 具有共同的生物信息学基础,因而具有较好的关联性。

图5 阿米替林与ASD 共同富集通路展示
2.4 “ASD-阿米替林”关联的文本验证及预测
2.4.1 基于领域知识得分的“ASD-阿米替林”文本验证
为了验证阿米替林相关作用靶点的有效性,本文采用领域知识得分方法对关键靶点在中英文数据库中的案例进行整理,并对其数量进行累计求和。选取了PPI 网络中的8 个关键靶点,包括CCR2、SNAP25、GRM1、TLR4、CD44、SRC、IL6、RYR1,分别在CNKI 和PubMed 中检索ASD 与上述靶点作用相关的已有文献,领域知识得分统计结果中除靶点SNAP25 得分为3 分外,其余靶点得分均为1 分。
文本检索结果显示,关键靶点CCR2[13]主要参与调节体内T 细胞炎性细胞因子的表达和T 细胞分化,在炎症过程中促进T 细胞分化为Th17,并通过JAK-STAT 通路调节FOXO1 活性,在介导周围神经损伤引起的神经病理性疼痛中起着重要作用;靶点SNAP25[14-16]主要位于囊泡和质膜中,参与神经递质释放的分子调节,这与智力低下和先天性肌无力综合征有关;靶点GRM1[17]参与谷氨酸在中枢神经系统中的中枢作用,如海马体的长期增强和小脑的长期抑制,该基因可能与许多疾病有关,包括精神分裂症、双向情感障碍、抑郁症和乳腺癌;靶点TLR4[18]通常作为水解酶或受体,主要参与免疫反应和炎症反应;靶点CD44[19]参与多种细胞功能,包括T 淋巴细胞刺激、循环、造血、炎症和对细菌感染的反应;靶点IL6[20]在免疫、组织再生和代谢方面具有多种生物学功能。
2.4.2 基于EpiMed 平台的“ASD-阿米替林”关联预测
表观精准治疗预测平台EpiMed 是研究团队在近20 年的临床生物信息学研究过程中,基于系统生物学和以比较功能基因组学理论为基础的逻辑组学算法而建立的,它包含有疾病转录组数据和临床常用药物、中药和多种化合物的功能基因组学数据。平台可自动匹配差异基因,从而筛选出所需关联的药物与疾病[21]。
本文借助EpiMed 平台对疾病与药物进行关联分析,将筛选出的差异基因导入平台后,平台利用自动匹配功能,依据基因名、logFC 及FDR 值匹配与差异基因相关联(正负相关)的疾病或药物。以关联系数<-0.1,FDR<0.05 作为阈值,经过计算得出与阿米替林呈负相关的疾病,即阿米替林对该疾病具有治疗作用,预测结果见表2。

表2 与阿米替林负相关的疾病(部分结果)
根据2020 版《精神障碍诊疗规范》[28]:阿米替林作为一种三环类抗抑郁药,常与其他药物联用于治疗抑郁症、创伤后应激障碍等精神卫生类疾病。在Drugbank 数据库进行检索得知,阿米替林的适应证有成人重度抑郁症、成人神经病理性疼痛、成人慢性紧张型头痛、成人偏头痛的预防性治疗、肠易激综合征、睡眠障碍、糖尿病精神病变、激动、纤维肌痛和失眠等。表3 中阿米替林与疾病关联实验的检索结果显示,阿米替林可能对精神分裂症、高血压、哮喘等起到治疗作用,有实验证明确有疗效[23-28],故本文认为EpiMed 平台的预测结果具有一定的科学性和准确性。因此,表3 中阿米替林对特发性肺纤维化、亨廷顿病、神经纤维瘤病等疾病的潜在治疗效果也值得关注。
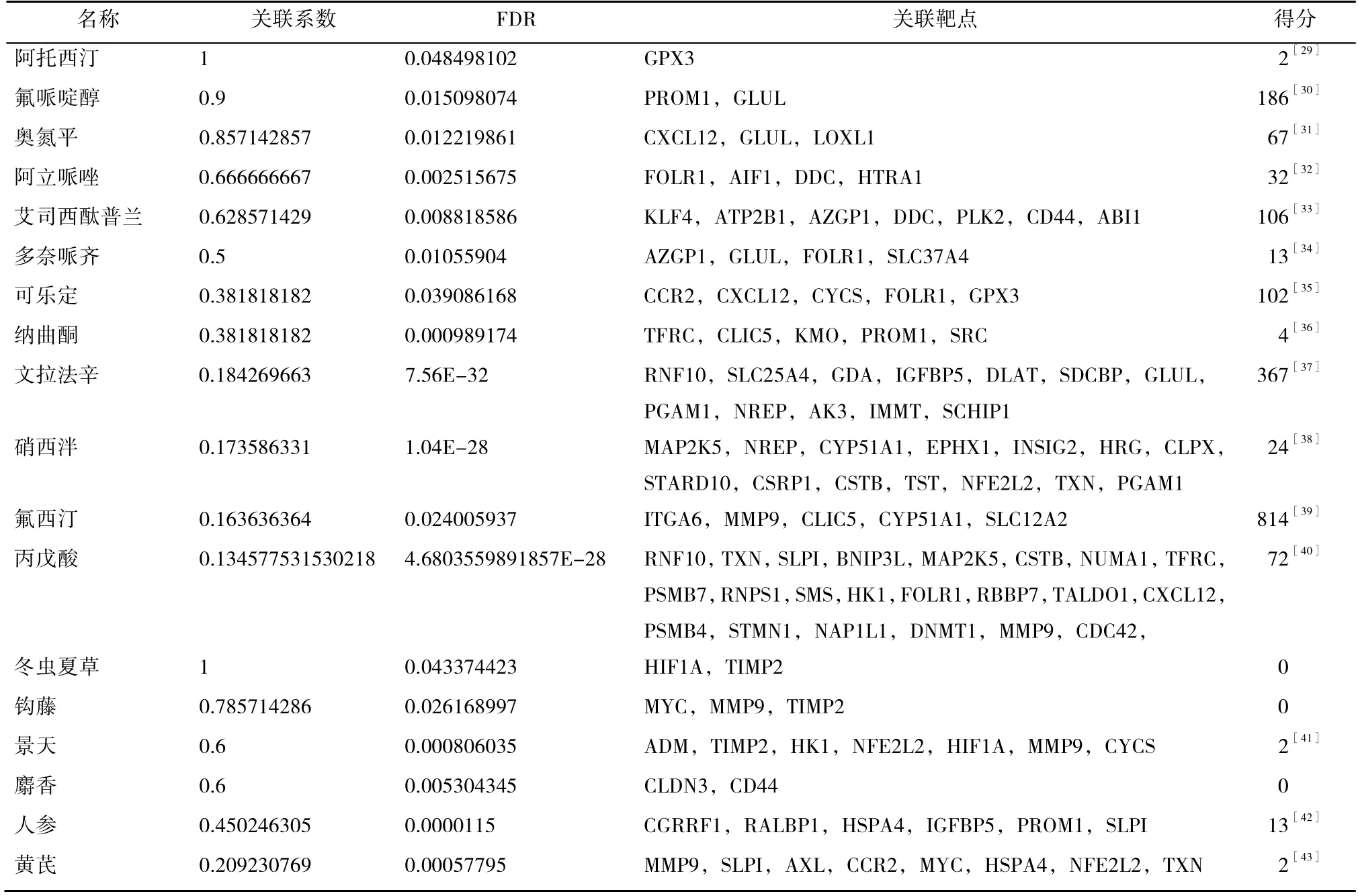
表3 与阿米替林正相关的药物(部分结果)
通过EpiMed 平台自动匹配功能可得与阿米替林正相关的药物,其中氟哌啶醇、奥氮平、阿立哌唑、艾司西酞普兰、可乐定、文拉法辛等西药,以及人参、黄芪等中药已被实验证明[29-43]与阿米替林联用针对精神障碍类疾病所取得的疗效均优于单独使用其中任何一种药物,说明这些药物与阿米替林确实呈正相关关系。
Goodwin Guy M 通过临床证明,在使用来曲唑时需要谨慎[44],尤其是针对有产后情感障碍或双向情感障碍的女性,使用不当(在患者联合使用处方阿米替林期间)可能会导致患者体内雌激素水平急剧下降。结合表4 中EpiMed 平台计算结果,同样呈现出负相关的药物如链唑霉素、白头翁、细辛等也被证明与阿米替林联用具有削弱药物疗效的结果,需要临床进一步研究验证。

表4 与阿米替林负相关的药物(部分结果)
3 讨论
3.1 关键靶点分析
本文以阿米替林的基因表达谱数据为研究对象,对GEO 中阿米替林相关数据集进行分析,发现阿米替林对ASD 的治疗作用是一个多靶点组学网络调控,通过PPI 网络分析发现,关键的基因如CCR2、SNAP25、GRM1、TLR4、CD44、CYCS、SRC、IL6 等,与以往研究结果一致[13-20],这些基因主要参与跨膜信号转导、炎症反应、释放神经递质、蛋白质磷酸化、免疫反应、蛋白质受体编码、调控细胞周期等过程。有研究发现,CCR2 在神经系统中主要表达于大脑皮质、海马、黑质、苍白球、脑室旁丘脑、下丘脑视上核和小脑[45],由此参与跨膜信号的转导过程。有学者认为,SNAP25 在神经元和内分泌细胞高度表达,并分布在多个区域,如哺乳动物大脑皮层、中脑、丘脑、海马和基底节,其中SNAP25 在大脑皮层、海马和基底节的表达与精神分裂症有关,SNAP25 分布于中枢神经系统神经元的轴突和突触终末,在轴突生长和突触可塑性中起到重要作用[46],因此认为SNAP25 在神经递质的释放和轴突生长过程中起着重要作用。还有学者认为,白细胞介素6(IL-6)参与的自身免疫反应作用于中枢神经细胞,可导致脑功能障碍,并可改善额叶、海马等脑区的多巴胺和5-羟色胺的活性[47],因此它与精神分裂症的发病机制密切相关。此外,在促炎性细胞因子中,IL-6 在中枢神经系统的发育和功能中起着重要作用。
3.2 富集分析
在GO 富集分析结果中,阿米替林在生物学过程中主要参与蛋白质磷酸化、免疫反应、炎症反应、细胞凋亡过程的负调控,正向调节GTP 酶活性及RNA 聚合酶启动子的转录;在分子功能方面,阿米替林主要与多种转录因子活性、蛋白的特异性结合、锌离子结合等功能相关;在细胞组分方面,阿米替林主要影响跨膜转运复合物、细胞质膜、胞浆、等离子膜等多种膜的构成。
在KEGG 通路富集方面,阿米替林主要作用于神经受体间的相互作用、碳代谢、机体蛋白质的氧化磷酸化反应,还参与MAPK 信号通路和Hippo信号通路。有学者认为MAPK 通路是调节包括神经发育在内的多种生理过程所必需的细胞内信号通路[48],MAPK 通路的干扰会导致神经发育障碍,包括ASD,因此阿米替林在体内的作用通路与ASD具有关联性。另有学者通过实验发现阿米替林可显著降低脊髓神经结扎产生的促炎细胞因子的蛋白水平[49],而Hippo 信号通路在氧化应激(脑卒中、阿尔茨海默病、肌萎缩性侧索硬化及帕金森等疾病均与氧化应激密切相关)介导的神经细胞中起到重要作用,并且Hippo 信号通路除重要组分NF2 参与调控神经前体细胞NPC 的数目和胼胝体的发育外,Hippo 信号通路还参与神经发育的主要过程[50],而阿米替林也会作用于此信号通路,因此阿米替林在治疗神经系统失调所导致的发育障碍(包括ASD)方面所发挥的作用不容小觑。
4 结语
本文采用生物信息学方法对阿米替林基因表达谱数据进行蛋白质相互作用网络分析、基因本体学(GO)富集分析和京都基因与基因组百科全书(KEGG)富集分析等,并借助领域知识得分法和EpiMed 进行文本验证和预测,探讨阿米替林是否对ASD 具有潜在治疗作用。在疾病关联分析方面,发现阿米替林与ASD、精神分裂症、高血压、哮喘、肝炎等疾病呈负相关,说明阿米替林对这些疾病具有潜在治疗作用;在药物关联分析方面,发现氟西汀、文拉法辛、米氮平、艾司西酞普兰、可乐定、氟哌啶醇等西药,冬虫夏草、钩藤、景天、麝香、黄芪等中药与阿米替林呈正相关,说明这些药物与阿米替林可能具有潜在协同作用;发现氯尼达明、链唑霉素、来曲唑等西药,白头翁、皂刺、细辛等中药与阿米替林呈负相关,说明这些药物与阿米替林可能具有潜在拮抗作用。总之,阿米替林对ASD 具有潜在治疗作用,建议科研人员关注阿米替林在治疗ASD 中的应用,并可尝试与其他相关药物进行联用,以求得最佳治疗效果。

