ICP-MS 法测定注射用头孢美唑钠中31 种元素杂质的含量*
耿 悦,宋芸峰,沈 杰,张锦琳,袁耀佐**
1 江苏省食品药品监督检验研究院,南京 210019;2 国家局化学药物杂质谱研究重点实验室,南京 210019;3 南京中医药大学,南京 210023;4 上海华测艾普医学检验所有限公司,上海 200040;5 安捷伦科技有限公司,上海 200080
元素杂质可能催化药物活性成分的降解,从而影响药效及效期,一些特定元素杂质的固有毒性也有可能带来安全风险[1]。药品中的元素杂质是企业、监管部门及消费者都很关注的问题。近年来,各国药品监管部门以及药典规范都对元素杂质的控制要求愈加严格[2,3]。现在一般要求定量测定药品各生产阶段所涉及物料与中间体元素杂质的情况,即对药品生产过程中的水、辅料、原药和所有合成中间体的元素杂质进行控制和监测[4]。人用药品注册技术要求国际协调会议(ICH)“Q3D 元素杂质指南”[5]基于风险管控的原则,将药品中存在风险的24 种元素杂质分为4 类(1 类、2A 类、2B 类、3 类),并针对口服、注射和吸入制剂等不同剂型规定不同的限值(元素杂质每日最大允许摄入量,PDE)。《化学药品注射剂仿制药质量和疗效一致性评价技术要求》[6]关于元素杂质提到,“根据ICH Q3D 的规定,通过科学和基于风险的评估来确定制剂中元素杂质的控制策略,包括原辅包、生产设备等可能引入的元素杂质”。USP<233>[7]也提出了元素杂质方法学验证的一般要求。
为加强对上市后药品质量的监管,国家药品监督管理局将注射用头孢美唑钠列入2021 年度国家药品评价性抽验计划。注射用头孢美唑为注射用无菌粉末,包装为钠钙玻璃模制注射剂瓶或低硼硅玻璃管制注射剂瓶及胶塞。在玻璃包装材料中,一些金属离子或阳离子团均有可能从玻璃中迁移到药物中,过量迁移会影响药物质量,故《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行稿)》[8](以下简称玻璃指导原则)要求“结合特定玻璃容器的组分以及添加物质的信息,对所含有的离子进行定量检查并进行安全性评估”。对于元素杂质的检测,常用的方法有重金属法、原子吸收光谱法、电感耦合等离子体发射光谱法、电感耦合等离子体质谱法等。头孢美唑为注射剂,安全性要求更为严格,需建立更灵敏、准确的分析方法来监测元素杂质的水平。
本研究主要参考“ICH Q3D 元素杂质指南”及玻璃指导原则。ICP-MS 可以同时分析多种元素,且线性范围宽,分析能力强,速度快,灵敏度高[9],本试验建立了ICP-MS 法测定注射用头孢美唑钠中可能存在的31 种元素杂质含量。目前对于注射用头孢美唑钠元素杂质的检测鲜有报道,对于涵盖ICH Q3D 中24 种元素、玻璃指导原则中的元素及其他值得关注元素的检测更是未见报道。本试验通过对国评样品的元素杂质迁移情况开展筛查,既可掌握注射用头孢美唑钠质量整体水平,又能为监管部门对上市后药品再评价提供技术储备和数据支持。
1 仪器、试剂与标准物质
Agilent ICP-MS 8900 电感耦合等离子体质谱仪及Masshunter 数据处理软件(美国安捷伦公司);XS205 电子天平(瑞士梅特勒托利多公司)。硝酸(德国默克公司);水为纯净水。
ICH/USP 232 Class1&2 Parenteral Elements(批号0010673282)、ICH/USP 232 Parenteral Combined-1(批号0011048112)、ICH/USP 232 Parenteral Combined-2(批号0011075532)、Pharma Internal Standard 1(批号0107721219)均由安捷伦公司提供。B 标准液(唯一标识码20C042-1)、Al 标准液(唯一标识码20A041-3)、Ti 标准液(唯一标识码20A022)、Fe 标准液(唯一标识码20C001-5)、Zn(标准液(唯一标识码20C019-3)、Mn 标准液(唯一标识码20B021-4)、Si 标准液(唯一标识码20C009)均由国家有色金属及电子材料分析测试中心提供,浓度均为1000 μg·mL-1。
样品为2021 年国家评价性抽验样品,来源于全国28 个省(直辖市、自治区)的20 家生产企业、经营单位以及使用单位,共177 批次。每个单位随机抽取1 批(分别编号为单位1~20);一批原研样品(日本第一三共株式会社)。
2 方法与结果
2.1 ICP-MS 仪器条件
以高纯氩气为载气,高纯氦气为碰撞气,采用高基体(HMI)进样模式。RF 功率:1550 W;载气流量:1.01 L·min-1;氦气流量:4.5 mL·min-1;雾化气流量:0.67 L·min-1;蠕动泵转速:0.10 rps;雾化室温度:2℃;采样深度:10.0 mm;采样锥类型:Ni。分析模式:全定量,重复3 次,在线内标加入。
2.2 元素杂质限度的制定
参照“ICH Q3D”指导原则[5]和玻璃指导原则[8],注射剂中31 种元素的 每日最大允许摄入量(permitted daily exposure)PDE 值见表1。本研究参考“ICH Q3D 指南”中浓度转换方法2a,即特定每日摄入量的药品(注射用头孢美唑钠日最大剂量为4 g)中各组分元素杂质的通用允许浓度限度,计算各元素杂质的通用允许浓度(限度值)。根据各元素杂质的限度值,稀释合理倍数,得到稀释后溶液中的限度浓度(J)。因ICP-MS 测定大多数元素的线性动态范围在0.1~1000 ng·mL-1,故本研究中调整稀释倍数为250 倍,使溶液中各目标元素J 值在ICP-MS合适的线性动态范围内。各目标元素限度值及J 值见表1。
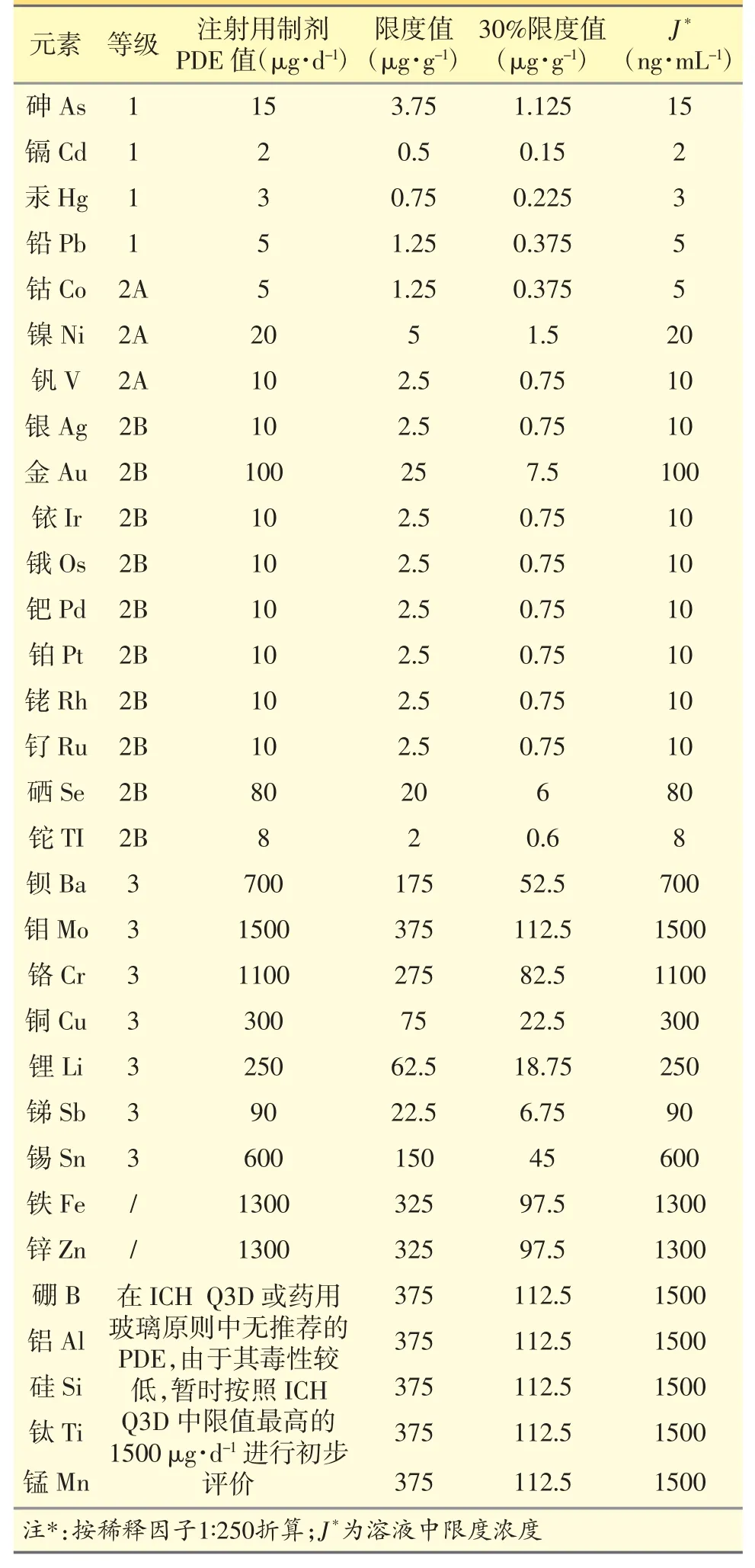
表1 元素PDE 值和J 值转换表
2.3 溶液制备
2.3.1 供试品溶液 取注射用头孢美唑钠,按照规格加水溶解转入20 mL 塑料量瓶中,摇匀,制成0.1 g·mL-1的样品储备液;取该液2 mL 于50 mL 塑料量瓶中,用0.2%硝酸溶液稀释至刻度,摇匀。
2.3.2 标准曲线溶液 分别按各元素限度浓度的0~300%作线性范围,设计6 个浓度点为0、0.25、0.5、1.0、2.0、3.0 J,考察各元素线性关系,以0.2%硝酸溶液为稀释剂及空白溶液。线性溶液浓度见表2。

表2 线性溶液浓度
2.3.3 内标溶液 精密量取5 mL Pharma Internal Standard 1 到50 mL 容量瓶中,用0.2%硝酸溶液稀释至刻度,摇匀。内标溶液中Bi、Ge 和In 浓度为500 μg·L-1,Sc 为1000 μg·L-1,元素7Li、11B、27Al、30Si、47Ti、51V、52Cr、55Mn、56Fe 以45Sc 为内标,元素59Co、60Ni、63Cu、66Zn、75As、78Se 以72Ge 为内标,元素95Mo、101Ru、103Rh、105Pd、107Ag、114Cd、118Sn、121Sb、138Ba 以115In为内标,元素189Os、193Ir、195Pt、197Au、201Hg、205Tl、206Pb 以209Bi 为内标。
2.4 方法学考察
2.4.1 方法的专属性 由于《中国药典》2020 版暂未对元素杂质方法验证有细致要求,本次试验参考USP <233 >方法学验证要求完成。其分析方法应能明确检测每种元素杂质,共存的其他成分(包括其他元素杂质、基质成分)不干扰检测[7]。本方法选择的待测同位素见“2.3.3”项下,待测元素均有各自的m/z,不互相干扰检测;空白溶液中31 个待测元素的m/z 位置强度值均较低,小于标准曲线溶液3(1.0 J)响应值的10%,空白溶液干扰小;样品溶解加标与标准曲线溶液3(1.0 J)对比的方法表明,基质干扰在10%以内,无较强干扰,满足专属性要求。
2.4.2 线性关系考察 取“2.3.2” 项下标准曲线溶液和“2.3.3”项下内标溶液进样,以元素强度与内标强度比值(Y)为纵坐标,质量浓度(X)为横坐标,进行线性回归,结果见表3。31 种元素的线性关系良好。
2.4.3 检测限及定量限 取“2.3.2”项下的空白溶液,按“2.1”项下仪器条件连续进样测定11 次,计算各元素浓度的标准偏差。以3 倍标准偏差所对应的浓度值作为检测下限,10 倍标准偏差所对应的浓度值作为定量限,结果见表3。
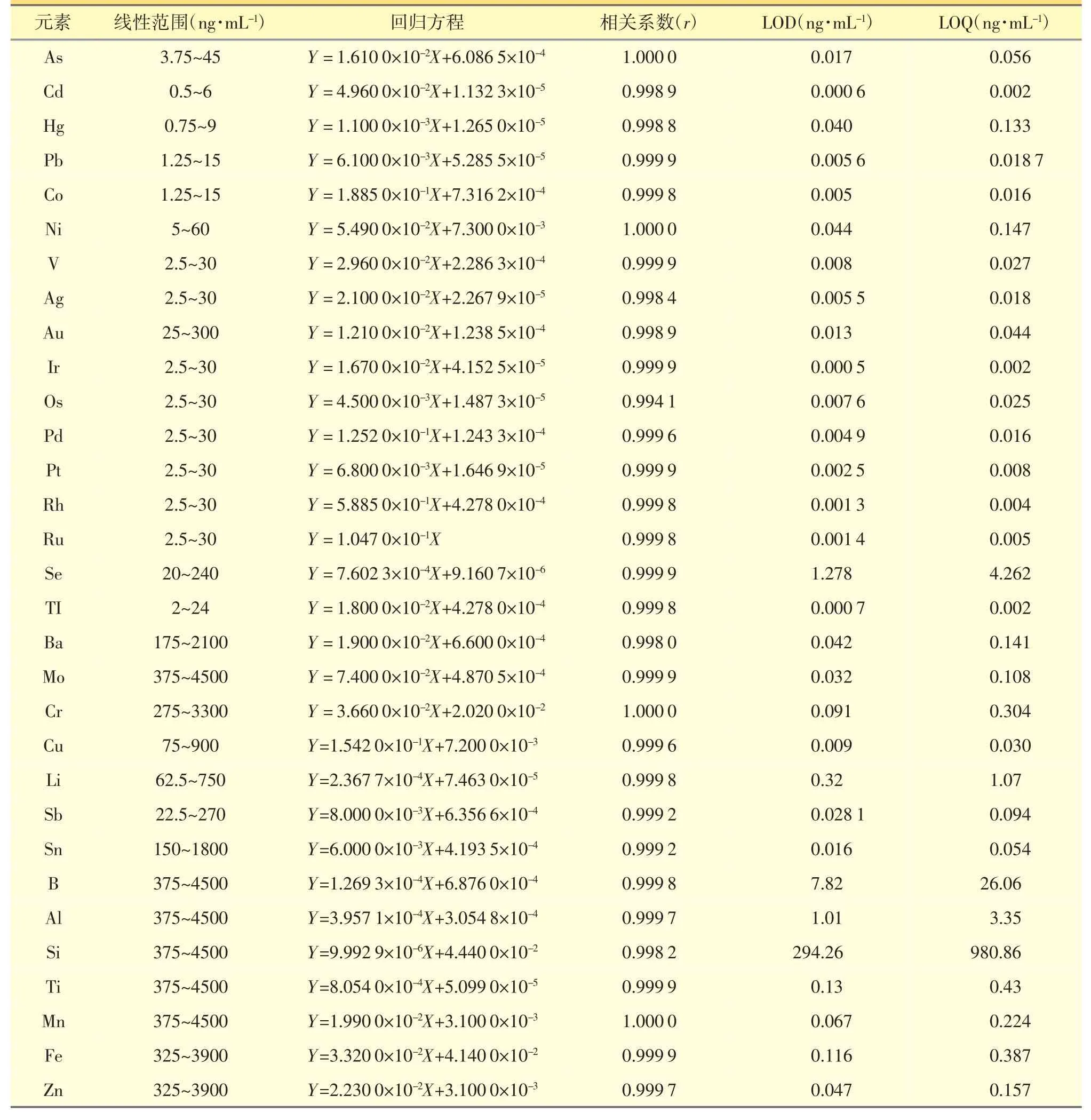
表3 回归方程、线性范围、检测限及定量限
2.4.4 回收率试验 按照“2.3.1”项方法制备样品储备液,精密量取该储备液2 mL 于50 mL 塑料量瓶之中(n=9),分别精密加入各测定元素相应的储备液适量,配制成含各测定元素0.5、1.0、1.5 J 的溶液,每个浓度平行制备3 份。以回收率溶液中待测元素响应值和内标元素响应值的比值,扣除试剂空白后,以线性回归方程算得各待测元素的含量,采用Masshunter 软件计算回收率,验证方法准确度。结果见表4,表明本方法回收率良好。
2.4.5 重复性试验 按照“2.3.1”项方法平行制备6份供试品溶液,按“2.1”项下仪器条件测定,仪器自动扣除空白,分别计算样品中各元素的含量,根据测得值计算6 份数据的RSD 值,且31 种元素的RSD 值均<20%,结果表明仪器重复性良好,结果见表4。
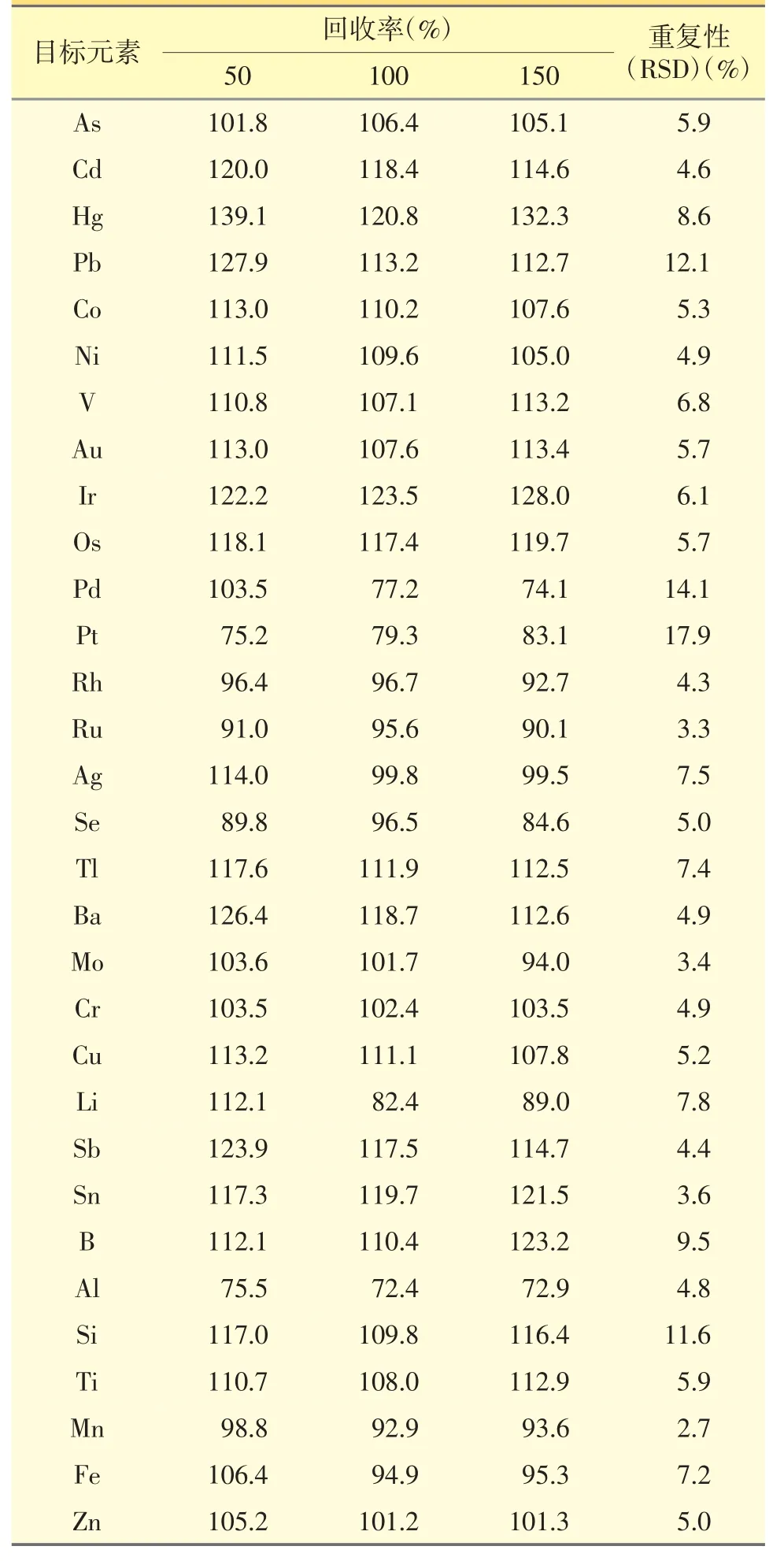
表4 加样回收率和重复性结果(n=6)
2.4.6 样品测定结果 从本次国评抽验的20 家企业的样品中各随机抽取1 批,加一批原研企业的样品,按“2.3.1”项下制备供试品溶液,按“2.1”项下仪器条件测定,仪器自动扣除空白,分别计算样品中各元素的含量。国产制剂和原研制剂中Cd、Hg、V、Ag、Ir、OS、Rh、Se、Tl、Mo、Li、Sb、Sn、B、Si,15 种元素含量均低于检测限;As、Co、Ru、Al 4 种元素含量均低于定量限;个别企业检出了极微量的Pb、Pt、Cr、Cu、Zn、Ti、Mn;大部分企业检出了微量的Ni、Au、Pd、Ba 和Fe。其中,Ni 元素检出量为0.0486~0.1261 μg·g-1,Au 元素检出量为0.279~2.497 μg·g-1,Pd 元素检出量 为0.006~0.065 μg·g-1,Ba 元素检 出量为0.069~1.131 μg·g-1,Fe 元素检出量0.268~1.173 μg·g-1。总之,注射用头孢美唑钠中的元素杂质含量远小于限度的30%。国产制剂与原研制剂元素杂质含量无显著差异,国产制剂在元素杂质方面质量可控。
3 讨论
3.1 供试品溶液制备方法的选择
元素分析时样品常需要进行一些溶剂化处理后才能进行分析。微波消解是一种常用的元素分析前处理方法,可以处理一些基质较为复杂的样品;但对于溶解性好、成分简单的物质而言以直接溶解法操作简单,处理步骤较少,相比其他方法不容易引入污染。本品种属于原料药直接灌装的注射剂,选择了直接溶解法,此法能够满足测定需要。
3.2 仪器测定模式的选择
在ICP-MS 测定过程中,内标的应用具有重要作用,选择合适的内标,不仅可以避免电离效应与基质效应的影响,还对结果有校正作用,能提高分析结果的准确性[10]。同时使用He 碰撞反应池技术可有效消除仪器多原子质谱干扰。本次抽验产品钠含量为5%,测定时仪器样品锥容易积盐影响内标的回收率,降低灵敏度,影响测定准确度。在试验中打开仪器的稀释气即高基体样品引入系统对其进行在线稀释,有利于含盐量较高样品的分析。
3.3 稀释溶剂的选择
注射用头孢美唑钠在水中溶解性好,在酸中的溶解度不佳,而大部分元素在稀酸溶液中较为稳定。尝试不同浓度的硝酸、盐酸及硝酸与盐酸混合溶液,在供试药品溶解性和元素杂质稳定性中寻求平衡,最终确定了0.2%硝酸作为溶剂。
3.4 元素的选择
“ICH Q3D 元素杂质指南”[5]对药品中存在风险的24 种元素杂质PDE 有明确规定(见表1)。玻璃指导原则要求测定迁移入注射剂药液的常见元素,包括Si、Na、B、Al、Ti、Mn、Fe、Zn。《化学药品与弹性体密封件相容性研究技术指导原则》[11]还要求关注S 元素。
由于头孢美唑分子中含有硫元素且为钠盐,所以本次迁移试验未能测定Na 与S 元素。
本试验测定了注射用头孢美唑钠中的31 种具有潜在风险的元素杂质的含量。供试品为国家评价性抽验样品,其原辅包来源和生产设备均不尽相同,故本研究开展迁移试验,测定所有来源元素杂质总量,结果表明,国产注射用头孢美唑钠元素杂质质量可控。
3.5 ICP-MS 法的优缺点
当元素杂质测定时,常采用原子吸收光谱法、ICP-MS 法、ICP-OES 法。原子吸收光谱法具有灵敏度好、准确性高、检测限低和精密度好等优点;但每次只能测1 个元素,应用于多批次样品的多种元素测定时费时耗力。ICP-OES 法可同时测定许多元素;但检测灵敏度不如ICP-MS 高。ICP-MS 法以其线性范围宽、精密度高、准确性好和检测限低等优点被广泛应用;但ICP-MS 仪器价格比较昂贵,而且维护成本也很高,并且由于ICP-MS 的检测限低、灵敏度高,对所用纯化水和酸的质量要求较高。
4 小结
本研究采用ICP-MS 法测定了注射用头孢美唑钠中31 种具有潜在风险元素杂质的含量,操作简单,通过方法学验证了其科学性与可靠性,证明方法灵敏度高,专属性强,重复性好,可用于其他相似药品元素杂质的含量测定。因检测样品覆盖面较广,测定结果好,给生产企业和监管部门对注射用头孢美唑钠元素杂质的风险评定提供数据支持及技术依据。