植物乳杆菌微胶囊的制备及其效果评价
郭春燕,姚 琨,聂存喜,纪守坤,严 慧,李胜利*,张文举*
(1.晋中职业技术学院生物工程系,山西榆次 030600;2.中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京市生鲜乳质量安全工程技术研究中心,北京 100193;3.石河子大学动物科技学院,新疆石河子 832003;4.河北农业大学动物科技学院,河北保定 071000)
植物乳杆菌是乳酸菌的一种,外形呈圆短直杆菌,属于革兰氏阳性厌氧菌。研究表明,植物乳杆菌可促进营养物质吸收[1]、具有一定的免疫调节作用[2-3]、对致病菌有抑制作用[4-5]、缓解乳糖不耐症[6]、抑制肿瘤细胞的形成[7-8]等益生功能。植物乳杆菌对肠道微生物亦有着重要的影响[9-10],主要通过活菌的积极生命活动到达肠道来调节菌群平衡的,但益生菌产品的相关宣传鲜少提及其通过消化道进而在肠道定植成功的报道。因其执行功能时必须耐受胃酸、胆盐、消化酶等的不利因素[11-12],对于反刍动物来说,还需要克服瘤胃微生物的分解作用,而益生菌微胶囊被视为解决这一问题的有效技术。
本试验以植物乳杆菌JCM-1149 为囊芯物,采用丙烯酸树脂和海藻酸钠对植物乳杆菌进行双层包被,分别对抗瘤胃微生物的降解和真胃胃酸的破坏[13-14],促使更多菌体到达肠道靶向释放;同时采用造瘘术(体内验证法)对植物乳杆菌微囊化效果进行综合评价,以期为益生菌在奶牛生产的科学应用提供理论指导。
1 材料与方法
1.1 试验材料 植物乳杆菌为中国农业大学农学院微生物实验室保藏的日系菌株JCM-1149,分离自泡菜;海藻酸钠为国药集团化学试剂有限公司产品;聚丙烯酸树脂为连云港康力特药业有限公司产品;微晶纤维素空白丸芯(直径850~1 000 μm)为杭州高成生物营养技术有限公司产品;多用途流化床试验机(WBF-1G,重庆英格造粒包衣技术有限公司)。
1.2 植物乳杆菌菌粉及胶囊制备
1.2.1 植物乳杆菌菌粉的制备 ①菌种的活化:将甘油管保存的植物乳杆菌JCM-1149 菌液添加到100 mL 三角瓶中,在34℃恒温培养箱中静置培养24 h;将培养好的菌液按2%的比例添加到500 mL 的摇瓶当中,34℃静置培养16 h。②扩大培养:将上述摇瓶培养好的菌液倒入到200 L 发酵罐中进行发酵培养。③收集菌泥:对发酵液进行离心处理,采用筒式离心机16 000 r/min,离心10 min,保留沉淀;对上清液再次离心,重复3 次,最后收集菌泥。④添加保护剂:用20% 脱脂奶粉作为保护剂,添加量为1~3 倍菌泥的重量。⑤冷冻干燥:先-20℃预冻4 h,再-80℃冷冻8 h,最后上冷冻干燥机抽真空制成菌粉。
1.2.2 植物乳杆菌微胶囊的制备 步骤①、②同1.2.1;③收集菌泥:对发酵液进行离心处理,采用筒式离心机16 000 r/min,离心10 min,收集菌泥。④制备菌泥混合液:取上述加工好的菌泥加入20% 脱脂奶粉水溶液(菌泥:20%脱脂奶粉溶液=1:3),充分混匀,即得加入保护剂的菌泥混合液。⑤制粒:以微晶纤维素空白丸芯(MCC)和海藻酸钠充分混匀作为起膜芯粒;再加入上述菌泥混合液,最后上流化床进行制粒。⑥包衣液的制备(海藻酸钠和丙烯酸树脂双层包被):一次包衣液的制备:配制含1.5%~2%的海藻酸钠水溶液,所用溶剂为灭菌蒸馏水;二次包衣液的制备:配制含10~12%的丙烯酸树脂水溶液,所用溶剂为灭菌蒸馏水。⑦流化床包衣:一次包衣采用顶喷包衣,包衣液为1.5%海藻酸钠溶液,制粒后的颗粒用1.5%海藻酸钠进行包被。制粒颗粒在包衣前先在流化床干燥10 min,设置流化床试验机的进风量38~45 m3/h、流速12~18 r/min、雾化压力1.2 kg/cm3、物料温度(31±1)℃以及进风温度75℃,整个包衣过程约耗时1~1.5 h。二次包衣:一次包衣结束后进行二次顶喷包衣。一次包衣后的颗粒用12%丙烯酸树脂进行包被。设置流化床试验机的进风量55 m3/h、流速16 r/min、雾化压力1.2 kg/cm3、物料温度(31±1)℃以及进风温度75℃,此次包衣过程约耗时10~15 min。
1.3 体外评价 配置人工胃液和肠液,进行体外抗逆性评价,参照中国药典进行配置[15]。
1.4 体内评价
1.4.1 试验动物及饲粮 在北京中地种畜良种奶牛科技园选取4 头体况良好,体重约590±12 kg,妊娠4~5 月龄的三胎荷斯坦奶牛,安装永久性瘤胃瘘管和十二指肠瘘管,用于瘤胃和十二指肠内容物的采集。瘘管牛每天09:00 和21:00 定时饲喂全混合日粮(Total Mixed Ration,TMR),自由采食,自由饮水,日粮组成及营养成分见表1。

表1 基础饲粮组成及营养水平
1.4.2 试验设计 试验采用单因素分期分组试验设计,共分3 期,每期正式期7 d,间隔期20 d。第1 期为空白对照组,不添加任何益生菌;第2 和3 期(试验组)分别在晨饲后1 h(10:00)打开瘤胃瘘管塞投喂植物乳杆菌菌粉和包被植物乳杆菌颗粒。试验组连续投喂7 d,每天投菌量80 g/ 头。每期试验最后3 d 连续采样,每天采样时间点均为晨饲后11 h(本课题组前期研究表明奶牛采食后11 h 各肠段活细菌比例较高)采集瘤胃液、十二指肠内容物以及直肠粪样。
1.4.3 样品采集 分别从安装的瘘管中采集瘤胃和十二指肠内容物各50 mL,粪便由直肠直接取样约5 g。采集的瘤胃液用4 层纱布过滤后,分装到无菌冻存管中;十二指肠和直肠样品直接分装于冻存管中。所有样品取样后立即投入液氮罐,用于样品DNA 的提取,并进行实时荧光定量PCR(Real-time Quantitative PCR,qPCR)以及16S rRNA 高通量测序检测。
1.5 测定指标及方法
1.5.1 产品活菌计数 植物乳杆菌菌粉计数采用平板菌落计数法[16]计数。植物乳杆菌微胶囊计数:精密称取1.000 g 包被植物乳杆菌颗粒,加入20 mL PBS 缓冲液(pH=7.4),再加入数粒玻璃珠于摇床上震荡,以190 r/min 破壁30 min,制备菌悬液进行平板稀释计数。
1.5.2 包埋率测定 ①微胶囊表面活菌数:精确称取1.000 g 植物乳杆菌微胶囊,加入20mL 0.9%的生理盐水,制备菌悬液后进行平板稀释计数。
② 微胶囊活菌数:同植物乳杆菌微胶囊计数方法。
③包埋率=(微胶囊活菌数-微胶囊表面活菌数)/微胶囊活菌数×100%
1.5.3 体外抗逆性评价 ①体外模拟胃液消化试验:分别精密称取1.000 g 植物乳杆菌和包被植物乳杆菌,加入20 mL 人工胃液(pH 分别为1、2 和3),于恒温震荡摇床34℃、90 r/min 培养2 h,采用平板菌落计数,计算活菌数。② 体外模拟肠道消化试验:分别精密称取1.000 g 植物乳杆菌和包被植物乳杆菌,加入20 mL人工肠液(胆盐浓度分别为0.1%、0.2% 和0.3%),于恒温震荡摇床34℃、120 r/min 培养2 h,采用平板菌落计数,计算活菌数。
1.5.4 目标菌种定量(qPCR) ①基因组DNA 的提取:DNA提取方法参照DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)试剂盒说明书进行操作。通过1%琼脂糖凝胶电泳测定DNA 完整性,并用生物分光光度计测定DNA 的浓度和纯度,-20℃保存备用。②引物设计:根据NCBI 已报道的植物乳杆菌JCM-1149 的全基因组序列,设计引物序列:上游引物:5'-CGCATAACA ACTTGGACCGC-3';下游引物:5'-TGTCTCAGTCCC AATGTGGC-3',产物大小为143 bp。引物由生工生物工程(上海)股份有限公司合成。
③实时定量荧光PCR 反应体系及程序:反应体系为15 µL:7.5 µL SYBR PremixExTaq、PCR上游和下游引物各0.3 µL(引物终浓度为0.2 µmol/L)、ROX Reference Dye 0.3 µL、DNA 模板1 µL,其余用灭菌蒸馏水补齐。反应参数:95℃预变性30 s;95℃变性5 s、60℃退火、延伸,采集荧光信号34 s,40 个循环,在反应结束后进行熔融曲线分析。以不同拷贝数的对数值为横坐标,以反应过程中到达荧光阈值的初始循环数Ct 值为纵坐标绘制标准曲线,计算二者的回归方程。
1.5.5 16S rRNA 高通量测序 瘤胃和十二指肠内容物以及直肠粪便微生物多样性检测选取细菌16S rDNA V3-V4 区,样本所得DNA 送至北京奥维森基因科技有限公司,利用Illumina MiSeq PE300 平台(Illumina,Inc.,CA,USA)进行Paired-end 测序。
1.6 统计分析 所有数据输入软件Excel 2003 整理,采用SPSS 17.0 统计软件One-way ANOVA 进行方差分析,用LSD 法对组间差异显著性检验,P<0.05 表示差异显著,P<0.01 表示差异极显著,结果用平均值± 标准差表示。生物信息分析利用QIIME 平台进行多样性矩阵分析。在R(version 3.3.0)软件中使用VennDiagram 包(1.6.17),各组间比较采用Kruskal-Wallis 检验以及P<0.05 检验。
2 结果
2.1 包被工艺参数确定
2.1.1 制粒参数 ①起膜芯粒的适宜比例:利用多孔的微晶纤维空白丸芯(MCC)作为载体基质可以提高制粒的稳定性,如表2 可知,起膜芯粒(MCC 与海藻酸钠)比例在10:1 较好。②起膜芯粒与菌泥的混合液用量比例:将起膜芯粒与菌泥(植物乳杆菌)混合制备微液滴,提高制粒的圆球度,便于后续包被,由表2 可知,二者比例在1:1 较适宜,便于制粒。

表2 制粒参数
2.1.2 包被参数 一次包被以海藻酸钠作为内层包衣材料,形成初级微胶囊,由表3 可知,制粒颗粒与海藻酸钠包被液之比为4:3 较合理。二次包被采用胃崩快渗型丙烯酸脂类共聚物作为外层包膜,一次包衣颗粒与丙烯酸树脂的用量为1:4 较适宜。

表3 包衣液用量
2.1.3 产品活菌数 据上述工艺参数,对植物乳杆菌和包被植物乳杆菌分别加工成成品,为体内评价试验做准备,也为保证后期体内评价试验条件一致,所以每批次生产的活菌数均控制在同一数量级,其活菌数分别为(8.00±0.07)×109CFU/g 和(7.82±0.17)×109CFU/g。
2.1.4 产品包埋率 对植物乳杆菌进行包被,通过平板计数得出的平均包埋率达82%以上(表4)。

表4 植物乳杆菌包埋率
2.2 体外抗逆性评价 由表5 可知,植物乳杆菌在pH 1和2 的人工胃液中几乎不能存活;而当pH 达3 时,活菌率达23.25%。包被植物乳杆菌在pH 1 和2 的人工胃液存活率虽不高,但其活菌数依旧维持在106CFU/g 和108CFU/g 以上,而在pH 3 的人工胃液中其活菌存活率高达85%。说明未包被的植物乳杆菌对抗胃酸的能力较差。
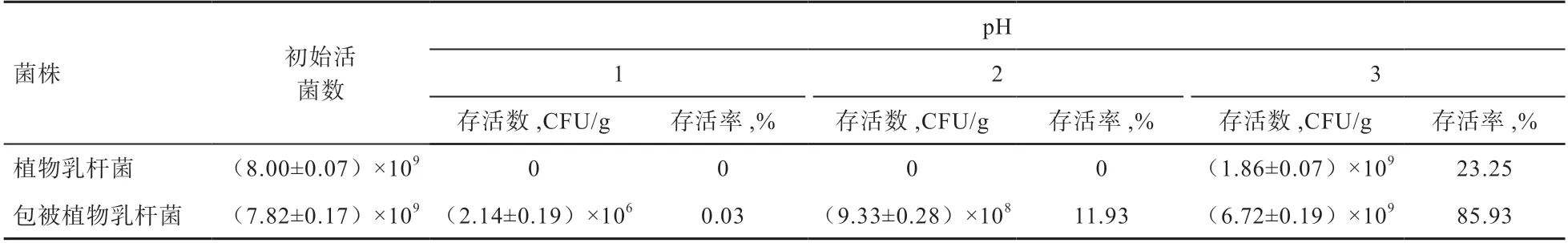
表5 人工胃液条件下植物乳杆菌活菌数
由表6 可知,不同处理植物乳杆菌在不同浓度胆盐中的活菌数保持在一个数量级上。二者在较低浓度0.10%和0.20%的人工肠液中的活菌率均较高,而在高浓度0.30%的人工肠液中,包被植物乳杆菌的活菌存活率很高,但植物乳杆菌活菌数仍旧在109CFU/g 以上。说明本试验选用的植物乳杆菌具有较强的抗胆盐能力。
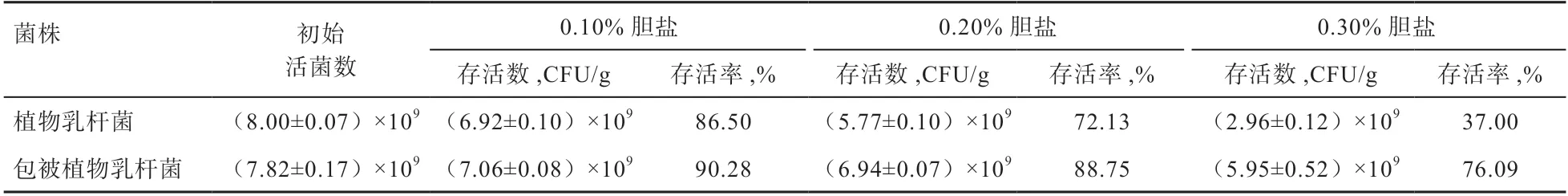
表6 人工肠液条件下植物乳杆菌活菌数
2.3 体内评价
2.3.1 包被植物乳杆菌过瘤胃过真胃效果 由图1 可知,Ct 值和拷贝数呈线性关系,荧光定量PCR 标准曲线方程:y=-2.70x+34.58(y 代表Ct 值,x 代表初始模板量的对数),Ct 值从12.57 到27.96 个循环,初始模板浓度与Ct 值之间线性相关系数R2=0.9917(R2>0.90),所建立的标准曲线符合实时定量PCR 的要求。
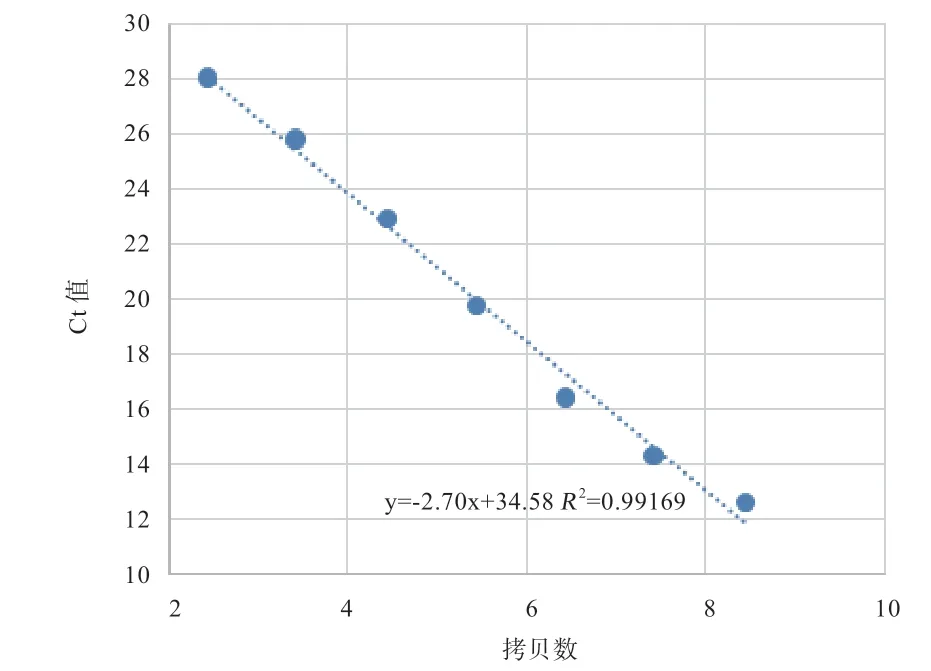
图1 植物乳杆菌JCM-1149 标准曲线
对奶牛胃肠道定量植物乳杆菌JCM-1149 含量如表7 所示。在瘤胃中,与对照组相比,试验组定量植物乳杆菌JCM-1149 含量均升高,而包被植物乳杆菌组显著升高(P<0.01),但3 组qPCR 的值都在1 个数量级上。在十二指肠中,与对照组相比,试验组定量植物乳杆菌JCM-1149 含量均升高,而包被植物乳杆菌组显著升高(P<0.01);包被植物乳杆菌组qPCR 值高出对照组和植物乳杆菌组1 个数量级;而未包被的植物乳杆菌与对照组在1 个数量级,说明通过真胃到达十二指肠的能力较低。在直肠中,与对照组相比,试验组定量植物乳杆菌JCM-1149 含量均升高,而包被植物乳杆菌组显著升高(P<0.01),分别高出对照组和植物乳杆菌组2 和1个数量级。

表7 不同处理植物乳杆菌JCM-1149 在各部位的含量 拷贝数/ng DNA
2.3.2 包被植物乳杆菌对奶牛胃肠道菌群的影响 由图2 可知,在门水平,3 个部位,3 个分组共获得22 个门的分类物种,主要优势菌门为厚壁菌门、拟杆菌门、放线菌门、单糖菌门以及变形菌门。
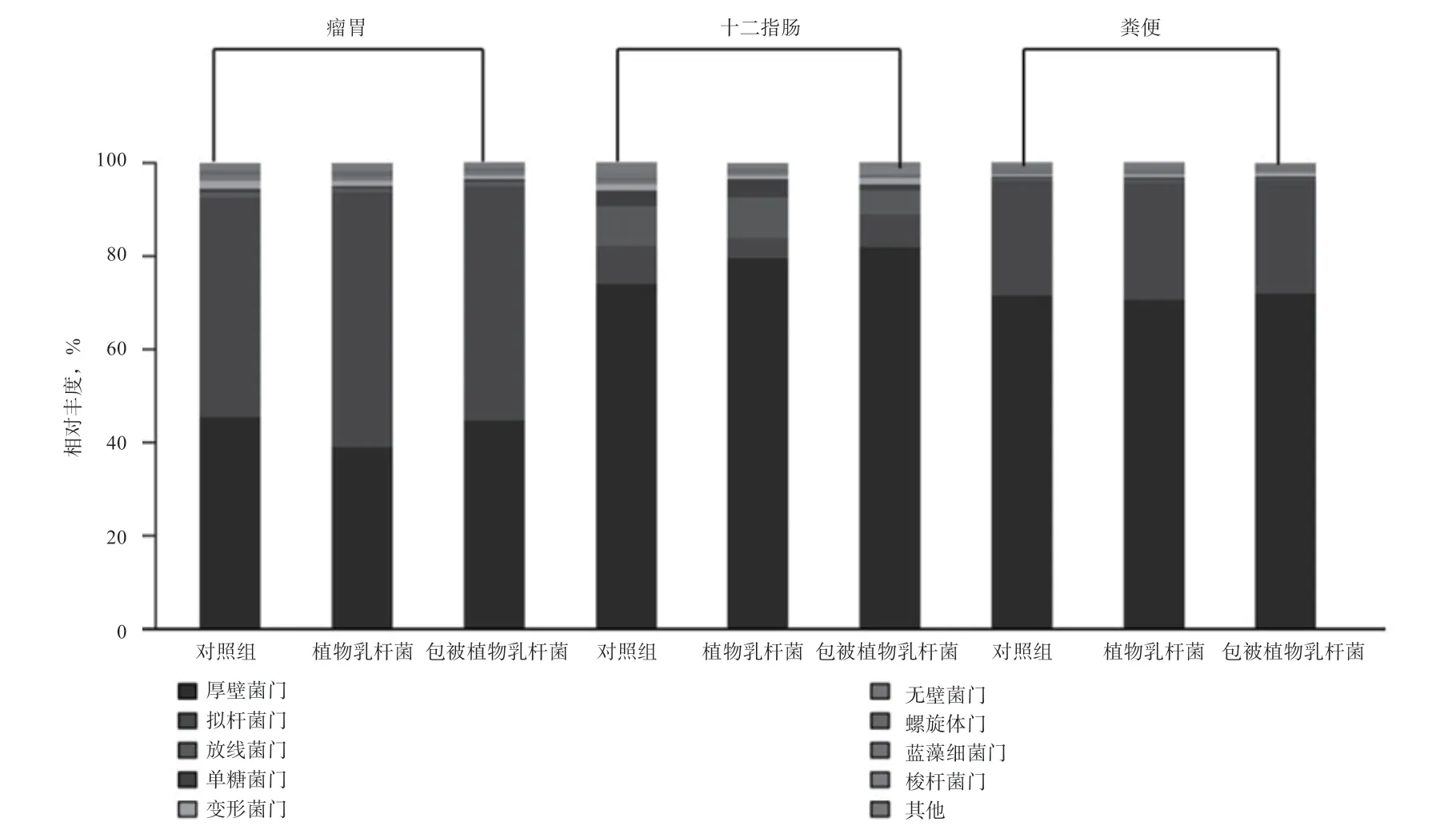
图2 不同肠段微生物在门水平的变化
通过Kruskal-wallis 检验提取差异微生物,再通过SPSS 统计软件进一步分析各组间菌群丰度的差异,共发现3 个菌门存在差异。如表8 所示,在瘤胃中,变形菌门和绿弯菌门在各组间差异显著,添加植物乳杆菌和包被植物乳杆菌均降低变形菌门和绿弯菌门的丰度(P<0.05)。在十二指肠中,各组间差异不显著。在直肠中,包被植物乳杆菌降低了广古菌门丰度(P<0.05)。由此表明,在门水平,植物乳杆菌组仅对奶牛瘤胃微生物有一定的影响,而包被植物乳杆菌组对瘤胃和肠道菌群均有影响。
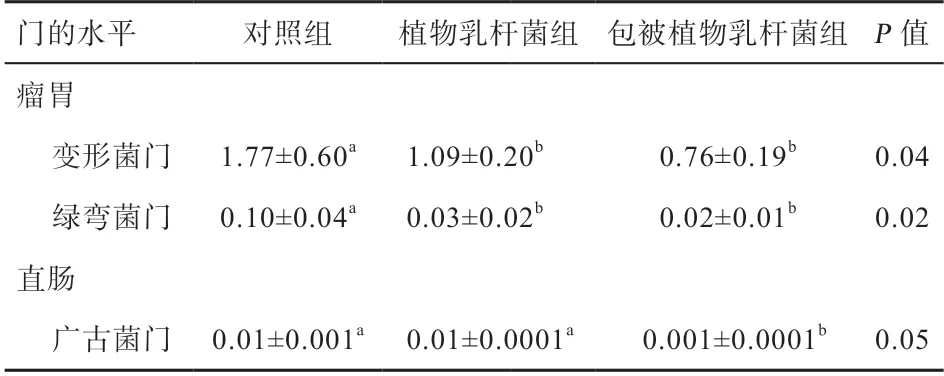
表8 不同处理植物乳杆菌对胃肠道菌门的影响 %
由图3 可知,在属水平,3 个部位,3 个分组共鉴定出322 个细菌属,主要优势菌属为普氏菌属_1、克里斯腾森菌科_R-7_group、毛螺菌科_NK3A20_group、瘤胃球菌科_UCG-005、理研菌科_RC9_gut_group、瘤胃球菌科_NK4A214_group、解琥珀酸菌属等。

图3 不同肠段微生物在属水平的变化
通过Kruskal-wallis 检验提取差异菌属,再通过SPSS 统计软件进一步分析,共有57 个菌属存在差异。如表9 所示,在瘤胃中,有34 个菌属在各组间存在差异,进一步分析差异属下相对丰度在1%以上的菌属。与对照组相比,包被植物乳杆菌主要提高了厚壁菌门下毛螺菌科的醋香肠菌属和毛螺菌科_NK3A20_group 属以及厚壁菌门下瘤胃球菌科的产粪甾醇真细菌属的丰度(P<0.05);植物乳杆菌提高了拟杆菌门普雷沃氏菌科_UCG-003 属的丰度(P<0.05),降低了厚壁菌门下瘤胃球菌科的瘤胃球菌属_2 的丰度(P<0.05)。在十二指肠中,5 个菌属在各组间存在差异,且各菌属的含量极低,其中包被植物乳杆菌主要提高了厚壁菌门下毛螺菌科的毛形杆菌属(Lachnobacterium)的丰度(P<0.05)。在直肠中,18 个菌属在各组间存在差异,进一步分析差异菌属下相对丰度在1%以上的菌属。与对照组相比,包被植物乳杆菌主要提高了厚壁菌门下瘤胃球菌科_UCG-005 属的丰度(P<0.05),降低了厚壁菌门下瘤胃球菌科_UCG-013 和拟杆菌门下拟杆菌目的Phocaeicola属的丰度(P<0.05)(表9)。由此表明,添加包被植物乳杆菌主要提高了胃肠道中厚壁菌门下毛螺菌科和瘤胃球菌科的菌属,降低了拟杆菌门下拟杆菌目的Phocaeicola属的丰度;而植物乳杆菌主要提高了瘤胃中拟杆菌门下的菌属,降低了厚壁菌门下的瘤胃球菌属_2 的丰度,而对肠道菌属的影响较小。

表9 不同处理植物乳杆菌对胃肠道菌属的影响 %
3 讨 论
3.1 包被植物乳杆菌工艺的确定 包被技术是近年来广泛应用于提高益生菌产品抗逆性的一种新技术,是一种利用包材(壁材)包裹或密封芯材,在特定条件下以可控速度释放芯材的技术[17-18]。常用的壁材有天然材料、半合成材料以及高分子材料。天然材料中海藻酸盐和壳聚糖来源丰富、价格合理,适于工厂化加工生产,其特点是成膜性好、生物相容性好、降解物无毒。半合成材料多为纤维素类衍生物。合成材料有聚酯、聚乙烯、聚丙烯酰胺以及树脂等,但价格较高,生物相容性不好。目前常将天然材料与合成高分子材料混合作为包被材料[19]。本试验采用微晶纤维素空白丸芯造粒,作为微丸造粒的起膜芯粒,不仅有效解决制粒中真球度低、颗粒均匀度差的问题,而且兼具稀释-粘合-崩解三合剂的作用。以植物乳杆菌为囊芯物,海藻酸钠为内层包被材料,形成初级微胶囊,此为一次包被。一次包被的目的是利用海藻酸钠对pH 敏感,在真胃中低pH 的情况下不破损,而在肠道中碱性环境可以快速释放。二次包被采用丙烯酸脂类共聚物成品作为外层包膜,二次包被依据外层包衣对瘤胃和真胃pH 的差距,可以耐受瘤胃的pH,不易被微生物分解,而在比瘤胃低的pH 值的真胃内被快速分解。分解后的丙烯酸树脂,暴露出内层海藻酸钠继续保护益生菌免受胃酸侵蚀,待进入动物肠道后将囊芯释放出来。
目前对微生态制剂的使用剂量还没有形成一个统一的标准。国际乳业联盟(The International Dairy Federation,IDF)推荐每克或者每毫升益生菌产品不得低于107的有效活菌数[20]。而食品农业组织和世界卫生组织建议,任何益生产品的理想活菌数不应少于106~107CFU/mL[21]。本试验采用WBF-1G 型多用途流化床进行顶喷包被制备植物乳杆菌微胶囊,经过多次预试验获得较佳的工艺参数,使得每批产品的活菌数都稳定在109CFU/g,符合益生菌产品推荐的有效活菌数量级。
包埋率是检验益生菌包被成功与否的一个因素。同时通过平板计数,其包埋率达到80% 以上,介于不少文献及发明专利中提及的益生菌微胶囊包埋率(60%~90%)[22-24]。
3.2 体外抗逆性评价 乳酸菌作为一种益生菌,对胃肠道具有一定的耐受性是发挥益生功能的前提条件[25]。一般哺乳动物胃内pH 为2 左右,而胃蛋白酶的最适pH 值也为2,这种酸性环境可以杀死随食物进入胃内的细菌。关于乳酸菌耐酸机制已有诸多研究[26]。本试验中,未包被的植物乳杆菌在低pH 1~2 时,无法存活,当pH 升高到3 时,活菌存活率仅为20%;而包被后的植物乳杆菌在低pH 1~2 时,其活菌存活率也很低,但其活菌数也可达到1×106CFU/g 以上,当pH 升高到3时,活菌存活率达85% 以上。据报道,当人或动物摄入含有1×106CFU/g 或以上的活性乳酸菌就能发挥其益生作用[27],表明包被后的植物乳杆菌对低pH 和胃蛋白酶均有一定程度的耐受性,能以一定数量的活菌顺利到达肠道。
乳酸菌要在肠道中存活并定植于肠道,因而对肠道的耐受力要比对胃液的耐受力更为重要。小肠是益生菌发挥功效的场所,内含胰液、胆汁和小肠液,而正常哺乳动物小肠中胆汁的浓度为0.03%~0.3%[28]。本试验把乳酸菌加于较高浓度梯度的胆盐肠液中,发现乳酸菌对胆盐的耐受力均较强,而包被后的植物乳杆菌几乎不受高浓度胆盐的影响。说明本试验选用的植物乳杆菌菌株和所采用的包被技术能对抗胆盐等形成的高渗透压及胰蛋白酶的分解作用,可以进一步研究其在体内的功效。
3.3 包被植物乳杆菌过瘤胃过真胃效果 据报道,益生菌等活细菌被用于调节动物体的肠道菌群和生理机能,但它们的定殖往往是一过性的[29]。而不同研究者发现食用益生菌通过胃进入肠道活菌数量较少,可能其在进入肠道之前就已灭活,类似的研究多集中于体外模拟胃肠道条件进行验证[24-25]。本研究通过造瘘术获取胃肠道真实环境样品,进行体内验证,并依据定量微生物多采用qPCR 技术,可以快速、精确定量肠道核酸含量,试图通过比较瘤胃与肠道中植物乳杆菌数量的变化,来检验包被植物乳杆菌过瘤胃、过真胃,到达肠道的能力。
本试验结果表明,在瘤胃、真胃和肠道中,包被植物乳杆菌组qPCR 值显著高于对照组和植物乳杆菌组,这与多数研究结果类似。Anselmo 等[11]采用海藻酸钠和壳聚糖对凝结芽孢杆菌进行逐层包被,结果表明:在体外模拟胃酸(pH=2)和胆盐(4%)2 h 后,双层包被的凝结芽孢杆菌较单层包被的凝结芽孢杆菌活菌数提高了4 个数量级;采用体内模拟小肠模型(MatTek EpiIntestinal),口服益生菌在被递送到靶点的过程中不受到胃肠道环境的影响,同时提升了益生菌在肠道中的粘附性。Li 等[30]用碳酸钙与纤维素做包材,可将高达1010CFU/g 的植物乳杆菌包裹在内,释放出的活菌数可达3×1010CFU/g,在模拟胃部环境不受pH 影响,而在肠道靶点释放。由此表明,本试验所采用的双层包被植物乳杆菌可以避免瘤胃微生物的降解,抵御真胃胃酸的侵蚀,最后顺利到达肠道,显著提高益生菌在体内的存活率。
3.4 包被植物乳杆菌对奶牛胃肠道菌群的影响 本试验中,植物乳杆菌仅影响瘤胃中的菌门和相关菌属丰度,包被植物乳杆菌对瘤胃和肠道的菌门和相关菌属均有影响,说明包被处理后的植物乳杆菌能顺利到达肠道,进而对肠道菌群产生潜在的影响。在瘤胃中,不同处理植物乳杆菌均显著降低了变形菌门和绿弯菌门丰度。变形菌门是细菌中最大的一个门,包括很多致病菌,添加不同处理的植物乳杆菌可能对变形菌门形成竞争和拮抗作用,起到益生作用[31]。绿弯菌门是一类进行不产氧光合作用的细菌,对水体环境影响较大[32]。添加不同处理植物乳杆菌降低其丰度可能跟菌株本身的特性有关。本研究发现,在直肠中仅包被植物乳杆菌显著降低了广古菌门丰度。广古菌门包含了古菌中大多数种类,在动物肠道中以产甲烷菌为主,添加的包被植物乳杆菌可能会抑制广古菌门中产甲烷菌丰度,对维持肠道健康有益。在属水平,包被植物乳杆菌对奶牛胃肠道菌群均有较大影响,而植物乳杆菌仅对瘤胃的影响较大,在十二指肠和直肠中几乎未检测到显著的菌属,可能未经保护的植物乳杆菌多数不能到达肠道靶向释放。包被植物乳杆菌降低了直肠中拟杆菌门下的菌属,提高了厚壁菌门下的某些菌属,这与一项人类的研究结果类似,服用含植物乳杆菌的复合益生菌制剂可以降低便秘患者肠道内的拟杆菌门的丰度,而提高厚壁菌门的相对丰度[33]。
物种组成与差异分析表明,不同处理的植物乳杆菌对奶牛胃肠道中厚壁菌门和拟杆菌门下的菌属影响较大,说明肠道微生物能够对植物乳杆菌的介入产生迅速反应,这可能与各菌门的代谢产物(VFA)有关。有报道指出,拟杆菌门以生成乙酸和丙酸为主,乙酸、丙酸可以抑制肿瘤坏死因子的释放,对结肠炎有很好的疗效;而厚壁菌门则以生成丁酸为主,丁酸对预防治疗结肠癌有良好的疗效[34-36]。本试验中57 个关键菌属中大部分是对肠道健康有益的。植物乳杆菌主要提高瘤胃中拟杆菌门下普氏菌属丰度,降低了厚壁菌门下的瘤胃球菌属_2 丰度。普氏菌属在瘤胃中可降解并利用淀粉和植物细胞壁多糖,同时参与蛋白质的降解以及对肽的吸收和发酵起作用[37]。瘤胃球菌属在肠道中丰度较高,能促进蛋白质的合成,可以防止机体营养不良[38]。包被植物乳杆菌主要提高瘤胃中醋香肠菌属、毛螺菌科_NK3A20_group 以及产粪甾醇真细菌属的丰度;提高十二指肠中毛形杆菌属丰度;提高直肠中瘤胃球菌科_UCG-005 丰度,降低瘤胃球菌科_UCG-013 和Phocaeicola丰度,这些菌属主要来自厚壁菌门下毛螺菌科和瘤胃球菌科的菌属。瘤胃球菌科和毛螺菌科是厚壁菌门下梭菌目的最丰富的2 个家族,可以参与到将碳水化合物分解为SCFAs 的过程中[39-40],负责多种多糖和纤维的降解,与维持肠道健康有关。毛螺菌属对结肠患者和炎症性肠病患者具有保护作用[41-42],与其能产生丁酸有关,同时毛螺菌科菌可以抵制艰难梭菌的定植,并且可以用于治疗与预防艰难梭菌引起的伪腺性肠炎等疾病[43]。植物乳杆菌本身属于厚壁菌门下的菌属,以上结果再次证明经过包被处理后的植物乳杆菌可以顺利达到肠道而靶向释放,进而提高胃肠道中厚壁菌门下的菌属。本试验中同一菌株植物乳杆菌经过包被处理后的效果强于未经包被的植物乳杆菌,说明包被植物乳杆菌可以顺利到达肠道发挥益生作用。
4 结 论
在理想制粒和包被工艺参数下,植物乳杆菌微胶囊活菌数和包埋率分别达到109CFU/g 和82.48%,包被后的植物乳杆菌对抗胃酸和胆盐的抗逆性好;经包被处理的植物乳杆菌微胶囊过瘤胃、过真胃以及达到肠道的能力极显著高于对照组和未包被的植物乳杆菌组;包被植物乳杆菌组对奶牛瘤胃和肠道菌群均有一定的调控作用,而植物乳杆菌组仅对奶牛瘤胃菌群有一定的影响。包被植物乳杆菌微胶囊具备作为微生物添加剂的潜力,并对相关产品的研发具有一定的参考价值。

