榛子雄花神曲发酵物的药理活性比较研究
林宇青,梁依然,陈 琦,姜 君,安仁波
(1.延边大学 农学院,吉林 延吉 133002;2.长春市农业科学院,长春 130000;3.延边大学 药学院,吉林 延吉 133002 )
神曲又名六曲,六神曲。目前神曲对药物的加工方式多为传统发酵工艺,因神曲中含有酵母菌、根霉菌等真菌,可在一定的温度和湿度下通过其自身的催化分解作用,使药物发泡、生衣,更易于人体吸收[1-2]。
榛子(Corylusheterophylla)为桦木科的果实,主要生长于北半球的温带地区,其雄花穗在中国长白山地区常被用于预防和治疗肝脏疾病[3]。榛子树在越冬期间,其雄花都会有不同程度的脱落或损害,而这些在农业生产上往往被忽略。作为世界4大坚果食品的榛子,其药理活性已被大量研究证实[4-5],然而其雄花却并未受到广泛关注。因此,该试验利用榛子雄花生神曲和炒神曲发酵物研究了3种提取物的抗氧化、抗炎、抗糖尿病及抑制黑色素形成的影响,并与水提取物(对照)进行了比较,为后续榛子雄花产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
榛子雄花于2016年4月采集于吉林省延吉市,由延边大学药学院安仁波教授鉴定。生神曲、炒神曲购置河北金草药业有限公司;DMEM,胎牛血清(FBS)购于Gibco公司;DPPH,购于索莱宝科技有限公司;噻唑蓝(MTT)购买于碧云天生物技术有限公司;α-葡萄糖苷酶,α-淀粉酶,酪氨酸酶均购于上海源叶生物有限公司;(S)-2-氨基-3-(4-羟基苯基)丙酸(左旋多巴)购于Sigma 公司。
1.2 方法
1.2.1 样品制备
称取10 g榛子雄花放于预先装入200 mL蒸馏水的三角瓶中后,分别加入10 g的生神曲与炒神曲,以不加神曲处理的蒸馏水组为对照。用棉花塞住瓶口,放置于25 ℃的恒温培养箱中,摇匀后培养6 d,发酵后取发酵液,冷冻干燥后置于-20 ℃保存。
1.2.2 体外抗氧化试验
1) DPPH清除能力
参考夏秋霞等[6]的方法测定了DPPH自由基清除能力。将2种神曲发酵的榛子雄花发酵液分别配置成0.2、0.4、0.6、0.8和1.0 mg/mL后,与1 mL的60 μmol/L DPPH混合。维生素C(Vc)为阳性组,以不加榛子雄花发酵液为对照组。混合液于37 ℃下避光温育30 min,测定517 nm处的吸光值。
2) 铁离子螯合能力
参考 Fu等[7]的方法,于96孔板中加入用不同神曲发酵的不同浓度的榛子雄花发酵液(0、5、10、15、20 mg/mL)后,加入蒸馏水137.5 μL和2.5 μL的2 mmoL的FeCl2,摇荡后加入10 μL的5 mmoL菲洛嗪溶液。室温下反应10 min后于562 nm处测定吸光值。
铁离子螯合能力=
1.2.3 体外细胞抗炎试验
1) 细胞培养
Raw264.7细胞培养于含10%胎牛血清,1%链霉素和青霉素的DMEM培养液中后在相对湿度为95%,CO2含量为5%的细胞培养箱中培养。
2) 细胞毒性试验
将Raw264.7细胞以1×104cells/孔培养于96孔板中,试验组加入不同浓度的榛子雄花发酵液,孵育24 h后弃去培养液,加入MTT (500 μg/mL),培养2 h后取出,加入DMSO后置于振荡器以充分溶解甲瓒结晶,使用酶标仪在波长为550 nm处测定OD值,计算细胞存活率。
3) NO测定
选取对数生长期Raw264.7细胞以2.5×105cells/孔培养于48孔板。正常组和LPS组分别加入培养液150 μL,处理组加入不同浓度的榛子雄花发酵液。1 h后,处理组与LPS组同时加入LPS(100 ng/mL)37 ℃培养24 h后收集细胞上清液,每孔取50 μL上清液至96孔板中。使用NO标准品工作液制作标准曲线。每孔按1∶1 加入Griess试剂50 μL,使用酶标仪在波长为550 nm处测定OD值,制作标准曲线,计算NO含量。
1.2.4 降血糖活性测定
1) α-葡萄糖苷酶抑制率测定
取50 μL不同浓度榛子雄花发酵液(0、0.20、0.40、0.60、0.80和1.00 mg/mL)于试管中,加入50 μL α-葡萄糖苷酶溶液(0.5 mol/mL),混匀,置于37 ℃恒温培养反应10 min,加入100 μL对硝基苯酚葡萄糖苷(PNPG)溶液,用塑料膜密封并置于37 ℃恒温培养箱中反应30 min,最后加入50 μL 0.1 mol/L Na2CO3溶液终止反应,405 nm处测定吸光值[8]。计算公式如下。
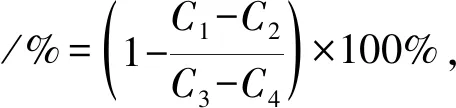
式中,C1,样品+α-葡萄糖苷酶+PNPG 的吸光值;C2,样品+PNPG 的吸光值;C3,α-葡萄糖苷酶+PNPG 的吸光值;C4,PNPG 的吸光值。
2) α-淀粉酶抑制率测定
取50 μL α-淀粉酶溶液(2 mol/mL)于96孔板中,加入50 μL不同浓度榛子雄花发酵液(0、0.25、0.50、1.00、1.50、2.00 mg/mL),混匀,置于37 ℃恒温箱中10 min。加入50 μL 1%淀粉溶液,在37 ℃反应10 min,加入100 μL 3,5-二硝基水杨酸(DNS),沸水浴中反应5 min 后立即冰浴,冷却后550 nm处测定吸光值。计算公式如下。
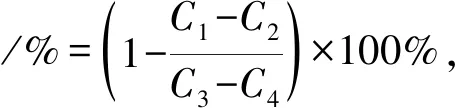
式中,C1,样品+α-淀粉酶+1%淀粉的吸光值;C2,样品+1%淀粉的吸光值;C3,α-淀粉酶+1%淀粉的吸光值;C4,1%淀粉的吸光值。
1.2.5 酪氨酸酶抑制率检测
为了测定不同神曲发酵的榛子雄花发酵液对酪氨酸酶活性的抑制影响。参考Chan等的方法[9],在96孔板中依次加入榛子雄花发酵物、磷酸盐缓冲液和1 mmol/L左旋多巴,在37 ℃水浴10 min,加入100 U/mL酪氨酸酶反应5 min,在475 nm处测定吸光值,并计算酪氨酸酶的抑制率。
式中,A,不含样品但含酪氨酸酶的阴性组吸光值;B,不含样品及酪氨酸酶的空白组吸光值;C,包含样品及酪氨酸酶的样品组吸光值;D,含样品但不含酪氨酸酶的对照组吸光值。
1.2.6 数据分析
所有试验均重复进行3次,利用GraphPad Prism 9软件进行数据分析。数据为平均数,采用t检验对试验数据进行分析。
2 结果与分析
2.1 榛子雄花神曲发酵液的抗氧化活性
2.1.1 不同神曲发酵的榛子雄花清除DPPH自由基的能力
不同神曲发酵的榛子雄花对 DPPH 自由基的清除活性有所差异,随着榛子雄花发酵物浓度的增加,对DPPH 自由基的清除能力不断增强(图1)。其中,对照组在1 mg/mL清除效果达到了81.33%,清除能力稍低于维生素C(Vc),炒神曲组清除效果达到了68%。当提取物浓度为1 mg/mL时,对于DPPH自由基的清除能力依次为:对照组>炒神曲组>生神曲组。

图1 不同神曲发酵的榛子雄花发酵液对清除DPPH自由基能力的影响
2.1.2 不同神曲发酵的榛子雄花发酵液对铁离子螯合能力试验
不同神曲发酵的榛子雄花随着浓度的升高,铁离子螯合能力也逐渐增强,呈正相关。炒神曲组在20 mg/mL时,螯合能力达到91%,稍高于柠檬酸(图2)。当榛子雄花发酵物浓度为20 mg/mL时,不同榛子雄花神曲发酵对于铁离子的螯合能力依次为:炒神曲组>对照组>生神曲组。

图2 不同神曲发酵的榛子雄花发酵液 对铁离子螯合能力的影响
2.2 不同神曲发酵的榛子雄花发酵液抗炎活性比较
2.2.1 不同神曲发酵的榛子雄花发酵液的毒性试验
分别用浓度为0、1.56、3.13、6.25、12.5、25、50、100、200和400 μg/mL的榛子雄花提取物处理细胞24 h。与空白组比较发现,当浓度低于100 μg/mL时,该样品对于细胞无毒性影响,大于100 μg/mL对细胞有毒性(图3A)。因此,榛子雄花组在后续试验中低、中、高组浓度依次选择为25、50和100 μg/mL,以确保后续试验的正确性。
生神曲组筛选浓度为0、1.56、3.13、6.25、12.5、25、50、100、200和400 μg/mL,处理细胞24 h,与空白组比较发现,当浓度低于25 μg/mL时,对于细胞无毒性影响,而大于25 μg/mL对细胞有毒性(图 3B)。因此,生神曲组在后续试验选择低、中、高组浓度为6.25、12.5和25 μg/mL,以确保后续试验的正确性。
分别使用0、1.56、3.13、6.25、12.5、25、50、100、200和400 μg/mL的炒组样品处理细胞24 h。根据统计学分析,当样品浓度低于25 μg/mL时,该样品对于细胞无明显毒性影响(图3C)。因此,在后续试验分别选择6.25、12.5和25 μg/mL为该样品的低、中、高剂量组浓度,以确保后续试验的正确性。

图3 榛子雄花生水提取(A)、神曲(B)和炒神曲发酵物(C)对细胞活性的影响
2.2.2 不同神曲发酵的榛子雄花发酵液对NO释放量影响对比试验
由图4可知,Raw264.7 细胞经LPS(200 ng/mL)刺激后,细胞上清中NO的含量显著升高(P<0.05);与LPS组比较发现,不同神曲发酵的榛子雄花预处理后,细胞上清中NO含量上升的现象被有效抑制(P<0.05),并且随着榛子雄花发酵物浓度的增加呈正相关。其中,不同组别样品对NO的抑制率依次为:对照组>炒神曲组>生神曲组。
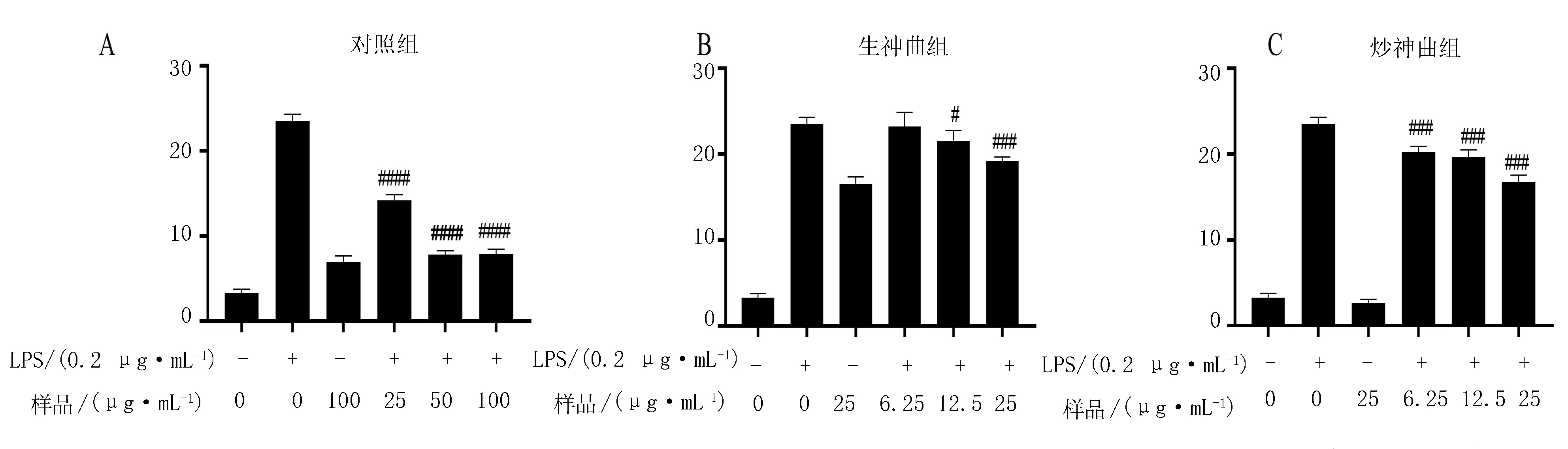
图4 不同神曲发酵的榛子雄花发酵液对NO释放量的影响
2.3 不同神曲发酵的榛子雄花发酵液对降血糖活性测定
由图5A可知,不同神曲发酵的榛子雄花的提取物浓度在0~2 mg/mL时,对α-葡萄糖苷酶有明显抑制作用,且抑制率随提取物浓度的升高呈快速上升趋势,其中,抑制率强弱分别为炒神曲组>对照组>生神曲组。
由图5B可知,不同神曲发酵的榛子雄花在0~2 mg/mL时,对α-淀粉酶均有抑制作用,且随提取物浓度的升高呈快速上升的趋势,其中,对α-淀粉酶的抑制能力炒神曲组>对照组>生神曲组。

图5 不同神曲发酵的榛子雄花发酵液对酶的抑制作用的影响
2.4 不同神曲发酵的榛子雄花发酵液对酪氨酸酶的抑制作用
由图6可知,不同神曲发酵的榛子雄花提取物浓度处于0~1.25 mg/mL时,对酪氨酸酶有抑制作用,且抑制率随着样品浓度的升高呈快速上升的趋势,其中,炒神曲组>对照组>生神曲组。
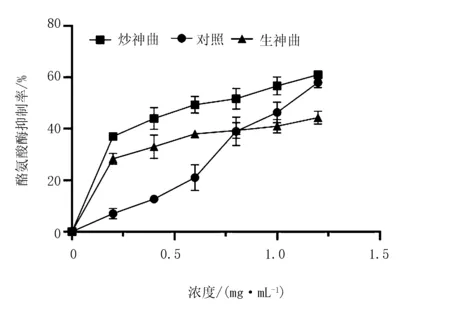
图6 不同神曲发酵的榛子雄花发酵液对黑色素的抑制作用
3 讨论与结论
神曲又被称为中华第1曲,是用发酵法制成的代表性中药炮制品,其原料复杂,主要含有酵母菌和根霉菌[10]。据文献报道,苷类和挥发油在传统发酵过程中不稳定,会降解或挥发,因此发酵后产生的各种酶在一定程度上削减了神曲的药理活性[10-11]。该研究探究了神曲经不同处理后对榛子雄花药效的影响,通过对榛子雄花提取物“抗氧化”“抗炎”“降血糖”“抑制黑色素生成”等活性的检验,以确定榛子雄花的最佳处理方式。
体外抗氧化指标主要可分为清除自由基的能力、铁离子的还原力及金属离子的螯合能力等[6]。DPPH是一种常见的自由基,利用其与样品结合后在可见光区吸光值的变化可以有效地评价样品的抗氧化性[12];Fe2+可以催化活性氧自由基的形成从而对细胞和组织造成损伤,如果可以将这些Fe2+耦合为Fe3+,即可消除其催化作用,以证明其样品的抗氧化活性[13]。在该研究中,炒神曲发酵的榛子雄花的提取物铁离子螯合能力最佳,而DPPH自由基消除效果为对照组最优。
炎症发生时,细胞间质中促炎介质NO浓度升高,过量的NO有较强的毒性作用,会诱导机体产生一系列炎症反应及氧化应激损伤[14-15]。对照组抑制NO的释放量最高,达73.5%。在人体中,α-淀粉酶将碳水化合物水解成寡糖,寡糖在α-葡萄糖苷酶的作用下进一步水解成葡萄糖;抑制α-淀粉酶和α-葡萄糖苷酶的活性,能减缓葡萄糖生成,从而降低人体血糖水平[16-17]。炒神曲发酵的榛子雄花对α-葡萄糖苷酶和α-淀粉酶均具有抑制作用。在生化酶学研究中,黑色素细胞中存在大量的黑色素体,酪氨酸酶主要存在于黑色素体中。当人体中黑色素增长过多时会造成皮肤色素沉着,颜色暗沉,从而引起皮肤类疾病,颜色分布不均造成黄褐斑、老年斑、雀斑等,因此,抑制酪氨酸酶可以减少黑色素瘤的形成[18]。在生化酶学法研究黑色素的抑制研究中,炒神曲明显优于其他发酵方式。
总之,不同神曲发酵榛子雄花药效不尽相同,但均能有效抗氧化,抑制炎症,抑制α-淀粉酶、α-葡萄糖苷酶活性及黑色素的生成。

