白菜型冬油菜NAC基因家族鉴定及表达分析
王会文, 范军强, 路晓明, 曾 瑞, 武军艳, 刘丽君, 马 骊, 蒲媛媛, 孙万仓, 李学才
(1.甘肃农业大学农学院,甘肃兰州730070;2.省部共建干旱生境作物学国家重点实验室,甘肃兰州730070)
关键字: 白菜型冬油菜;NAC转录因子;家族分析;非生物胁迫;表达分析
气候变化是当今人类面临的重大风险挑战,荒漠化不仅威胁着全球生态环境,而且对各个国家和地区的经济发展产生重大影响。中国北方大多数地区为干旱半干旱气候,冬季寒冷干燥,这种气候和人类活动的影响更容易使土地荒漠化[1],21世纪以来,全球土地荒漠化现象正在日益加剧,在中国北方地区尤其明显。陇油系列白菜型冬油菜可以在寒冷干旱的恶劣环境中正常越冬[2],拥有丰富的抗逆基因,使油菜的分布范围更加广泛,可以在北纬48°的阿勒泰等地区种植[3]。与此同时,白菜型冬油菜增加了中国北方地区的复种指数,提高了当地土地利用率和粮油产量[4],使油菜不仅可以作为传统的油料作物,还可以作为冬季覆盖作物。在北方干旱寒冷区域大面积种植冬油菜可以增加土壤覆盖率,同时有效防止土地沙漠化,减少沙尘天气[5],对改善生态环境具有重要作用。随着生物信息学的不断发展和对白菜型冬油菜基因组测序的完成,挖掘白菜型冬油菜中储存的基因信息,以阐明植物生长发育机制、各种逆境胁迫机理,并利用其丰富的抗逆基因增强作物抵御环境胁迫的能力,为今后培育适应性更强的品种提供理论依据。
植物在长期适应外界多变的环境过程中,自身形成了响应逆境胁迫的防御体系,其本质就是通过内部的基因表达,使植物在复杂的环境中调节体内生化代谢途径和生长发育进程来适应外界环境变化[6]。转录因子作为蛋白质,可以与目的基因启动子或增强子的区域相互作用来调控基因的表达[7],从而发挥其生物学功能。NAC(NAM、ATAF1/2、CUC2)是植物特有的最大的转录因子基因家族之一,NAC蛋白结构由高度保守的N端和可变的C端(TR)组成,N端分为A、B、C、D、E 5个亚结构域[8],不同亚结构域发挥着不同的作用。其中,C、D高度保守,负责与目标靶基因的DNA序列识别并结合,B、E则保守性较弱,和C端功能相似,一起促成其功能的多样性;亚结构域A可以形成二聚体,和DNA结合有关[9]。NAC转录因子蛋白通常与植物细胞内膜结合在一起,当植物受到外界不利环境信号刺激后,与NAC转录因子蛋白结合的受控蛋白被水解,然后NAC蛋白进入细胞核[10]。NAC蛋白结构域N端的亚结构域可形成二聚体,与DNA结合形成稳定的结构,调控靶基因启动子区基因的表达[9]。NAC转录因子的这种调节方式可以使植物迅速对外界环境作出反应,有利于为植物的生长发育创造良好的内部环境。NAC家族成员广泛分布在植物中,成员多达100个以上[11-13]。NAC蛋白结构域C端具有高度可变的转录调控区,在不同的条件下具有不同的转录特性,从而激活或抑制不同的转录过程[14],为其参与调控植物的生长发育、器官衰老、果实成熟、各种非生物胁迫防御等提供条件[15]。
在番茄中,NAC转录因子基因SlNAM1与合成乙烯的2个关键基因SlACS2和SlACS4的启动子结合并激活其表达[16],促进了乙烯的合成,而SlNAM1突变体则延迟番茄的成熟;PdeNAC是赤松纤维素合成酶合成的关键基因,促进了赤松次生细胞壁的形成和管胞分化,增加了烟草和拟南芥次生细胞壁的沉积[17];拟南芥转录因子基因NAC103在种子萌发和幼苗生长过程中被上调[18],其编码蛋白质对脱落酸敏感,并正向调节多个脱落酸(ABA)应答下游基因,提高了拟南芥种子的发芽率。在调控植株衰老过程中,ANAC087和ANAC046具有协同作用,通过控制拟南芥根冠程序性死亡来促进植株的衰亡,ANAC087通过核酸酶BFN1降解根部细胞的染色质[19],ANAC046通过内含子顺式作用元件和相关蛋白质的修饰主动调控细胞程序性死亡。马铃薯StNAC053基因在拟南芥中过量表达,上调相关基因,增强了超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)的活性,增加了转基因拟南芥对干旱的耐受力[20];最近研究发现,辣椒CaNAC55基因的表达受ABA的抑制[21],而在水稻中,NAC转录因子ONAC066能抑制合成脱落酸基因的表达,积累更高的可溶性糖、氨基酸含量,提高水稻对稻瘟病和白叶枯病的抗性[22],表明NAC家族基因与ABA代谢基因具有拮抗作用,并且NAC家族基因在生物胁迫中也发挥作用。迄今为止,白菜型冬油菜NAC转录因子家族在白菜型冬油菜中还未见报道。
本研究拟利用白菜型冬油菜基因组测序数据和生物信息学手段挖掘并分析白菜型冬油菜NAC基因家族成员的基本信息、系统进化、共线性复制关系,通过对2个不同品种白菜型冬油菜在低温胁迫下生长锥中BraNAC家族基因表达量的预测,并应用实时荧光定量PCR技术对2个耐旱性、抗寒性不同的白菜型冬油菜幼苗中候选BraNAC基因的表达量进行检测,然后筛选抗逆基因,以期为后续全面解析白菜型冬油菜NAC基因家族成员对多种逆境胁迫响应的机制奠定基础,同时,一些BraNAC成员可以作为候选基因,为增强油菜的耐旱性和抗寒性提供参考。
1 材料与方法
1.1 试验材料
本试验所用的白菜型冬油菜试验材料陇油7号和Lenox由甘肃农业大学油菜课题组提供。陇油7号和Lenox均为白菜型冬油菜,其中,陇油7号具有强抗寒性和抗旱性,而Lenox的抗寒性和抗旱性较弱。
1.2 试验设计
试验在2021年3月至10月进行,将陇油7号和Lenox种子种植在花盆中,每盆4株,使种子在室外自然条件下生长,待植株长到5~6叶期,分别对2种材料进行胁迫处理。低温处理,将植株移入4 ℃低温培养箱(光照14 h,黑暗10 h),同时对同一批次的幼苗进行干旱胁迫处理(18%聚乙二醇),处理后0 h(CK)、1 h、4 h、6 h、12 h、24 h、48 h收集幼苗的根和叶,立即放入液氮中速冻,之后保存于-80 ℃冰箱中备用,每个处理3次生物学重复。
1.3 白菜型冬油菜NAC家族成员的生物信息学分析
1.3.1 白菜型冬油菜全基因组的鉴定 白菜型冬油菜陇油7号基因组序列文件由甘肃农业大学油菜课题组提供;用Pfam数据库(http://pfam.xfam.org)下载NAM隐马尔可夫结构模型PF02365,使用HMMER搜索可能存在的NAC转录因子家族序列,并除去冗余。利用在线软件SMART(https://www.omicsclass.com/article/681)和NCBI CDD(https://www.ncbi.nlm.nih.gov/cdd/)对已获取的NAC蛋白进行结构域预测,最终得到含有保守BraNAC结构域的基因序列。同时,使用在线软件ExPASy (http://web.expasy.org/protparam/)对所有家族成员氨基酸序列的氨基酸数量、相对分子质量、等电点、亲水性、脂肪指数等进行预测。利用Plant-mPLoc( https://www.omicsclass.com/article/1438)预测NAC家族蛋白质的亚细胞定位。
1.3.2NAC基因家族系统进化树 基于已有候选基因家族蛋白质氨基酸序列全长,利用相邻接(Neighbor-joining)法在MEGA7软件中构建进化树,参数为默认值。
1.3.3NAC基因的染色体定位、共线性关系和启动子顺式作用元件分析 用所得NAC家族信息绘制基因在染色体上的位置图,同时用TBtools绘制共线性图;提取白菜型冬油菜候选BraNAC基因上游1 500 bp启动子序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库分析顺式作用元件,并绘制相关图表。
1.3.4 白菜型冬油菜NAC基因结构及保守模型分析 利用已有白菜型冬油菜NAC基因家族DNA和蛋白质编码区(CDS)序列,使用GSDS(http://gsds.gao-lab.org/)绘制内含子-外显子结构图;根据NAC基因ID从基因组注释文件中提取注释信息,搜索获得的家族成员的蛋白质结构域,利用MEME在线软件(http://meme-suite.org)分析BraNAC家族的保守基序,参数设置为在所有序列中最多找到15个、motif长度为6~50个氨基酸。使用TBtools软件绘制基因结构和保守模型图。
1.3.5 低温胁迫下BraNAC家族的表达预测 利用白菜型冬油菜陇油7号和Lenox的生长锥中BraNAC基因在冷胁迫时的表达数据,筛选出BraNAC家族基因的表达量,使用TBtools软件绘制热图。
1.3.6 RNA提取及荧光定量PCR 样品使用天根生化科技(北京)有限公司RNAprep pure Plant Kit植物总RNA提取试剂盒提取RNA,琼脂糖凝胶电泳检测RNA条带,利用PrimeScript RTrea-gent Kit with gDNA Eraser反转录试剂盒[宝生物工程 (大连) 有限公司产品]进行反转录,得到单链cDNA,置于-20 ℃冰箱保存备用。利用实时荧光定量PCR技术检测BraNAC基因的表达情况,所用引物见表1。各个样品检测重复3次,所得的数据采用2-△△Ct方法计算分析,以Actin内参基因作为对照。利用TBtools软件绘制表达热图。

表1 实时荧光定量RT-qPCR引物序列
2 结果与分析
2.1 白菜型冬油菜家族成员的鉴定
利用生物信息学分析方法从白菜型冬油菜全基因组中进行BLAST比对,除去冗余,通过结构域确认,最终得到119个NAC家族成员,根据E-value值从小到大的顺序,依次命名为BraNAC001~BraNAC119(表2)。BraNAC家族蛋白的相对分子质量、氨基酸数、脂肪指数等分析结果显示,BraNAC家族基因编码的氨基酸数量差异明显,最多的是BraNAC027,可编码658个氨基酸,最少的是BraNAC036,仅编码142个氨基酸;脂肪指数为43.68~84.04,表明脂肪链在蛋白质氨基酸序列中所占比重较高,蛋白质均为脂溶性蛋白质;等电点最小的是BraNAC023编码的蛋白质(4.47),最大的是BraNAC083编码的蛋白质(9.54),既有酸性氨基酸,又有碱性氨基酸;亲水性指数为-6.060~-0.280,为亲水性蛋白质;相对分子质量为16 529.18~71 967.59;亚细胞定位预测结果表明,BraNAC家族蛋白质成员在细胞中分布广泛,大部分分布在细胞核、细胞质和叶绿体中,BraNAC006、BraNAC015、BraNAC021、BraNAC067、BraNAC083定位在线粒体中,BraNAC050、BraNAC108定位在质膜上,BraNAC119定位在高尔基体中。在液泡、过氧化物体和细胞骨架中都发现了BraNAC家族蛋白,表明白菜型冬油菜NAC转录因子家族成员可能在不同亚细胞结构中具有不同的功能。
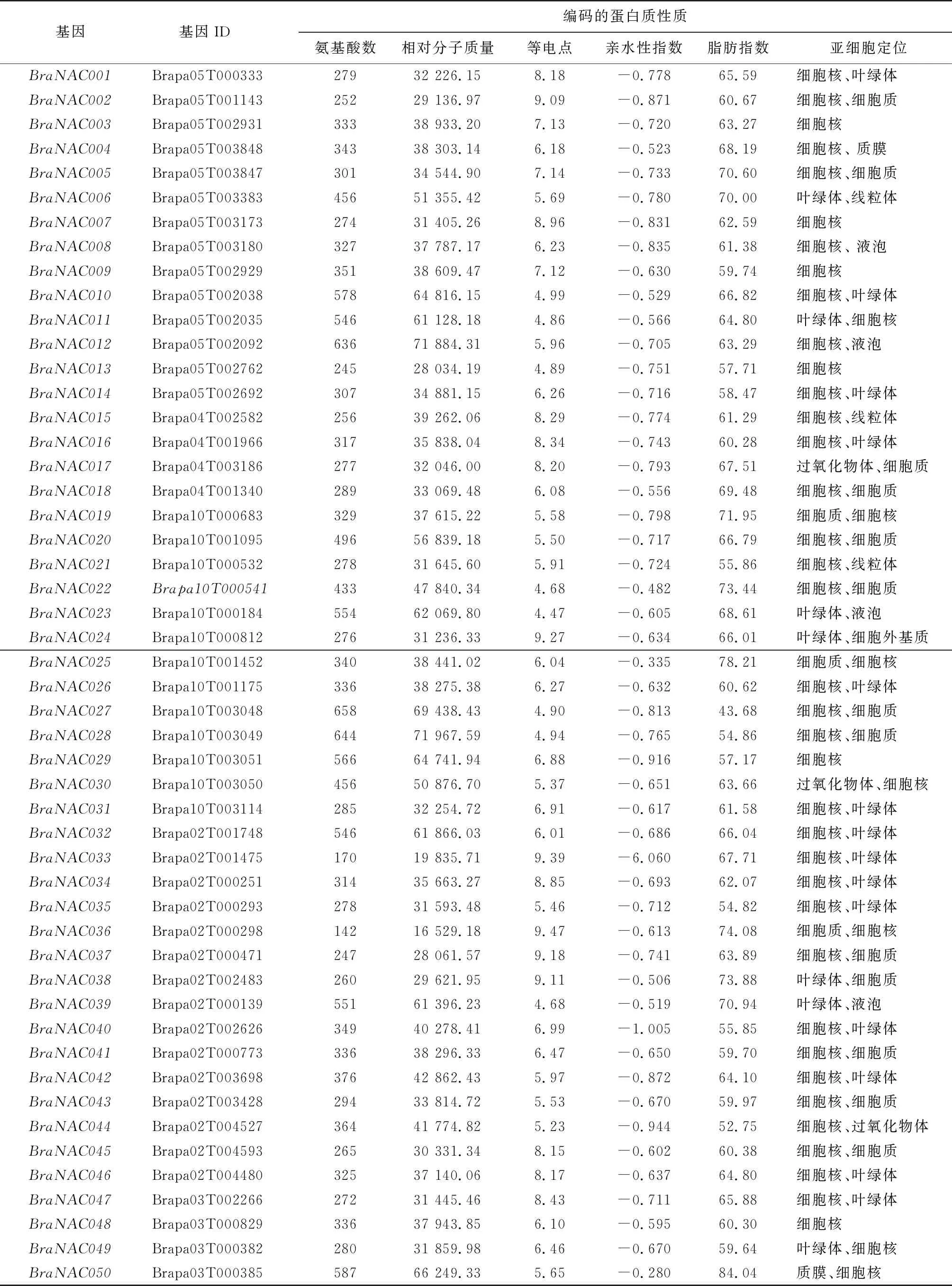
表2 BraNAC基因编码的蛋白质理化性质
2.2 BraNAC家族基因系统进化分析
由图1可知,119个白菜型冬油菜NAC家族成员被分为8个亚族。各亚族基因数目不一,第Ⅷ亚家族成员最少,仅包括5个基因,分支也较少,说明第Ⅷ亚家族基因同源性强;第Ⅵ和第Ⅰ亚家族数目最多,各包括25个家族成员,第Ⅰ亚家族分支数比第Ⅵ亚家族多,说明第Ⅰ亚家族的结构较为多样;BraNAC040在亚家族Ⅱ中的一级分支上,该基因可能行使亚家族Ⅱ的最基本功能;并且各个亚家族之间各级分支数、各分支基因数目不相同,表明每一个亚家族在同源结构域相同的情况下,还存在一些短的特异序列,这些序列可能为BraNAC家族功能多样性奠定结构基础。
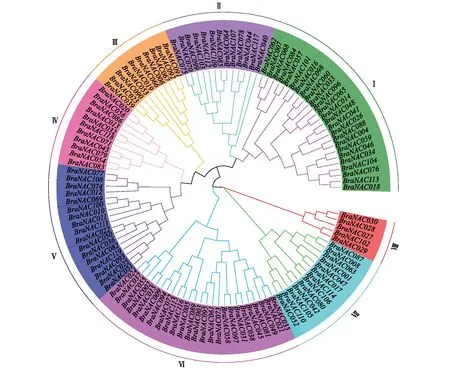
图1 BraNAC基因家族系统进化树
2.3 BraNAC基因家族染色体定位
由图2可以看出,BraNAC家族基因在10条染色体上都有分布,且在每条染色体上的数目各不相同。其中,3号染色体上分布的BraNAC基因数最多,有21个;在4号和8号染色体上分布的BraNAC基因数最少,各有4个;9号染色体最长,含有10个BraNAC家族成员。在1号、2号、3号、5号、6号、7号、10号染色体上含有较多BraNAC基因,距离较近。有31个(占比:26.05%)基因形成了13个串联基因簇,表明串联重复在BraNAC家族的扩展中发挥着重要作用。
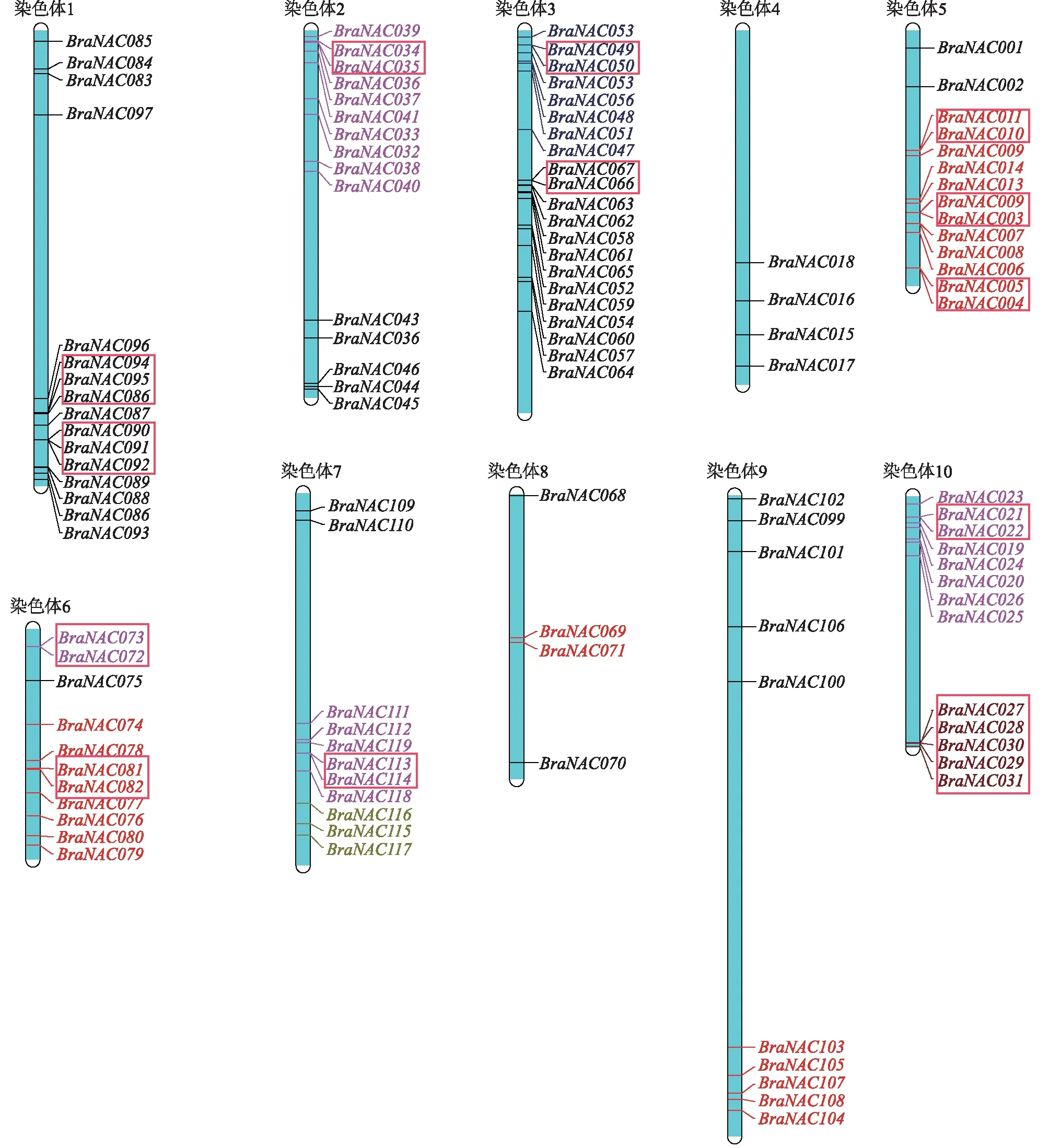
矩形表示串联重复基因。
2.4 BraNAC基因家族共线性复制关系分析
基因复制在生物体进化中发挥重要作用,复制的基因为植物个体的生理和形态变化奠定基础[23]。为了探究白菜型冬油菜NAC家族基因的串联重复关系,通过序列比对筛选BraNAC基因家族存在串联重复的基因,结果如图3所示。对119个BraNAC家族成员进行复制鉴定,发现10条染色体上有91个BraNAC家族基因发生了87对片段复制。表明BraNAC基因在进化过程中发生了一定规模的复制事件,导致BraNAC家族成员迅速扩张。
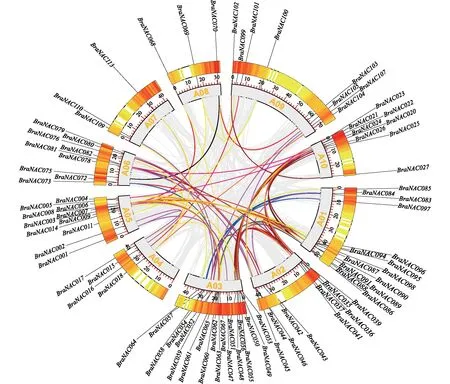
A01~A10表示1号染色体~10号染色体。
2.5 BraNAC基因家族蛋白质保守结构域、顺式作用元件和基因结构分析
为了明确BraNAC基因家族蛋白质的结构特点,分析了保守结构域,结果如图4所示,不同亚家族含有不同的保守结构域数目和种类,并且保守结构域的序列长度各不相同。除第Ⅷ亚家族的成员含有6个保守结构域之外,其他各个亚家族结构域的数目都是4个,Motif 1、Motif 2、Motif 3、Motif 4、Motif 5、Motif 7、Motif 8在亚家族Ⅰ~Ⅶ当中的数目较多,结构相对保守,表明这些结构域在BraNAC基因家族功能的发挥方面具有重要作用;而第Ⅷ亚家族保守结构域的数量增多,种类与其他各个亚家族不同。分析白菜型冬油菜上游1 500 bp启动子序列,如图4所示,大多数BraNAC家族成员上游主要有LTR、MBS、WUN-motif、GCN4_motif、CAAT-box、G-box、ABRE、TGA-element、GARE-motif等顺式作用元件,各个启动子的具体特征见表3。通过对BraNAC家族基因的结构分析(图4)发现,不同亚家族外显子和内含子数量存在差异,同一组内的数目相近。BraNAC036没有内含子,其他成员含有2~6个,亚家族Ⅰ和Ⅷ的内含子长度相比于其他亚家族明显增加,猜测这2个亚家族某些生物学功能可能发生了变化;亚家族Ⅰ、Ⅱ、Ⅵ和Ⅶ的外显子数目都是3个,亚家族Ⅲ、Ⅳ和Ⅴ外显子有4~6个;亚家族Ⅷ外显子平均数达到了8个,与基因的保守性结构域相吻合,表明亚家族Ⅷ的BraNAC成员在进化过程中可能发生了功能分化。

motif表示保守结构域; TGA-box表示顺式作用元件;UTR、CDS表示基因结构;LTR、MBS、WUN-motif、GCN4_motif、CAAT-box、G-box、ABRE、TGA-element、GARE-motif见表3。
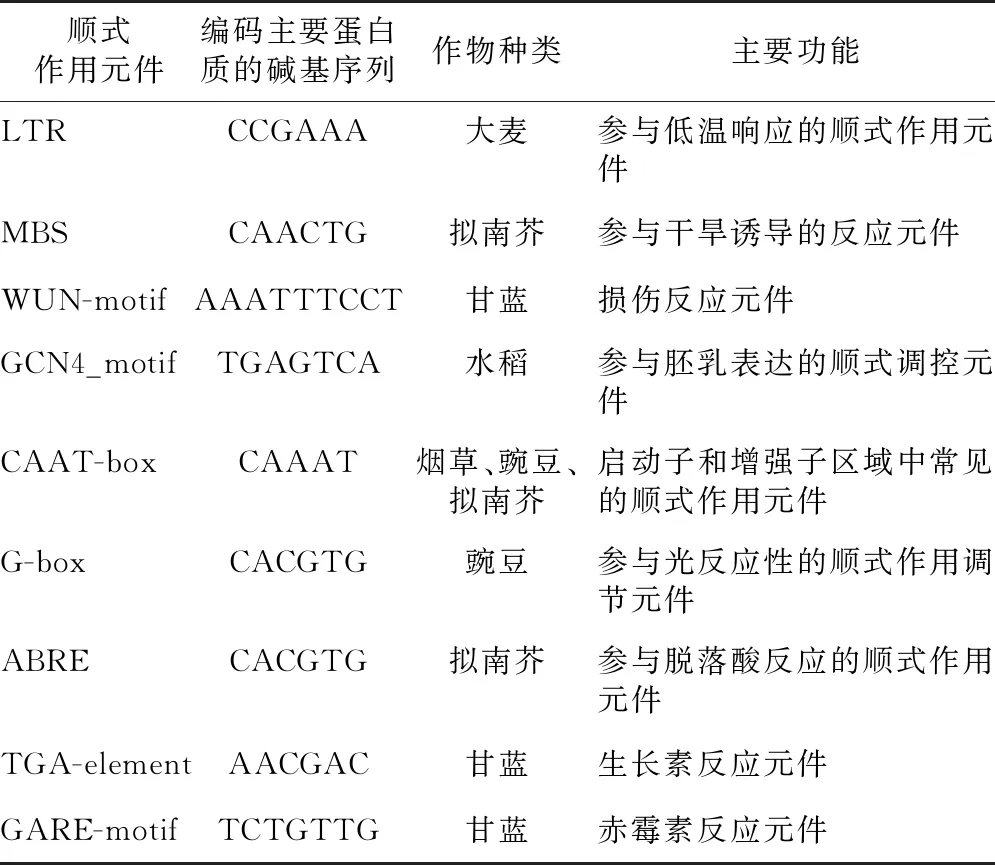
表3 白菜型冬油菜NAC基因家族顺式作用元件
2.6 低温胁迫下白菜型冬油菜BraNAC基因的表达分析
为了进一步了解白菜型冬油菜NAC家族基因在非生物胁迫下的表达模式,根据BraNAC基因在低温胁迫下的表达,分析2个不同品种白菜型冬油菜BraNAC基因在生长锥中的表达。由图5可知,在低温胁迫下,不同品种和不同处理时长BraNAC基因的表达变化不同,BraNAC097、BraNAC073、BraNAC095、BraNAC001、BraNAC061、BraNAC014、BraNAC033、BraNAC005、BraNAC115、BraNAC058、BraNAC003在陇油7号和Lenox中上调表达,BraNAC034、BraNAC051、BraNAC052、BraNAC025、BraNAC057、BraNAC118下调表达;冷处理初期,在陇油7号中上调表达的BraNAC家族基因少于Lenox,随着胁迫时间的增加,在陇油7号中上调表达的BraNAC家族基因明显多于Lenox。表明大部分BraNAC基因可能通过上调表达使白菜型冬油菜适应低温环境。
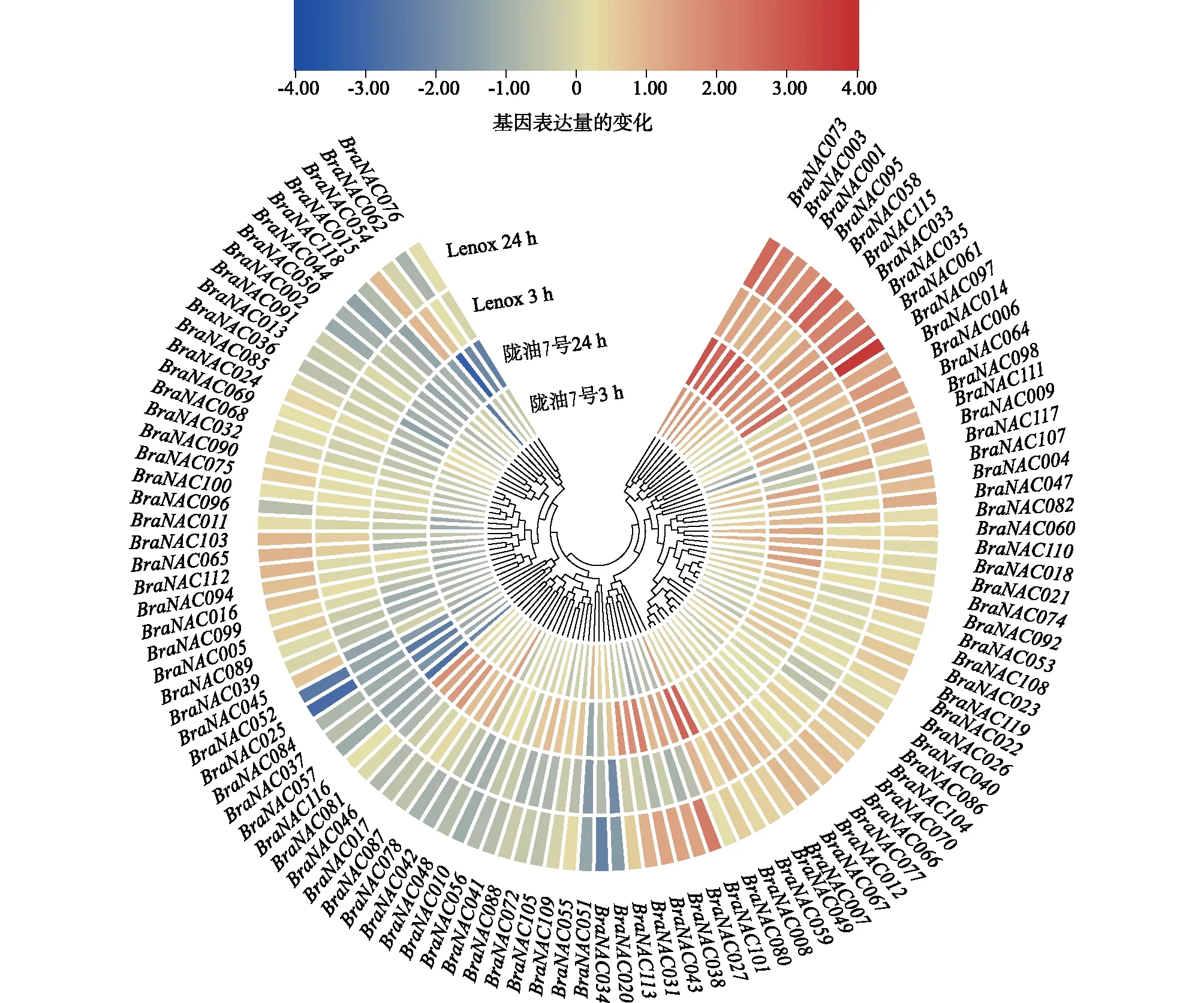
图5 低温胁迫下BraNAC家族成员在生长锥中的表达分析
2.7 BraNAC家族基因的表达分析
基于系统发育和BraNAC家族基因表达数据,选择了11个白菜型冬油菜NAC基因,分析低温和干旱胁迫下其在根和叶中的表达变化,对2种抗逆性不同的白菜型冬油菜分别进行低温处理和干旱处理,利用实时荧光定量PCR来检测BraNAC基因的表达水平。由图6A可知,低温胁迫下,白菜型冬油菜的根中大多数基因表达量在处理后24 h达到最大,如BraNAC012和BraNAC027在陇油7号处理24 h时表达水平明显升高,而在Lenox中变化不明显,BraNAC066表达量在陇油7号中变化不明显,而在Lenox中表达上调。在低温胁迫的叶中(图6B), 大多数基因在Lenox中的表达水平明显高于陇油7号,如BraNAC068在处理48 h后表达量明显升高,且在Lenox中变化更明显,BraNAC035在Lenox中处理24 h后具有很高表达量,BraNAC066和BraNAC015在Lenox中处理4 h后具有很高表达量,BraNAC034在处理48 h后表达水平明显升高,而在陇油7号中表达下调;因此,BraNAC012、BraNAC027和BraNAC068可能在植物抗寒方面起到正调控作用,相反,BraNAC035、BraNAC015、BraNAC066和BraNAC034可能与植物抗寒性呈负调控关系。
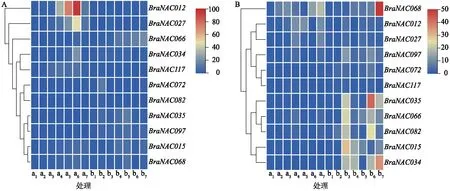
a1、a2、 a3、a4、a5、a6、a7分别表示陇油7号的根部对照、陇油7号的根部低温处理1 h、陇油7号的根部低温处理4 h、陇油7号的根部低温处理6 h、陇油7号的根部低温处理12 h、陇油7号的根部低温处理24 h、陇油7号的根部低温处理48 h。b1、b2、 b3、b4、b5、b6、b7分别表示Lenox的根部对照、Lenox的根部低温处理1 h、Lenox的根部低温处理4 h、Lenox的根部低温处理6 h、Lenox的根部低温处理12 h、Lenox的根部低温处理24 h、Lenox的根部低温处理48 h。
由图7A可以看出,在干旱胁迫下,白菜型冬油菜根中BraNAC034、BraNAC012、BraNAC027和BraNAC015的表达量在干旱处理4 h、6 h、24 h后在陇油7号中与对照相比明显上调,但在Lenox中变化不明显。图7B显示,BraNAC066的表达量在陇油7号干旱处理4 h明显升高,BraNAC012的表达量在陇油7号干旱处理6 h、48 h明显升高,在Lenox中变化不明显;干旱处理6 h,BraNAC068在陇油7号中的表达明显上调;干旱处理1 h后,BraNAC072的表达量在Lenox中明显升高,在陇油7号中没有明显变化;其他BraNAC基因干旱处理后在2个白菜型冬油菜品种中表达变化不明显。因此BraNAC012、BraNAC015、BraNAC068、BraNAC066、BraNAC027、BraNAC034可能在植物抗旱方面发挥正调控的功能,BraNAC072可能与植物抗旱性呈负相关关系。
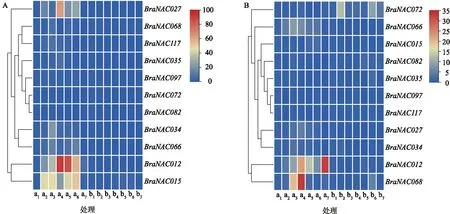
a1、a2、 a3、a4、a5、a6、a7分别表示陇油7号的根部对照、陇油7号的根部干旱处理1 h、陇油7号的根部干旱处理4 h、陇油7号的根部干旱处理6 h、陇油7号的根部干旱处理12 h、陇油7号的根部干旱处理24 h、陇油7号的根部干旱处理48 h。b1、b2、 b3、b4、b5、b6、b7分别表示Lenox的根部对照、Lenox的根部干旱处理1 h、Lenox的根部干旱处理4 h、Lenox的根部干旱处理6 h、Lenox的根部干旱处理12 h、Lenox的根部干旱处理24 h、Lenox的根部干旱处理48 h。
3 讨论
本研究利用白菜型冬油菜陇油7号基因组测序数据,经鉴定得到119个BraNAC家族成员,聚类为8个亚家族,保守结构域分析结果表明,第Ⅷ亚家族的保守结构域数量增多,种类与其他各个亚家族不同。基因结构分析结果显示,亚家族Ⅰ~Ⅶ的外显子数目都是3~6个,而亚家族Ⅷ外显子平均数达到8个,与基因的保守性结构域数目增多相吻合,可能在功能上出现了分化。顺式作用元件分析结果显示,BraNAC基因含有与冷胁迫、干旱胁迫、机械损伤、胚胎发育和内源激素调控等相关的响应元件,与前人的研究结果[7]一致。亚细胞定位结果表明,BraNAC蛋白在细胞核、细胞质、叶绿体、线粒体中都有分布,与之前研究结果[24]相比,在细胞中分布较为广泛,表明BraNAC基因在进化过程中可能发生了功能扩张事件。
低温和干旱是限制植物生长发育的重要气候因子[25-30],大量研究结果表明,NAC转录因子家族在植物响应寒冷[31]和干旱[6]信号途径中发挥作用。在干旱胁迫下,MlNAC12大量表达的转基因拟南芥与野生型相比,气孔孔径减小,活性氧(ROS)和丙二醛(MAD)积累减少,同时超氧化物歧化酶、过氧化物酶和过氧化氢酶等几种抗氧化酶的活性显著增强[32],增强了转基因拟南芥对干旱的耐受性。前人研究结果表明,当对白菜型冬油菜进行干旱胁迫时,CAT、SOD、POD活性与抗旱性呈正相关[33],且不同抗旱品种的CAT、SOD、POD活性变化不一样,在抗旱性弱的品种中各酶活性一般在相对较短的时间内变化较快。本研究利用2个抗性不同的白菜型冬油菜品种,筛选抗逆基因,结果发现,BraNAC012、BraNAC015、BraNAC068、BraNAC066、BraNAC027、BraNAC034都在陇油7号中干旱处理4 h后或者更长的时间后明显大量表达,这些基因可能在Lenox中处理很短的时间内大量表达,增强了白菜型冬油菜CAT、SOD和POD的活性,同时,降低ROS的含量,表现为植株对干旱的适应。低温通过影响植物体内的酶活性,减缓生理代谢过程,使细胞膜内外的渗透势发生改变[31],降低植物生长速率,从而造成生长缓慢,严重者可导致幼苗生长纤弱迟缓,叶片萎蔫、黄化,果实畸形等,最后导致农作物产量下降。在低温胁迫下,植物细胞会通过提高相关酶的活性或产生渗透调节物质来适应不利的环境[34]。在辣椒中,NAC家族基因CaNAC064的大量表达显著降低植株丙二醛(MDA)含量,增加渗透调节物质(Pro)含量,提高抗氧化酶活性,从而降低对低温胁迫的敏感性[35]。本研究中,BraNAC012、BraNAC027在超强抗寒材料陇油7号低温处理后表达量明显升高,而在弱抗寒材料Lenox中变化不明显。因此,BraNAC012、BraNAC027可能在提高白菜型冬油菜响应低温胁迫相关蛋白质含量和渗透调节物质含量等方面发挥着重要作用。
本研究首次对白菜型冬油菜NAC家族进行全基因组鉴定和结构分析,发现了119个BraNAC家族成员,并预测了11个可能参与寒冷、干旱胁迫的候选基因。结果表明,BraNAC012、BraNAC015、BraNAC068、BraNAC066、BraNAC027、BraNAC034可以作为候选基因,提高作物抗旱性,BraNAC027和BraNAC012可以作为提高作物抗寒性的候选基因。同时,BraNAC家族基因受不同逆境胁迫诱导,并且存在组织与时间表达特异性。本研究结果为今后全面解析白菜型冬油菜NAC基因的功能提供参考。

