血清4型禽腺病毒POCT荧光微球免疫层析检测方法的建立
邵 颖, 肖福泉, 王丽丽, 龚柳菲, 宋祥军, 涂 健, 祁克宗
(1.兽医病理生物学与疫病防控安徽省重点实验室,安徽合肥230036;2.安徽省动物性食品质量与生物安全工程实验室,安徽合肥230036)
禽腺病毒对养禽业有很大的隐患,许多家禽品种,如鸡、鸭、鹅等都会被感染。血清4型禽腺病毒(Fowl adenovirus serotype 4,FAdV-4)属于感染最为严重的I群禽腺病毒,不仅可以经口、经粪水平传播,而且还可以通过种蛋垂直传播[1]。FAdV-4侵染后主要以禽的心包积液和包涵体肝炎为病理特征,在世界各地都有发生。FAdV-4侵害3~5周龄肉鸡和蛋雏鸡,感染率高达90%以上,死亡率可高达80%[2-3]。FAdV-4是养殖业中致病的主要流行株,一直以来给中国家禽养殖业造成了严重的经济损失[4-5]。
目前常用的检测FAdV-4的方法有PCR、间接ELISA与IFA等。这些方法大都来自实验室,要求较高的专业技术,操作过程繁琐且检测仪器昂贵,对于大规模的临床检测来说费时费力[6]。荧光免疫层析因快捷简单、价格低廉、灵敏度高等优势而广泛应用于病原检测、食品安全检测、环境检测等方面[7]。即时检验(Point-of-care testing,POCT)是设备小、移动方便、操作简单、出结果时间短、即时即地检测的检测方式[8]。荧光微球免疫层析技术检测病毒时有较高的效率和灵敏度,可以定量检测,而且没有较高的技术要求。该技术在农业上可以运用于微生物鉴定、霉菌毒素残留测定、药物残留鉴定、动物疾病诊断、食品质量检测等[9]。
本研究用制备的鼠源多克隆抗体偶联荧光微球,用兔源多克隆抗体作为检测线(Test line, T线),山羊抗鼠IgG抗体为质控线(Control line, C线)[10],以FAdV-4具有特异性的抗原决定簇Hexon蛋白制备多克隆抗体,建立FAdV-4荧光微球免疫层析试纸条检测方法,并验证该试纸条的特异性和灵敏性。
1 材料与方法
1.1 材料
1.1.1 试验样品 原核表达载体 pGEX-6p-1、pET-32a、FAdV-4 基因组DNA、FAdV-4病毒液(滴度1 ml 1×107.52TCID50),FAdV-4 阳性临床样本、禽白血病(ALV)阳性临床样本,均由安徽农业大学动物科技学院兽医病理生物学与疫病防控实验室保存。
1.1.2 试验动物 7只BALB/c 小鼠、2只2 kg 左右的新西兰雌兔。
1.1.3 主要试剂 洗脱液Ⅰ:120.00 g尿素、1 ml tritan100、2.92 g氯化钠、0.05 g EDTA,加入磷酸盐缓冲液(Phosphate-buffered saline, PBS)至体积为1 L。洗脱液Ⅱ:120 g尿素、1 ml tritan100,加入PBS至体积为1 L。Premix Taq©Version 2.0(Loading dye mix)、5×Protein SDS PAGE Loading Buffer、2×Power Taq PCR MasterMix均购自诺唯赞生物科技有限公司,DH5α chemically competent cell、Cat no. 11802ES购自北京全式金生物公司,SDS-PAGE 蛋白上样缓冲液、PAGE 凝胶快速制备试剂盒购自上海雅酶生物科技有限公司,弗氏完全佐剂、弗氏不完全佐剂购自上海碧云天生物科技有限公司,HRP 标记的山羊抗兔IgG和HRP 标记的山羊抗鼠IgG购自合肥艾格博斯生物科技有限公司,荧光微球购自美国Bangs Laboratories, Inc公司。
1.2 试验方法
1.2.1 引物的合成 参考GenBank(登录号MN781665)的FAdV-4hexon基因碱基序列,设计1对特异性引物hexon-F/hexon-R,以实验保存的FAdV-4基因组DNA为模板,扩增目的基因片段。用实验室保存的线性化载体pET-32a及pGEX-6p,分别设计载体引物pET-32a-hexon-F/pET-32a-hexon-R和pGEX-6p-1-hexon-F/pGEX-6p-1-hexon-R,由生工生物工程(上海)股份有限公司合成(表1)。

表1 本研究使用的引物
1.2.2 重组质粒标准品 以实验室保存的FAdV-4基因组 DNA为模板,PCR扩增目的片段(729 bp)。PCR 反应程序:95 ℃预变性15 min;94 ℃ 变性30 s,56 ℃退火 30 s,72 ℃复性 2 min,共32 个循环;72 ℃延伸10 min。将重组产物进行凝胶回收,经过纯化后,与保存的线性化载体利用PCR进行连接。转化于感受态细胞上,构建重组质粒。提取阳性质粒,进行测序,将结果进行比对。将阳性标准品于-20 ℃保存,作为后续试验的阳性模板。
1.2.3 扩增产物诱导表达条件确立 将His-hexon蛋白和GST-hexon蛋白分别接种于LB培养基,用异丙基-β-D-硫代吡喃半乳糖苷(IPTG) 诱导蛋白质表达,IPTG 终浓度设为0.25 mmol/L及0.50 mmol/L,诱导温度分别设为 16 ℃、28 ℃ 及 37 ℃。诱导蛋白质表达后,10 000 r/min离心10 min,弃上清液,用磷酸盐缓冲液(Phosphate-buffered saline, PBS)重悬沉淀。采用超声波细胞破碎仪破碎蛋白质沉淀,收集蛋白质上清液与包涵体沉淀,经12%聚丙烯酰胺凝胶(Polyacrylamide gel electrophoresis, SDS-PAGE)电泳后,确定融合蛋白质的表达条件。
1.2.4 扩增产物溶解纯化条件的确立 先用PBS 重悬包涵体沉淀,离心10 min,弃上清液。分别用洗脱液Ⅰ、洗脱液Ⅱ和8 mol/L尿素重悬His-hexon蛋白沉淀,混匀,冰上静置10 min,10 000 r/min离心10 min,收集上清液。分别用洗脱液Ⅰ、洗脱液Ⅱ、6 mol/L尿素重悬GST-hexon蛋白沉淀,混匀,冰上静置10 min,10 000 r/min离心10 min,收集上清液。分别取经处理后的His-hexon蛋白和GST-hexon蛋白上清液,SDS-PAGE验证,确定融合蛋白的溶解条件。
1.2.5 动物免疫及抗体效价的测定 用BCA试剂盒测定His-hexon蛋白和GST-hexon 蛋白的浓度。用PBS稀释重组抗原,首次免疫动物时,抗原溶液与弗氏完全佐剂等量混合制成乳剂后免疫动物,之后免疫时,抗原溶液与弗氏不完全佐剂等量混合,振荡使之完全融合。具体的免疫过程:取已经乳化好的His-hexon蛋白,皮下分多点注射7只BALB/c小鼠。2周、4周、6周后以相同方法再各免疫1次,最后一次免疫后4 d摘除小鼠眼球取血。取GST-hexon 蛋白注射新西兰大白兔2只,每隔7 d进行一次免疫,最后一次免疫后4 d采集心脏血液。收集血清,经过洗涤、封闭,加入不同浓度的多克隆抗血清,孵育1 h。加入待测血清,加入用封闭液按1∶5 000稀释的HRP标记的山羊抗鼠IgG 抗体,孵育1 h,避光,用3,3′,5,5′-四甲基联苯胺 (3,3′,5,5′-Tetramethylbenzidine, TMB)显色,终止后用酶标仪测定波长450 nm处的吸光值,计算分析P/N值(阳性血清与阴性血清OD值之比)确定融合蛋白最佳包被浓度,根据最佳包被浓度测定抗体效价。用相同的方法测定兔源多克隆抗体效价。
1.2.6hexon基因的多克隆抗体Western Blot鉴定 GST-hexon蛋白进行12% SDS-PAGE电泳,将蛋白质转印到PVDF膜上,封闭后4 ℃过夜。以稀释100倍的鼠源多克隆抗体为一抗,稀释5 000 倍的HRP 标记的山羊抗鼠IgG为二抗,润洗后,加ECL显色液避光显色。His-hexon经12% SDS-PAGE电泳转印到PVDF膜,过夜孵育,以稀释100倍的兔源多克隆抗体为一抗,稀释5 000倍的HRP标记的山羊抗兔IgG为二抗,加ECL显色液,避光显色。拍照分析。
1.3 FAdV-4 POCT荧光微球免疫层析方法的建立
1.3.1 POCT 试纸条包被微球液最适pH的确定 将标准品用PBS 2倍梯度稀释,空白对照为PBS。FAdV-4病毒液的每个样品分别用pH值为6.2、6.6、7.2 偶联鼠源多克隆抗体组装的试纸条检测,在电脑上读出数值。
1.3.2 POCT试纸条包划线浓度的确定 将标准品用PBS 2倍梯度稀释,空白对照为PBS。将FAdV-4病毒液的每个样品分别用划线稀释液稀释至1 g/L、2 g/L、3 g/L组装的试纸条检测,读出数值。
1.3.3 敏感性试验 在最适pH下稀释5倍微球稀释液,利用三维喷点平台将稀释好的抗体标记微球溶液喷涂到5 mm的玻璃纤维膜与最佳划线浓度制备好的PVC板。分别取 FAdV-4 病毒液(分别稀释 101、102、103、104倍)、禽白血病临床阳性样本及样本稀释液加入加样孔,用本研究建立的POCT荧光微球免疫层析方法进行检测,15 min后进行读数,保存数据。
1.4 临床样品的检测
将实验室保存的7份禽腺病毒样本分别进行 PCR检测与POCT荧光微球免疫层析检测,对比检测结果。
2 结果与分析
2.1 pET-32a-hexon及pGEX-6p-1-hexon载体的构建
PCR产物与载体pET-32a用同源重组方法连接,转化后提取质粒。进行PCR验证,结果如图1所示,PCR目的片段大小在729 bp左右,与预期相符,测序正确。PCR产物与载体pGEX-6p-1经同源重组方法连接,转化后提取质粒,进行PCR验证,结果如图2所示,PCR目的片段与预期相符,测序正确。

M:核酸大小标准;1、2:PCR产物。

M:核酸大小标准;1、2:PCR产物。
2.2 产物诱导表达温度及IPTG浓度的确定
His-hexon蛋白在不同浓度IPTG、不同温度下诱导表达。SDS-PAGE电泳检测结果表明,His-hexon蛋白在包涵体中表达,在蛋白质相对分子质量4.3×104左右出现目的条带,第5孔融合蛋白目的条带明显(图3)。因此在16 ℃、 IPTG浓度0.25 mmol/L条件下诱导表达His-hexon融合蛋白最佳。

M为蛋白质相对分子质量标准,1、2分别为16 ℃诱导温度下空载未诱导、空载诱导,3为16 ℃诱导温度下菌液未诱导,4~6分别为16 ℃诱导温度、IPTG浓度0.25 mmol/L下的菌液、上清液、包涵体,7~9分别为16 ℃诱导温度、IPTG浓度0.50 mmol/L下的菌液、上清液、包涵体。
GST-hexon蛋白在不同浓度IPTG、不同温度下诱导表达。SDS-PAGE电泳检测结果显示,GST-hexon蛋白在包涵体中表达,在蛋白质相对分子质量5.2×104左右出现目的条带,第9孔融合蛋白目的条带明显且杂蛋白质最少。所以在37 ℃、 IPTG浓度0.50 mmol/L 条件下诱导表达GST-hexon融合蛋白最佳(图4)。

M为蛋白质相对分子质量标准,1、2分别为16 ℃诱导温度下空载未诱导、空载诱导;3为16 ℃诱导温度下菌液未诱导,4~6分别为16 ℃诱导温度、IPTG浓度0.50 mmol/L下的菌液、上清液、包涵体,7~9分别为37 ℃诱导温度、IPTG浓度0.50 mmol/L下的菌液、上清液、包涵体。
2.3 融合蛋白的溶解纯化条件优化
His-hexon蛋白在大肠杆菌中以包涵体形式存在。对重悬沉淀混合后溶解纯化的His-hexon蛋白进行SDS-PAGE 分析,从图5可看出,8 mol/L尿素能充分溶解His-hexon蛋白且目的蛋白浓度较高。

M:蛋白质相对分子质量标准;1:洗脱液Ⅰ;2:洗脱液Ⅱ;3:8 mol/L尿素。
对经洗脱液、尿素洗脱下来的GST-hexon蛋白进行SDS-PAGE分析,从图6可看出,6 mol/L尿素能充分溶解GST-hexon蛋白且目的蛋白浓度较高。

M:蛋白质相对分子质量标准;1:洗脱液Ⅰ;2:洗液Ⅱ;3:6 mol/L尿素;4:8 mol/L尿素;5:细菌菌液。
2.4 Hexon基因的多克隆抗体效价测定
采用间接ELISA方法测定最后一次免疫后小鼠血清。在 1∶800包被抗原稀释倍数下,P/N值普遍高于1∶400与1∶1 600包被浓度下的P/N值,并且在抗原稀释到1∶800、血清稀释到1∶100时P/N值达到最高,所以在1∶800稀释度下包被效果最佳。在包被浓度1∶800下进行抗体效价测定,再用间接ELISA方法测定抗体效价,取P/N≥2.1的血清稀释度为小鼠血清效价,结果(表2)显示小鼠血清效价为1∶819 200。
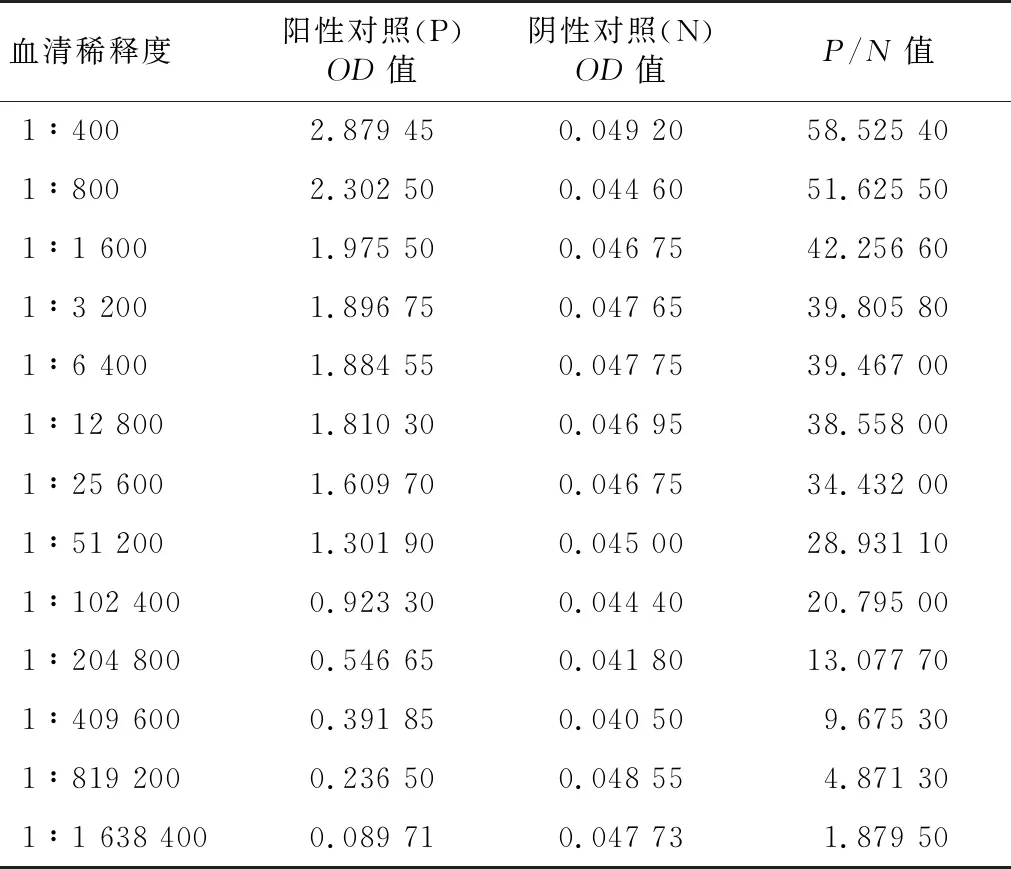
表2 鼠源抗体效价的间接ELISA测定结果
用间接ELISA方法检测最后一次免疫后新西兰大白兔的血清,在包被浓度1∶800 时P/N值普遍高于1∶400与1∶1 600包被浓度下的P/N值,且在抗原稀释到1∶800、血清稀释到1∶800时P/N值达到最高,所以在1∶800稀释度下包被效果最佳。在包被浓度1∶800时进行抗体效价测定,再用间接ELISA方法测定抗体效价,取P/N≥2.1的血清稀释度为兔血清效价,结果(表3)显示,1号兔的血清效价为1∶512 00、2号兔血清效价为1∶102 400。

表3 兔源抗体效价的间接ELISA测定结果
2.5 多克隆抗体Western Blot鉴定
将GST-hexon蛋白进行Western Blot鉴定,结果(图7)显示第2孔在5.2×104左右出现与预期蛋白质大小相同的条带。将His-hexon融合蛋白进行Western Blot鉴定,结果(图8)显示第2 孔在4.3×104左右出现与预期蛋白质大小相同的条带。

1:pGEX-6p-1空载菌液;2:GST-hexon蛋白。

1:pET-32a空载菌液;2:pET-32a-hexon。
2.6 POCT试纸条包被微球液最适pH的优化及划线浓度的确定
用FAdV-4病毒液作为标准品鉴定试纸条包被微球液最适pH。采用荧光读数仪读取T线(检测线)和C线(质控线)的荧光强度,并计算T/C值。T/C值越大说明特异性越好,如表4所示,该鼠源多克隆抗体荧光包被微球液在pH为6.6时效果最好。

表4 不同包被微球液pH下POCT试纸条荧光强度峰值
2.7 POCT试纸条划线质量浓度的优化
用FAdV-4病毒液作为标准品,比较试纸条包被微球液最适的兔源多克隆抗体T线划线质量浓度。用荧光读数仪读取的T线和C线荧光强度,并计算T/C值。T/C值越大说明特异性越好,如表5所示,兔源多克隆抗体T线划线质量浓度在3 g/L时效果最好。

表5 不同兔源抗体质量浓度下POCT试纸条荧光峰值
2.8 POCT荧光微球免疫层析检测的敏感性
用POCT试纸条检测实验室保存的临床样本,分别检测了3组PBS稀释液、3组ALV阳性组织研磨液、3组FAdV-4阳性组织研磨液与5组FAdV-4病毒液。结果(表6)显示ALV阳性组织研磨液为阴性,FAdV-4阳性组织稀释液为阳性。FAdV-4病毒液的稀释度1×103时为阳性,稀释度1×104时为阴性,禽白血病阳性组织液为阴性。检测病毒液最低病毒滴度为1 ml 1×104.52TCID50。
2.9 POCT荧光微球免疫层析检测方法初步应用
取实验室保存的7份禽腺病毒样本用POCT荧光微球免疫层析试纸条检测。POCT荧光微球免疫层析试纸条15 min检测出结果。检测结果如图9所示,检测出2份阳性,与PCR检测结果和临床诊断结果相符。

图9 POCT荧光微球免疫层析试纸条检测结果图
3 讨论
禽腺病毒属于禽腺病毒属,是DNA病毒[11-13]。禽腺病毒有12 种血清型(FAdV-1~FAdV-7、FAdV-8a、FAdV-8b、FAdV-9~FAdV-11)[14]。FAdV-4和FAdV-8b两种血清型最常见,FAdV-4型在中国养禽业中发生更加普遍,引起了广泛重视[15]。血清4型禽腺病毒会引起鸡的包涵体肝炎、心包积水综合征、产蛋下降综合征等临床症状,发病率和死亡率都很高[16]。目前对于血清4型禽腺病毒最常见的检测法有琼脂试验检测法、中和试验检测法、ELISA检测法、免疫荧光技术检测法等,这些检测方法都能有效地检测病毒,具有良好的特异性[17],但是操作专业性强,需要在实验室条件下进行,对于养殖场工作者来说是比较困难的。因此建立操作要求低且适用于大部分养殖场和基层兽医临床的检测方法十分必要。
本研究针对血清4型禽腺病毒特异性抗原的多克隆抗体,建立了一种检测血清4型禽腺病毒的POCT荧光微球免疫层析试纸条检测方法。生产POCT荧光微球免疫层析试纸条的关键技术在于抗体的制备,用特异性高的抗体制备的试纸条特异性和灵敏性也更高[18]。利用同源重组技术将目的基因与载体连接,转化为His-hexon和GST-hexon,作为免疫原,制备高效价的多克隆抗体,用间接ELISA和Western Blotting方法鉴定。本试验用的是多克隆抗体,利用ProteinA/G-Sephrose FF亲和层析柱快速提取多抗中的IgG,大大提高了试纸条的特异性,捕获到了抗原的存在,但灵敏度还有待进一步提高[19]。
影响试纸条特异性与灵敏性的因素还有一些化学药剂造成的非特异性结合、包被液和稀释液的浓度、包被液的pH等。不同样本稀释液检测的结果会有一定的差异,一般会选择PBS。在试纸条组装过程中,要避免操作台不被病原等可控因素影响,组装时尽可能不触碰到结合垫与NC膜,避免出现误差[20]。本试纸条最大的优点是不需要昂贵的仪器,定性检测的时候只需要紫外灯光照射便可观察结果,既快速又简单[21],可以在15 min内产生结果,适合于现场快速检测。但还需要进一步完善和优化生产过程,以适应不断变化的检测需求。
荧光微球制备过程简单且受外界环境的干扰较小,稳定性更好,利用检测仪就能实现基本定量,同时POCT技术已是很多病毒检测项目的研究热点[22]。本试验将二者相结合,建立了血清4型禽腺病毒的POCT荧光微球免疫层析检测方法,为基层兽医临床诊断提供了一种新的快速检测方法。

