α-1-酸性糖蛋白1在肺癌中的表达及其生物学功能探究
王卫东,艾丽丝,詹 艳,王雪晴,孙 慧,龚永生,金艳霞*
(1.湖北师范大学生命科学学院食用野生植物保育与利用湖北省重点实验室特色野菜良种繁育与综合利用湖北省工程技术研究中心生物学国家级实验教学示范中心,中国湖北 黄石 435002;2.武汉大学生命科学学院,中国湖北 武汉 430072;3.南京医科大学附属苏州医院,中国江苏 苏州 215008)
肺癌是较常见的原发性恶性肿瘤,发病率增长迅速,因其发病机制复杂、预防难、易转移和复发,患者存活率很低。肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占85%;根据组织亚型,NSCLC又分为肺腺癌(lung adenocarcinoma,LUAD)、肺鳞癌(lung squamous cell carcinoma,LUSC)、大细胞癌 3 种类型[1~2]。LUAD 占肺癌病例的40%,来自于小的气道上皮细胞和Ⅱ型肺泡细胞,具有侵袭性和快速致命性,总生存率低于5年,通常诊断为晚期时已扩散转移;LUSC占肺癌病例的25%~30%,起源于肺中央支气管上皮细胞中的早期鳞状细胞;大细胞癌占肺癌病例的5%~15%[3]。虽然低剂量计算机断层扫描(lowdose computed tomography,LDCT)用于肺癌筛查降低了肺癌患者死亡率,但晚期肺癌患者5年存活率仍不到15%[4]。研究表明,早期诊断可显著提高肺癌患者5年存活率,肿瘤大小为21 mm的IA期肺癌患者术后5年生存率达92%[5]。但肺癌患者在早期阶段无明显症状,因而易漏诊,发现时通常已为晚期,且其经治疗后易复发,预后差。临床上肺癌的治疗药物有顺铂及其衍生物、单抗药物(如阿特珠单抗)、靶向药物(如吉非替尼)等[6],但都有一定的副作用或低特异性,存在局限性。因此,肺癌的早诊和治疗仍是临床迫切需要解决的重难点问题,早发现、早干预和早治疗可有效降低死亡风险和改善预后。
前期研究中,我们运用定量蛋白质组学鉴定到α-1-酸性糖蛋白1(alpha-1-acid glycoprotein 1,AGP1)在早期NSCLC血清中表达下调,且能有效区分早期NSCLC和健康受试者,有望作为早诊NSCLC的肿瘤标志物[7];将早期NSCLC患者外周血中的白细胞进行转录组测序,筛选到下调的AGP1蛋白,进一步研究发现早期NSCLC中AGP1表达下降受转化生长因子-β(transforming growth factor-β,TGF-β)的调控,且 AGP 与 TGF-β 联合诊断早期NSCLC的效果很好,曲线下面积(area under the curve,AUC)达到 0.985[8]。
AGP1又称血清类黏蛋白1(orosomucoid 1,ORM1),是orosomucoid家族成员之一,该家族包括 ORM1(AGP1)和 ORM2(AGP2)[9]。AGP1 主要由肝脏合成并分泌到血液中,血液中的中性粒细胞也能分泌。AGP1含有201个氨基酸,相对分子质量为23.51 kD,其含有的多个糖链占总相对分子质量的45%[10],故在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE)中AGP1蛋白的条带大小约为44 kD。据报道,血清中AGP1有12~20种不同的糖型[11]。UniProt数据库显示,AGP1含有5个N-连接的GlcNAc 修饰位点,即 33、56、72、93 和 103 位点(https://www.uniprot.org/uniprot/P02763;2020-05-07)。AGP1是丝氨酸蛋白酶抑制剂,也是急性时相蛋白,是炎症生物标记物之一,在炎症或感染中AGP1血清浓度增加[12~13],AGP1与其他指标联合可用于区分活动肺结核和潜伏肺结核感染[14]。Sumanth等[11]报道,血清中肝脏来源的AGP1(sAGP1)和中性粒细胞分泌的AGP1(nAGP1)肽段序列一致,但二者糖型不同,表现功能不同,sAGP1限制血小板反应性,nAGP1限制sAGP1的促炎作用。AGP1还是免疫调节蛋白,通过调节细胞因子发挥免疫调节功能[15]。Sumanth等[16]报道,AGP1上调巨噬细胞中MAPK信号。AGP1也可与纳米粒子相互作用,既能保持蛋白质的天然活性,又可减少纳米粒子的细胞毒性[17]。此外,AGP1可作为肿瘤的诊断和预后指标,例如用于早期乳腺癌的诊断[18]和胰腺癌的预后判断[19]。Zhang等[20]用实时荧光定量PCR和酶联免疫吸附测定发现,AGP1的表达水平在喉癌组明显高于健康组,用于喉癌诊断的AUC值为0.92,灵敏度为78.80%,特异性为89.70%,并且其与喉癌进展相关,提示AGP1有潜力作为喉癌诊断的生物标志物。研究表明,AGP1的N-糖基化修饰在疾病中发生改变,具有很大的诊断和预后潜力,如用于Ⅱ型糖尿病的风险判断[21]。Ayyub等[22]也报道,糖基化的AGP1可作为肺癌潜在的血清生物标志物。
然而,关于AGP1在肺癌中的研究报道较少。为进一步研究AGP1在肺癌的表达及其临床意义,本研究通过生物信息技术分析AGP1在肺癌中的表达及与肺癌患者生存的关系,通过组织和血清样本验证AGP1在早期肺癌中的表达,最后通过分子细胞生物学技术探究过表达AGP1基因对肺癌细胞增殖的影响,以期为AGP1用于肺癌的生存评估或靶向AGP1的肺癌治疗提供科学依据。
1 材料与方法
1.1 临床样本收集和分离
所有患者及健康受试者样本采集自南京医科大学附属苏州医院,收集的临床样本信息见表1。NSCLC患者通过LDCT和组织病理学分析确诊,肺癌患者分期按照国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)的第八版TNM分期系统进行分级。本实验共收集了9例非肿瘤样本(3例健康样本和6例良性疾病患者)和6例NSCLC IA期患者的血清样本。患者血清在外科手术前收集,采集的血液样品于4℃400g离心20 min,随后将血清按每管200 μL进行分装,并立即冻存于-70℃备用。每份血清在使用前不超过两次冻融。

表1 样本信息Table 1 Sample information in this study
4对组织样本在患者手术过程中收集,癌旁组织距离癌组织2 cm。组织样本采集后液氮速冻,立即置于-70℃冻存备用。组织样本先在6孔板中用灭菌的剪刀剪碎,加入含苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)(Sigma-Aldrich公司,德国)的RIPA裂解液和陶瓷珠,随后在全自动样品快速研磨仪中研磨60 s,共研磨5次。冰上放置30 min后,12 000 r/min离心10 min,收集的上清液即为组织匀浆的蛋白质提取物。
1.2 数据库分析与统计
运用GEPIA数据库(http://gepia.cancer-pku.cn/;2020-05-07)分析AGP1基因在肺癌中的表达。运用cBioPortal数据库(http://cbioportal.org/;2020-05-07)分析AGP1基因在肺癌中的DNA改变情况。用STRING数据库(https://string-db.org/;2021-01-24)分析AGP1与其他蛋白质的相互作用关系,探究AGP1在肺癌中表达变化可能涉及的调控机制。运用蛋白质数据库(Human Protein Atlas,HPA;https://www.proteinatlas.org/;2021-01-24)和SPSS软件(v26.0)统计分析AGP1表达与早期肺癌患者生存的关系。运用Kaplan-Meier Plotter数据库(https://kmplot.com/analysis/;2021-01-24)分析AGP1表达与肺癌患者生存的相关性。蛋白质印迹条带经Image J软件进行量化分析后,再用GraphPad Prism软件(v8.0)中非配对的t检验进行统计分析,P<0.05被认为有显著差异。
1.3 目的基因AGP1的扩增
从人cDNA文库中获取AGP1的cDNA(cDNA模板由武汉大学生命科学学院孙慧教授赠送),以此为模板进行PCR扩增。上游引物为5′-TGTACCAGACTACGCTGGCCGGCCAGAATTCatggcgctgtcctgggttcttac-3′,下游引物为 5′-TCTACGTAATACGACTCACTATAGTTCTAGActaggattccccctcctcctg-3′,引物订购于武汉擎科生物科技有限公司。上游引物中引入EcoRⅠ酶切位点(GAATTC),下游引物中引入XbaⅠ酶切位点(TCTAGA)。扩增条件:98℃预变性5 min,然后以98℃变性15 s、60℃复性15 s、72℃延伸30 s进行35个循环,最后72℃延伸5 min。
1.4 过表达载体的构建
采用1%琼脂糖凝胶电泳检测PCR扩增后的产物条带,随后切胶,用胶回收试剂盒(No.D2500-01-100T,OMEGA公司,美国)回收PCR产物;同时,将带有HA标签的空载质粒pCS2-HA用EcoRⅠ、XbaⅠ于37℃双酶切过夜,回收酶切产物;双酶切产物(空载体)和基因片段(AGP1基因)用重组克隆酶(2×MultiF Seamless Assembly Mix,武汉爱博泰克生物科技有限公司)在50℃连接15 min;连接产物转化到DH5α感受态细胞中,挑取大小适宜、边缘光滑的单菌落进行菌液PCR鉴定,筛选阳性克隆,并由武汉擎科生物科技有限公司测序。将测序比对正确的克隆扩大培养,用无内毒素质粒提取试剂盒(No.CW2105,北京康为世纪生物科技有限公司)提取过表达质粒,储存于-20℃备用。
1.5 细胞培养及转染
用含10%Gibco胎牛血清的DMEM培养基培养肺癌细胞 A549、H157、SK-LU-1、H1299 和H1975,以及其他细胞如293T细胞、肝癌细胞Hep G2、宫颈癌细胞HeLa和乳腺癌细胞MCF7,培养箱条件:37℃、5%CO2,用胰酶消化传代。所有细胞均由武汉大学生命科学学院孙慧教授赠送。
收集处于对数生长期的A549细胞和H157细胞,分别重悬,A549细胞按每孔3.00×105个种植于6孔板中,H157细胞按每孔2.45×105个种植于6孔板中;待6孔板中细胞密度达到80%~90%时,用Highgene转染试剂(No.RM09014,武汉爱博泰克生物科技有限公司)进行转染。
1.6 Western-blot检测
收集6孔板中转染后的细胞,用预冷的磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤两次,加入含0.20 mmol/L PMSF的RIPA裂解液,冰上裂解30 min,随后12 000 r/min离心10 min,吸取上清至新管中。用BCA试剂盒(Thermo Fisher公司,美国)于562 nm处测定蛋白质浓度。上样的蛋白质样品经15%SDS-PAGE电泳后,在300 mA电流下转膜45 min;胶中蛋白质条带转移到聚偏氟乙烯[poly(1,1-difluoroethylene),PVDF]膜(Merck Millipore公司,德国)上后,用5%脱脂牛奶封闭过夜。洗膜3次,室温孵育AGP1抗体(1∶2 000稀释,武汉三鹰生物技术有限公司)和GAPDH抗体(1∶10 000稀释,武汉三鹰生物技术有限公司)1 h;洗膜3次,室温孵育羊抗兔HRP-IgG二抗(1∶5 000稀释,武汉三鹰生物技术有限公司)或羊抗鼠HRP-IgG二抗(1∶5 000稀释,武汉三鹰生物技术有限公司)1 h;洗膜3次后显影,用Vilber FUSION FX7化学发光成像仪拍照。
1.7 CCK-8检测细胞增殖实验
取对数生长期的A549细胞和H157细胞,重悬成单细胞悬液,种植于96孔板中,A549细胞每孔种植5.00×103个,H157细胞每孔种植4.08×103个,过夜培养12 h后转染过表达AGP1基因的质粒,继续培养24 h,然后每孔加入10 μL CCK-8试剂(Dojindo),放在培养箱中孵育,每隔30 min用酶标仪检测450 nm处的吸光度。将所测的值用Excel表按如下公式计算:细胞增殖率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,并用GraphPad Prism软件(v8.0)进行数据分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 AGP1在肺癌中的表达
采用GEPIA数据库分析AGP1在肺腺癌(LUAD)和肺鳞癌(LUSC)中的表达,结果显示,相对正常肺组织样本,AGP1的mRNA表达水平在LUAD样本(n=483)中无明显差异,但在LUSC样本(n=486)中显著下调(图1A)。进一步的临床样本Western-blot检测结果显示,与癌旁组织相比,NSCLC患者肺癌组织中AGP1蛋白的表达水平下降,但无显著差异(P=0.08)(图1B和1C);而相对于非肿瘤(non-tumor)样品,早期NSCLC(stage IA)患者血清中AGP1蛋白的表达显著下降(图1D和1E)。
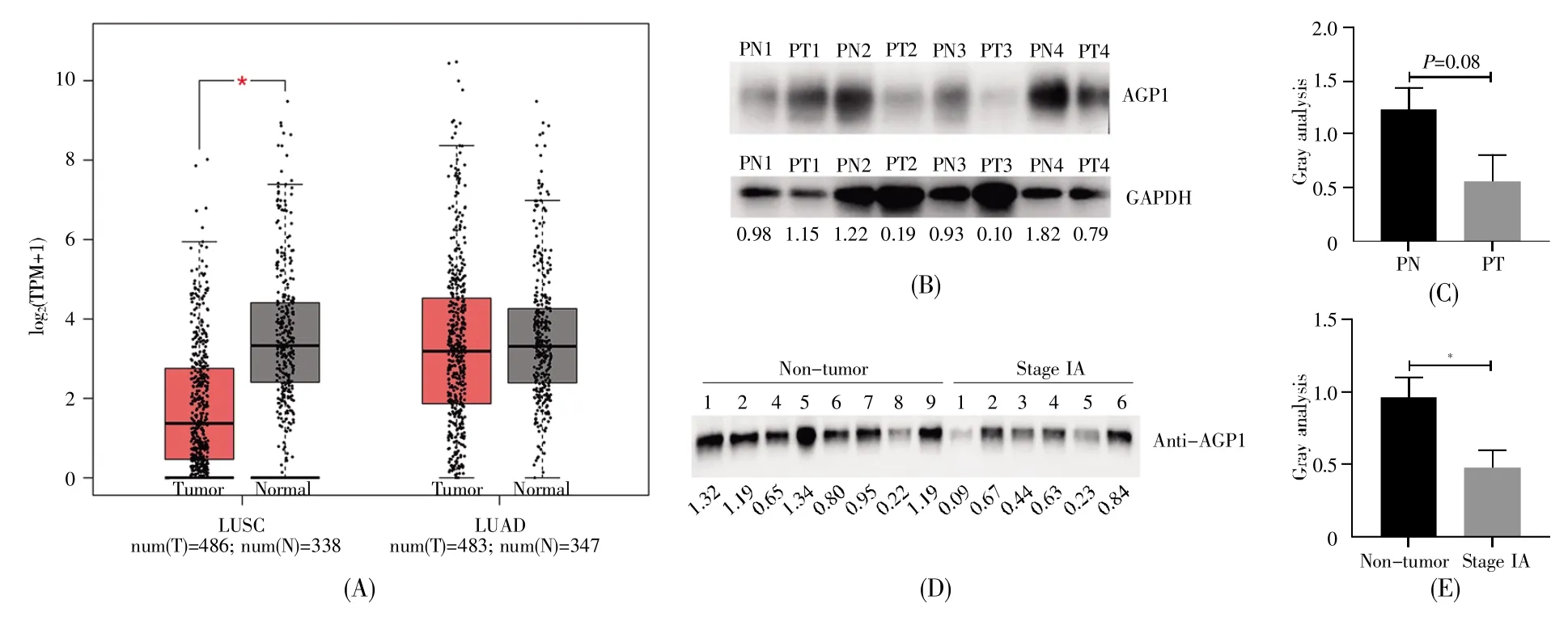
图1 AGP1在肺癌中的表达水平(A)用GEPIA数据库(http://gepia.cancer-pku.cn/)分析肺腺癌和肺鳞癌组织中AGP1 mRNA表达水平。红色表示肿瘤组织(T),灰色表示正常组织(N)。TPM,transcripts per million。参数设置:|log2(变化倍数)|阈值:1;P值阈值:0.01;log scale:是,用log2(TPM+1)表示;Jitter大小:0.4;匹配正常数据:匹配TCGA数据库中正常样本和GTEx数据;(B)蛋白质印迹法检测肺癌患者组织中AGP1蛋白表达水平。15 μg组织裂解液上样到15%的SDS-PAGE中,转膜后分别用AGP1和GAPDH一抗孵育,再用HRP-IgG二抗孵育,曝光时间5 s,最后显示的条带用Image J软件进行分析。PN,患者癌旁组织;PT,患者肿瘤组织;(C)统计分析肺癌组织中AGP1表达水平;(D)蛋白质印迹法检测肺癌患者血清中AGP1蛋白表达水平。5 μg血清蛋白上样到15%SDS-PAGE中,转膜后用AGP1一抗孵育,再用HRP-IgG二抗孵育,曝光时间5 s,最后显示的条带用Image J软件进行分析;(E)统计分析AGP1在肺癌患者血清中的表达。数据用平均值±标准误表示,*P<0.05。Fig.1 The expression level of AGP1 in lung cancer(A)Analysis of the AGP1 mRNA expression levels in LUAD and LUSC tissues by GEPIA database(http://gepia.cancer-pku.cn/).Red represents tumor(T)tissues and gray represents normal(N)tissues.TPM,transcripts per million.Parameter settings:|log2(fold change)|cutoff:1;P-value cutoff:0.01;log scale:Yes,and the log2(TPM+1)was used for log-scale;Jitter size:0.4;Matched normal data:Match TCGA normal and GTEx data;(B)Detection of the AGP1 expression levels in tissues of lung cancer patients by Western-blot.The tissue lysates(15 μg)were loaded to 15%SDS-PAGE.After transferred onto the PVDF membrane,the blots were probed with anti-AGP1 and-GAPDH antibodies,and then incubated with HRP-IgG secondary antibody.The exposure time was 5 s.Band intensities were analyzed by Image J software.PN,paracancerous tissues in patient;PT,tumor tissues in patient;(C)Statistics analysis of AGP1 expression in lung tissues;(D)Detection of the AGP1 expression levels in sera of lung cancer patients by Western-blot.5 μg of proteins from sera were loaded to 15%SDS-PAGE and transferred onto the PVDF membrane.The blots were probed with anti-AGP1 antibody,and then incubated with HRP-IgG secondary antibody.The exposure time for blots was 5 s.Band intensities were analyzed by Image J software;(E)Statistics analysis of AGP1 expression in sera of lung cancer patients.The statistics data are expressed as mean± standard error.*P<0.05.
2.2 AGP1表达与肺癌患者生存的相关性
利用HPA数据库和SPSS统计分析AGP1表达与NSCLC生存的关系,结果显示,AGP1低表达肺癌患者的存活时间要比AGP1高表达肺癌患者的存活时间更短。在肺癌发生早期(IA期),AGP1 mRNA表达水平的FPKM(fragments per kilobase million)临界值(cutoff)为0.60,高于0.60的肺癌患者(n=150)生存时间长,低于0.60的肺癌患者(n=50)生存时间短,但两者间没有显著差异(P=0.37)(图2A)。进一步利用Kaplan-Meier Plotter数据库分析AGP1表达与肺癌患者生存的关系,生存曲线显示,AGP1低表达的肺癌患者(n=1 075)的中位生存时间为64.10个月,高表达AGP1的肺癌患者(n=850)的中位生存时间为72.33个月,差异具有显著性(P=0.03)(图2B),该结果同样表明AGP1低表达的肺癌患者生存率更低。

图2 肺癌中AGP1表达与生存的相关性分析(A)AGP1表达与早期肺癌患者生存的相关性分析。数据来源于HPA数据库,用SPSS 26.0软件进行数据分析;(B)AGP1表达与所有肺癌患者生存的相关性分析,数据来源于Kaplan-Meier Plotter数据库。Fig.2 Correlation analysis of AGP1 expression and survival in lung cancer(A)Correlation analysis between AGP1 expression and the survival of early lung cancer patients.The data was derived from HPA database and analyzed by SPSS software(v26.0);(B)Correlation analysis between AGP1 expression and the survival of all lung cancer patients.The data was derived from Kaplan-Meier Plotter database.
2.3 肺癌细胞株中AGP1蛋白的表达
利用HPA数据库分析AGP1在细胞水平的表达(https://www.proteinatlas.org/ENSG00000229314-ORM1/cell;2020-05-07),结果显示,AGP1 mRNA在肺癌细胞株A431和A549中的表达水平较低。我们也检测了培养的5种肺癌细胞株A549、SKLU-1、H1299、H157和H1975,以及 4种其他非肺癌细胞株如293T细胞、肝癌细胞Hep G2、宫颈癌细胞HeLa和乳腺癌细胞MCF7中AGP1的表达水平,结果表明AGP1蛋白在上述5种肺癌细胞株中的表达量也相对较低(图3)。
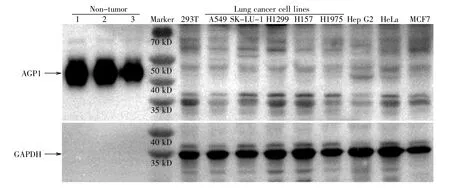
图3 蛋白质印迹法检测细胞中AGP1的表达10 μg细胞裂解液和3 μg非肿瘤样品的血清蛋白上样到15%SDS-PAGE中,转膜后分别用AGP1和GAPDH一抗孵育,再用HRP-IgG二抗孵育,曝光时间是30 s。Fig.3 Detection of AGP1 expression in cell lines by Western-blotThe cell lysates(10 μg)and sera(3 μg)from non-tumor samples were loaded to 15%SDS-PAGE.After transferred onto the PVDF membrane,the blots were probed with anti-AGP1 and-GAPDH antibodies,respectively,and then the blots were incubated with HRP-IgG secondary antibody.The exposure time was 30 s.
2.4 过表达AGP1基因对NSCLC细胞增殖的影响
将AGP1基因过表达载体pCS2-HA-AGP1分别转染到LUAD细胞A549和LUSC细胞H157中,采用Western-blot检测AGP1蛋白的表达。结果显示,与空载对照组相比,过表达转染组的AGP1蛋白表达量显著增加,表明AGP1基因在NSCLC细胞中成功实现过表达(图4A)。
运用CCK-8试剂检测AGP1过表达对A549和H157细胞增殖的影响,结果显示,过表达AGP1基因可显著抑制A549和H157细胞的增殖(图4B和4C)。

图4 过表达AGP1基因后肺癌细胞A549和H157的增殖情况(A)蛋白质印迹法检测肺癌细胞中AGP1的表达。10 μg细胞裂解液上样用于蛋白质印迹检测;(B)AGP1基因过表达24 h后CCK-8实验检测肺癌细胞A549和H157的增殖情况;(C)AGP1基因过表达48 h后CCK-8实验检测肺癌细胞A549和H157的增殖情况。采用非配对的t检验在GraphPad Prism(v8.0)中对数据进行统计分析,*P<0.05。Fig.4 The proliferation of both A549 and H157 cells after overexpression of the AGP1 gene(A)Detection of AGP1 expression in lung cancer cells by Western-blot.10 μg of cell lysates were loaded to 15%SDS-PAGE and used for Western-blot detection;(B)Detection of proliferation in A549 and H157 cells after overexpression of AGP1 for 24 h with CCK-8 kits;(C)Detection of proliferation in A549 and H157 cells after overexpression of AGP1 for 48 h with CCK8 kits.The statistics data were analyzed by unpaired t-test using GraphPad Prism(v8.0).*P<0.05.
2.5 生物信息学分析AGP1基因改变和AGP1互作蛋白质
运用cBioPortal数据库中1 144例肺癌样本分析NSCLC患者AGP1表达下降可能的原因,发现肺癌中AGP1基因总的改变率是1.10%,其中LUAD中的突变比例是0.91%,扩增比例是0.30%,缺失比例是0.30%;LUSC中的突变比例是0.41%,缺失比例是0.21%(图5A)。因此,DNA水平的改变可能是AGP1表达水平降低的原因之一。
进一步的STRING网站分析显示,AGP1蛋白可与多种蛋白质发生相互作用,包括白蛋白(albumin,ALB)、纤维蛋白原γ链(fibrinogen gamma chain,FGG)、α2-巨球蛋白(alpha-2-macroglobulin,A2M)、纤维蛋白原β链(fibrinogen beta chain,FGB)、纤维蛋白原α链(fibrinogen alpha chain,FGA)、富含组氨酸糖蛋白(histidine-rich glycoprotein,HRG)、胎球蛋白 A(human alpha-2-HS glycoprotein,AHSG)、丝氨酸蛋白酶抑制剂A1(serine protease inhibitor A1,SERPINA1)、血清类黏蛋白2(orosomucoid 2,ORM2)和触珠蛋白(haptoglobin,HP)(图 5B)。
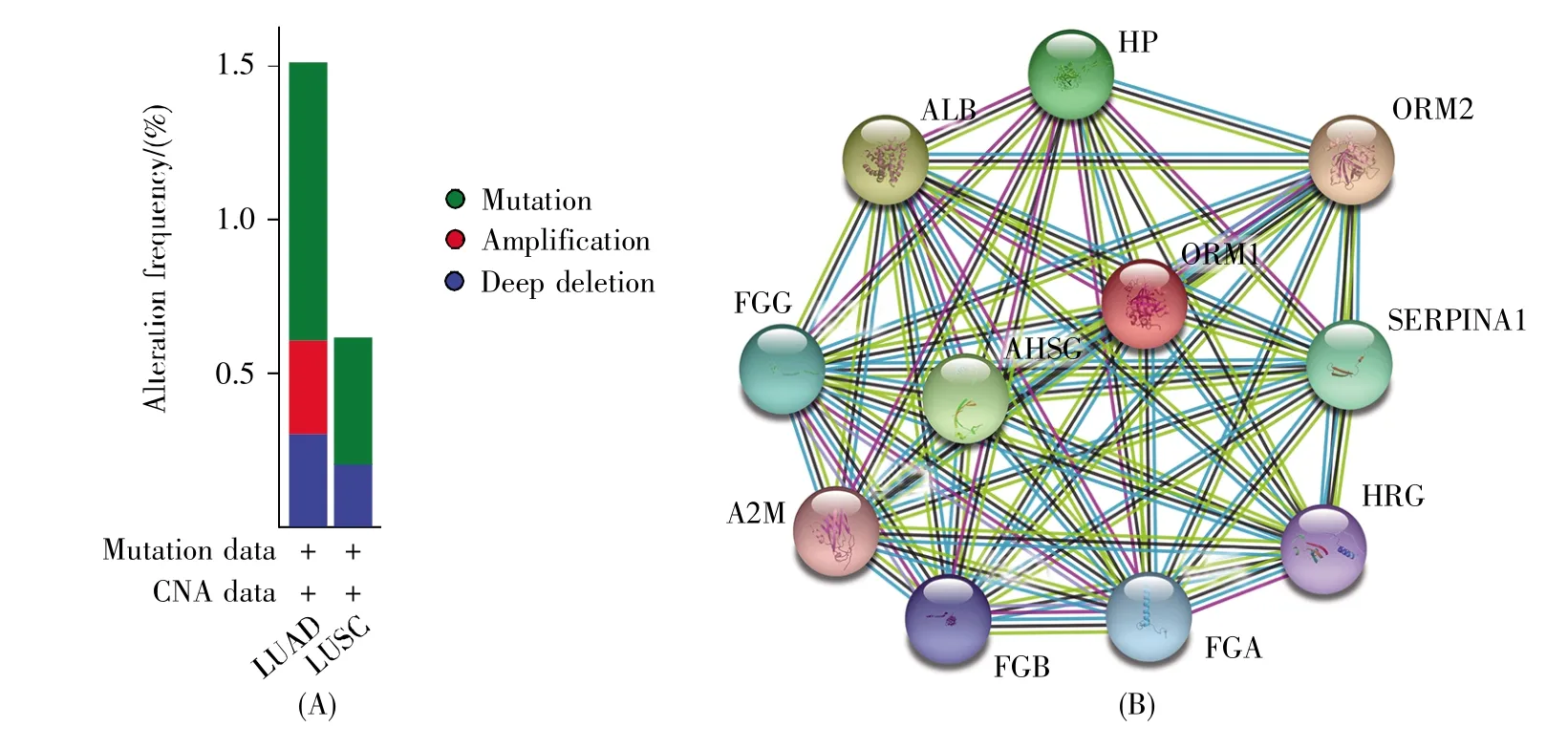
图5 AGP1基因改变和AGP1互作蛋白质分析(A)cBioPortal数据库(http://cbioportal.org/)分析AGP1基因中DNA的改变频率;(B)STRING数据库(https://string-db.org/)分析与AGP1相互作用的蛋白质网络。物种:人。Fig.5 Analysis of the AGP1 expression change and interaction protein with AGP1(A)Analysis of the DNA change in AGP1 gene in lung cancer by cBioPortal database(http://cbioportal.org/);(B)Analysis of the protein-protein network that interacts with AGP1 by STRING database(https://string-db.org/).Organism:Homo sapiens.
3 讨论
本团队前期经免疫组织化学和Western-blot实验发现AGP1蛋白在早期NSCLC组织和血清中表达水平下降,提示AGP1有望作为新的血清肿瘤标志物用于NSCLC早期诊断[7~8],但AGP1在肺癌发生中的具体作用以及可否用于肺癌预后判断还不清楚。本研究通过生物信息学分析发现,AGP1在LUSC中转录水平显著下降,在LUAD中无明显差异表达(图1A);进一步的Western-blot分析也证实,AGP1在早期肺癌组织和血清中表达下降(图1B~D)。文中cBioPortal数据库的分析结果提示,AGP1在两种肺癌中的表达水平不同可能是由于AGP1在LUAD和LUSC中的DNA改变频率不同(图5A),但这仍需临床样本进行实验验证。前期我们团队还报道了AGP1蛋白在63例晚期NSCLC患者血清中的表达水平,发现晚期时AGP1表达水平恢复[8];肺癌动物模型中的实验也证明AGP1蛋白在肺癌晚期表达水平回复[7~8],这些表明AGP1只在早期NSCLC较短的一个窗口期呈现表达水平下降,可能与肿瘤发生复杂的调控有关。此外,据研究报道,腺癌和鳞癌发展的细胞来源不同,且不同的基因通过调控不同的信号通路驱动肿瘤细胞发生[3];Li等[23]也报道,与LUAD预后相关的基因并不与LUSC预后相关,表明AGP1在LUAD和LUSC中表达变化不同可能与腺癌和鳞癌本身也有关。Luo等[10]报道,AGP1基因的表达主要受糖皮质激素、白细胞介素(interleukin,IL)-1、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IL-6等因子的综合调控。我们通过蛋白质互作分析发现,AGP1蛋白与急性时相蛋白HP、ORM2和丝氨酸蛋白酶抑制剂SERPINA1有相互作用(图5B),而HP蛋白β链被报道也可作为NSCLC的血清诊断标志物[24]。TGF-β通过诱导NSCLC的上皮-间充质转化(epithelial-mesenchymal transition,EMT),促进肿瘤的侵袭和转移[25]。Smad4是TGF-β信号通路的重要组成部分,在TGF-β诱导NSCLC的EMT中发挥重要作用[26]。我们前期研究也发现,肺癌患者血清中AGP1表达下降可能是TGF-β/Smad通路调控中性粒细胞中AGP1的表达导致[8]。因此,TGF-β/Smad通路及与HP蛋白的相互作用可能是AGP1参与肺癌发生的机制之一,但仍需更多的实验验证。总的来讲,本研究结果为AGP1参与肺癌发生提供了参考依据。
Yokobori等[27]报道,岩藻糖基化修饰的AGP可作为肺癌患者经纳武单抗免疫治疗后的预后评价指标。有研究指出,血清AGP可作为NSCLC患者服用多烯紫杉醇后中性粒细胞减少的预测指标[28];Bruno等[29]也报道,AGP可作为多烯紫杉醇治疗NSCLC患者的预后生存判断指标,可作为疗效的独立预测因子。本研究发现,AGP1的表达与肺癌患者生存有关,低表达AGP1的肺癌患者其生存率更短(图2),表明AGP1有作为肺癌预后判断指标的潜力,具有重要临床价值。
虽然肺癌的治疗效果在临床上已有较大改善,但肺癌总体生存率较低。当前,已有许多研究报道肺癌的治疗策略和疗效评价,如:血清中表面活性蛋白D(surfactant protein D,SFTPD)通过封闭配体与表皮生长因子受体(epidermal growth factor receptor,EGFR)的结合抑制EGFR信号通路,可用于临床EGFR酪氨酸激酶抑制剂治疗效果的评估指标[30~31];galectin-3可作为肺癌治疗的药物靶标[32~33];β-糖可用于原发和转移性肺癌的治疗[34]。Wang等[35~36]报道,AGP1蛋白可分别与布加替尼(brigatinib)和塞立替尼(ceritinib)相互作用,用于渐变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性的晚期NSCLC患者的治疗。本研究发现,过表达AGP1基因可抑制NSCLC细胞的增殖(图4),表明AGP1参与NSCLC的发生发展。
综上所述,AGP1在LUSC中转录水平下降,在早期肺癌组织和血清中也表达下降,这可能是其DNA频率改变或信号通路调控变化导致,但具体机制仍需进一步探究;AGP1的表达与肺癌患者生存有关,低表达AGP1的肺癌患者其生存率更短,表明AGP1有望作为肺癌预后判断指标;过表达AGP1基因可抑制NSCLC细胞的增殖,暗示AGP1有望作为肺癌治疗的一个靶点。本研究阐明了AGP1在肺癌中的表达改变、生物学功能和临床意义,为AGP1可能用于肺癌诊断、生存评估和治疗靶点提供了科学依据和数据支持。