胡蜂蜂毒肽对干燥综合征大鼠的作用探究
谢琳峰, 陈雅凝, 朱 靖, 林仁贵, 黄慧钟
( 1. 莆田学院 基础医学院, 福建 莆田 351100;2. 莆田学院附属医院 检验科, 福建 莆田 351100;3. 莆田学院附属医院 急诊重症监护科, 福建 莆田 351100 )
0 引言
干燥综合征(Sjögren's syndrome,SS) 是一种慢性炎症性自身免疫性疾病, 主要累及外分泌腺, 患者临床表现为口干、 眼干, 常并发多种器官损害[1]。 一般认为干燥综合征的发病机制包括性激素异常、 免疫功能异常以及环境、 遗传或病毒感染等[2]。 有一些研究结果表明, 肾上腺皮质激素分泌不足导致干燥综合征的发生[3]。另外有研究通过对干燥综合征患者与正常人群的血清及唾液代谢组学比较分析发现, 干燥综合征患者存在血清酪氨酸水平降低的情况[4-5]。
目前对于干燥综合征, 可使用人工唾液或人工泪液改善口干、 眼干症状, 尚无特异性治疗干燥综合征的药物, 一般采用糖皮质激素来调节患者的全身免疫状态[6]。 然而长期应用糖皮质激素具有许多不良反应, 因此需要探索是否有一些天然药物可以替代激素来治疗干燥综合征。
有研究表明蜂毒具有一定的抗炎作用[7],100 μg·mL-1胡蜂毒的抗炎效果是地塞米松的10倍[8]。 蜂毒肽(melittin,MEL)作为蜂毒的最主要成分, 大约占蜂毒的50%[9], 是蜂毒主要的药理作用及生物活性来源, 有抗肿瘤、 抗菌、 抗炎、 抗辐射、 抗癌等药理作用[10]。 研究表明用蜂毒配合中医疗法, 对干燥综合征具有一定的干预效果[11], 同时蜂毒肽可以促进肾上腺皮质激素的释放, 从而调节干燥综合征患者体内的免疫功能[12]。
本研究通过抗原诱导法建立干燥综合征大鼠模型, 用肌肉注射胡蜂蜂毒肽的方法进行干预,并用氢化可的松作为阳性对照, 期间对大鼠唾液分泌量、 泪液分泌量及血清中酪氨酸含量进行测定, 以评估胡蜂蜂毒肽对干燥综合征大鼠的治疗作用。
1 材料与方法
1.1 实验材料及试剂
健康的、 无眼部疾病的6~7 周的雄性Wistar大鼠(由上海斯莱克实验有限责任公司提供,清洁级), 质量约为200 g; 胡蜂蜂毒肽(上海阿拉丁生化科技股份有限公司,M119008), 纯度≥97% (高效液相色谱法); 氢化可的松(上海滕准生物科技有限公司,H811182); 弗氏完全佐剂、弗氏不完全佐剂、 生理盐水及BCA 微量蛋白检测试剂盒(上海碧云天生物技术有限公司); 泪液检测滤纸条(衡水格领商贸有限公司,YN-LZ-1)。
1.2 颌下腺蛋白的制备和浓度的测定
采用脱位法处死Wistar 大鼠。 切除颌下腺,切除颌下腺上的包膜和结缔组织[13]。 颌下腺组织用生理盐水清洗, 置于4℃生理盐水中, 研磨成匀浆, 并保持 4 h。 用离心机 2 000 r·min-1离心10 min, 收集上清液。 BCA 试剂盒检测颌下腺蛋白浓度, 为 16.252 mg·mL-1。
1.3 干燥综合征大鼠模型建立
所有大鼠适应性喂养3 d。 随机挑选18 只雄性的清洁级Wistar 大鼠分为: A 组, 正常组; B组, 阴性对照组; C 组, 阳性对照组(糖皮质激素组), 糖皮质激素采用氢化可的松; D 组, 蜂毒肽高剂量组; E 组, 蜂毒肽中剂量组; F 组,蜂毒肽低剂量组。 每组3 只大鼠。
A 组Wistar 大鼠不进行造模。 对其他各组大鼠, 在第1 d 和第4 d 在腹腔内进行皮下注射颌下腺蛋白和弗氏完全佐剂乳化液(各0.1 mL,颌下腺蛋白的最终浓度为0.325 mg·mL-1)的实验[14]。 第8 d, 再次在腹部皮下注射颌下腺蛋白和弗氏不完全佐剂乳化液(各0.1 mL,颌下腺蛋白的最终浓度为0.163 mg·mL-1)[15]。
1.4 给药
各组实验大鼠在造模后1 d 开始用药(肌肉注射,每组大鼠每天注射一次,连续给药3 d): A组和B 组每只大鼠按0.1 mL·kg-1·d-1注射生理盐水; C 组, 每只大鼠注射氢化可的松 15 mg·kg-1·d-1; D 组, 每只大鼠注射蜂毒肽0.437 5 mg·kg-1·d-1; E 组每只大鼠注射蜂毒肽 0.262 5 mg·kg-1·d-1; F 组, 每只大鼠注射蜂毒肽 0.087 5 mg·kg-1·d-1。[16]
1.5 各项指标的测定
治疗开始 0、 1、 2、 3 d 分别检测唾液分泌量和泪液分泌量。 唾液分泌量: 在测量前对处理过的干燥的脱脂棉球进行称重, 后将称重后的棉球塞至各大鼠口内, 待3 min 后, 称取棉球湿重。
唾液分泌量(g)=棉球湿重-棉球干重
泪液分泌量: 采用泪液分泌实验, 将泪液检测滤纸条对半折叠并切割。 需要注意是大鼠的下眼睑比人类的浅, 应将滤纸条前端剪短, 并修剪成圆弧弯曲, 将前端弯曲后置于大鼠下眼睑中,待5 min 后, 测量滤纸条的湿润长度。
血清中酪氨酸表达水平检测: 用荧光分光光度法检测大鼠血清中酪氨酸的含量。
1.6 统计学分析
采用SPSSPRO 统计软件处理, 计量资料实验数据先进行正态分布和方差齐性检验, 若满足正态分布和方差齐性, 则采用方差分析“”进行多组比较。 采用效应量化分析法对前后数据差异性进行比较。 方差不齐者, 进行多独立样本克鲁斯卡尔-沃利斯检验(Kruskal-Wallis 检验)。P<0.05, 认为差异有统计学意义。
2 结果
2.1 造模前后大鼠状态对比
造模前后大鼠体重、 唾液分泌量、 泪液分泌量对比见表1, 结果表明每组大鼠在造模后的唾液分泌量均明显低于造模前的唾液分泌量, 差异有统计学意义(P<0.05), 而造模前后大鼠的体重和泪液分泌量都无统计学差异(P>0.05)。
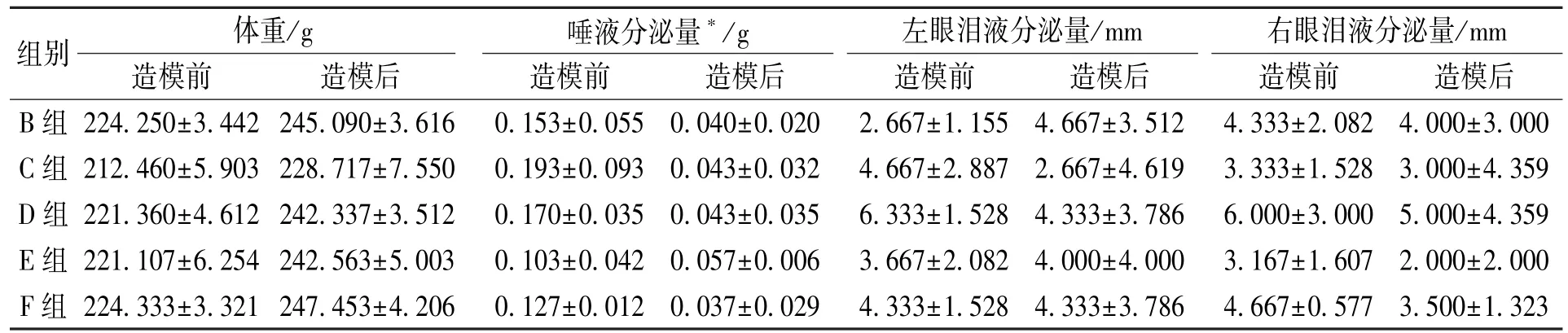
表1 造模前后大鼠体重、 唾液分泌量、 泪液分泌量对比
2.2 治疗前后唾液分泌量检测结果
治疗前后各组大鼠唾液分泌量变化情况见表2。 Kruskal-Wallis 检验结果显示, 治疗 3 d 后,与 B 组、 F 组相比, C 组、 D 组、 E 组的唾液分泌量显著增多, 差异有统计学意义(P <0.05),与A 组的唾液分泌量无统计学差异(P>0.05)。
表2 治疗前后各组大鼠唾液分泌量变化情况(,n=3)g

表2 治疗前后各组大鼠唾液分泌量变化情况(,n=3)g
images/BZ_43_472_2320_2014_2378.pngA 组 0.050±0.020 0.090±0.036 0.120±0.035 0.100±0.020 B 组 0.040±0.020 0.057±0.025 0.097±0.023 0.083±0.015 C 组 0.043±0.032 0.110±0.053 0.080±0.026 0.113±0.006 D 组 0.043±0.035 0.090±0.010 0.100±0.046 0.120±0.044 E 组 0.057±0.006 0.110±0.044 0.133±0.021 0.110±0.035 F 组 0.037±0.029 0.093±0.071 0.067±0.015 0.083±0.029
2.3 治疗前后泪液分泌量检测结果
治疗前后各组大鼠左眼泪液分泌量变化情况见表 3。 C 组、 D 组、 E 组治疗后左眼泪液分泌量显著升高, 组内差异有统计学意义(P<0. 05); A 组、 B 组、 F 组左眼泪液分泌量治疗前后无明显变化, 组内差异无统计学意义(P>0. 05)。 Kruskal-Wallis 检验结果显示, 治疗 3 d 后, D 组、 E 组左眼泪液分泌量显著高于 A 组、 B 组、 C 组、 F 组, 差异有统计学意义(P<0.05)。
表3 各组大鼠左眼泪液分泌量变化情况(,n=3)mm
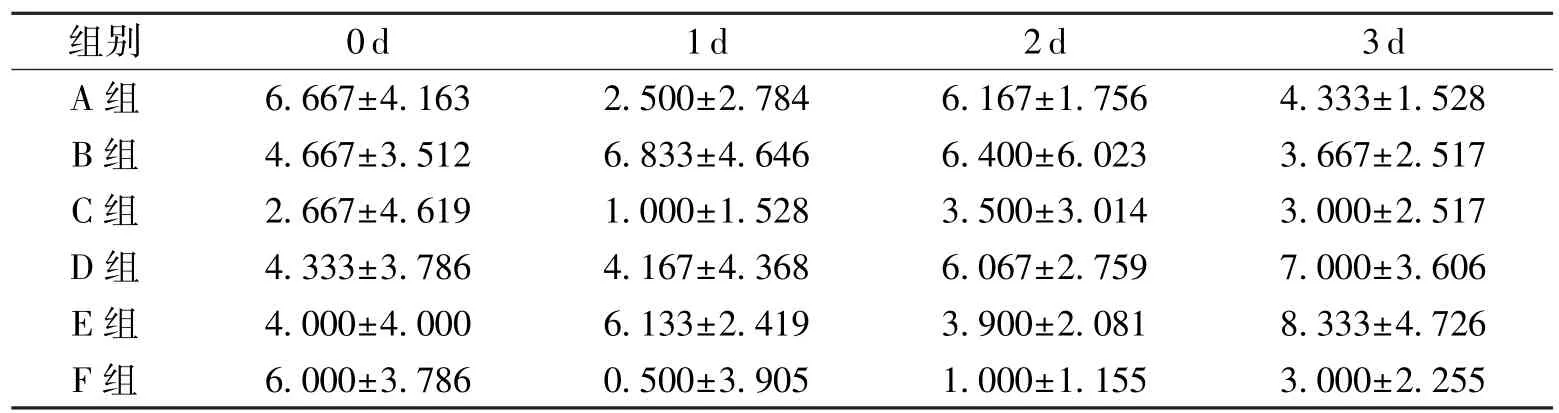
表3 各组大鼠左眼泪液分泌量变化情况(,n=3)mm
images/BZ_43_472_2803_2014_2861.pngA 组 6.667±4.163 2.500±2.784 6.167±1.756 4.333±1.528 B 组 4.667±3.512 6.833±4.646 6.400±6.023 3.667±2.517 C 组 2.667±4.619 1.000±1.528 3.500±3.014 3.000±2.517 D 组 4.333±3.786 4.167±4.368 6.067±2.759 7.000±3.606 E 组 4.000±4.000 6.133±2.419 3.900±2.081 8.333±4.726 F 组 6.000±3.786 0.500±3.905 1.000±1.155 3.000±2.255
治疗前后各组大鼠右眼泪液分泌量变化情况见表 4。 A 组、 C 组、 E 组、 F 组治疗后右眼泪液分泌量显著升高, 组内差异有统计学意义(P<0.05); B 组、 D 组治疗前后右眼泪液分泌量无明显变化, 组内差异无统计学意义(P >0.05)。Kruskal-Wallis 检验结果显示, 治疗 3 d 后, A 组、E 组、 F 组右眼泪液分泌量显著高于 B 组、 C 组、D 组, 差异有统计学意义 (P<0.05)。
表4 各组大鼠右眼泪液分泌量变化情况(,n=3)mm
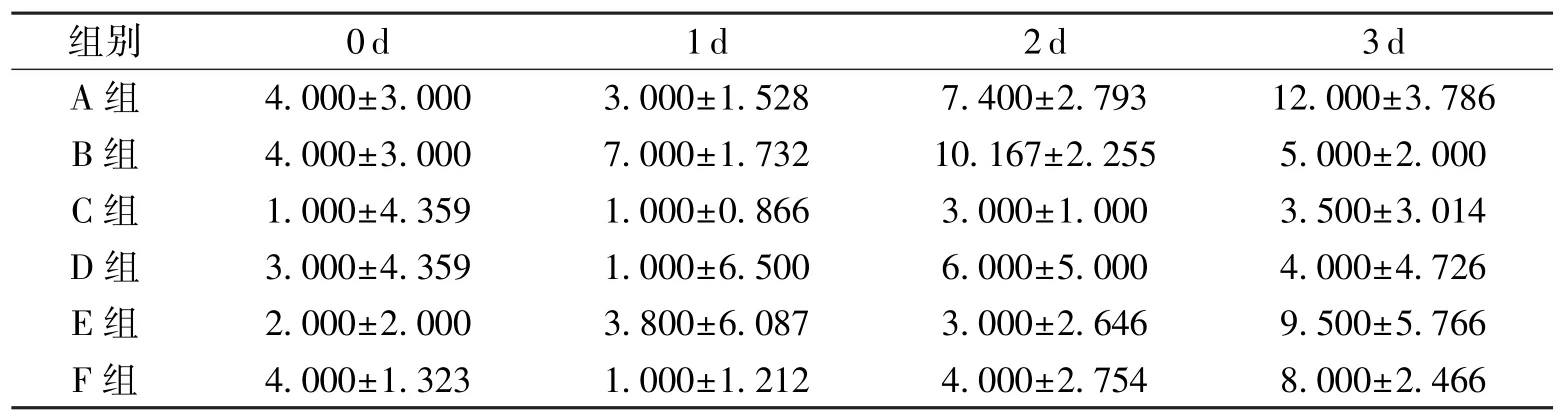
表4 各组大鼠右眼泪液分泌量变化情况(,n=3)mm
images/BZ_44_472_799_2014_857.pngA 组 4.000±3.000 3.000±1.528 7.400±2.793 12.000±3.786 B 组 4.000±3.000 7.000±1.732 10.167±2.255 5.000±2.000 C 组 1.000±4.359 1.000±0.866 3.000±1.000 3.500±3.014 D 组 3.000±4.359 1.000±6.500 6.000±5.000 4.000±4.726 E 组 2.000±2.000 3.800±6.087 3.000±2.646 9.500±5.766 F 组 4.000±1.323 1.000±1.212 4.000±2.754 8.000±2.466
2.4 血清检测结果
在治疗结束之后, 大鼠血清中酪氨酸检测结果分别为: A 组, 0.142±0.006 mg·mL-1; B 组,0.101± 0.052 mg·mL-1; C 组, 0.165± 0.024 mg·mL-1; D 组, 0.155 ± 0.009 mg·mL-1; E组, 0.156 ± 0.025 mg · mL-1; F 组, 0.115 ±0.006 mg·mL-1。 Kruskal-Wallis 检验结果显示,与B 组相比, C 组、 D 组及E 组的血清酪氨酸水平显著增高, 差异有统计学意义(P<0.05); 与A 组相比, C 组、 D 组及 E 组的血清酪氨酸水平差异无统计学意义(P>0.05)。
3 讨论
在多种因素作用下, 机体的体液免疫系统异常, 导致淋巴细胞的浸润, 使得唾液腺、 泪腺等腺体发生损害, 从而引发干燥综合征[17]。 干燥综合征常有口干、 眼干、 唾液腺肿大等临床表现, 初期症状不易察觉, 容易误诊。 糖皮质激素或免疫抑制剂可缓解干燥综合征引起的症状并降低组织器官损害, 但是病情易反复, 有局限性[18]。 在中医学里, 干燥综合征属于 “燥证”“顽痹” “燥毒证” 或 “虚劳” 的范畴[19]。 蜂毒疗法属于中医治疗的一种, 可以使患者血气通畅, 对痹症一类有良好的治疗效果, 且就治疗效果而言, 胡蜂蜂毒相比于蜜蜂蜂毒更加显著。 胡蜂毒素提取物常被用于治疗类风湿性关节炎[20]。《中华人民共和国药典》 2015 版将胡蜂酒作为民族药收载, 并注明胡蜂酒具有祛风除湿的作用[21]。 前期的文献调查研究发现, 胡蜂蜂毒肽具有抗炎、 镇痛、 调节免疫功能等作用, 可用于风湿免疫病的治疗[22], 有着良好的应用前景。
干燥综合征的造模方法有很多, 如蛋白抗原诱导的SS 模型、 多肽抗原诱导的SS 模型、 去势诱导的干眼症模型、 基因诱导的 SS 模型等[23-25], 本实验用蛋白抗原诱导法造模。 通过唾液或泪液分泌量检测判断是否造模成功。 由表1可知, 虽然造模前后泪液分泌量变化不显著, 但是唾液分泌量的差异有统计学意义(P<0.05), 可以看到经过蛋白抗原诱导的大鼠唾液分泌量明显降低, 说明蛋白抗原诱导法造模成功。 从本次实验结果看, 蛋白抗原诱导法对大鼠的唾液腺影响更大, 短期对泪腺的影响并不显著。
由表2 可知, 中剂量、 高剂量的蜂毒肽与糖皮质激素对改善口干症状的治疗效果相当, 且与B 组以及低剂量组的唾液分泌量相比都有所改善。 但是从短期来看, 改善效果不稳定, 可能是因为治疗时间过短, 治疗效果还未完全显现, 或与治疗组的大鼠体内药物代谢速度有关。
由表3、 表4 可知, E 组的左眼和右眼泪液分泌量在治疗3 d 后均显著高于 B 组、 C 组, 也高于D 组、 F 组, 说明中等剂量的蜂毒肽对眼干症状改善效果最明显。 B 组在没有治疗的情况下, 虽然3 d 的泪液分泌功能有减退的趋势, 但仍比C 组更好, 可能是由于造模方法对大鼠泪液腺的影响更小, 也可能与大鼠每天泪液分泌情况本就不稳定有关, 因此需要长期观察, 才能得到更准确的数据。
由大鼠血清中酪氨酸检测结果可知, 通过糖皮质激素与中等剂量蜂毒肽治疗后大鼠的血清酪氨酸水平显著高于B 组, 说明血清中酪氨酸水平可能影响干燥综合征的干燥症状。 虽然蜂毒肽低剂量组对提高血清酪氨酸水平并不明显, 但是随着剂量的增加, 蜂毒肽的治疗效果逐渐增强,可与氢化可的松的治疗效果等同, 但在达到某种剂量后, 蜂毒肽对血清酪氨酸水平影响不会因剂量的增大而升高。
本实验的局限性是未能长期观察大鼠的治疗效果, 而且由于条件的限制, 未能检测治疗前大鼠血清酪氨酸水平, 包括 TNF-α、 血清 lgG、 5-羟色胺等标志物[26], 需要改进实验设计、 提高检测能力来进一步研究。
4 结论
本实验采用同种鼠颌下腺蛋白抗原诱导大鼠干燥综合征造模, 同时分组进行不同剂量胡蜂蜂毒肽的干预, 并与阴性、 阳性对照组比较, 推测中等剂量的胡蜂蜂毒肽可能通过上调血清中的酪氨酸水平来改善干燥综合征大鼠的口干症状。 但本实验样本量偏少, 因此需要更多的样本量来进一步验证。

