慢性阻塞性肺疾病-阻塞性睡眠呼吸暂停低通气综合征重叠综合征患者认知功能障碍的相关因素分析
方庆娟, 李 燕, 李 娜, 王 珅, 李新鹏, 崔彩梅, 李有香, 任文娟
(河北省张家口市第一医院, 河北 张家口, 075000)
慢性阻塞性肺疾病-阻塞性睡眠呼吸暂停低通气综合征(COPD-OSAHS)是临床常见的重叠综合征之一,同时具备COPD与OSAHS的临床特征,相比于单纯的COPD或OSAHS,COPD-OSAHS重叠综合征患者COPD急性加重发作次数增加,夜间低氧症更为严重[1-2]。目前研究[3-4]证实,COPD与OSAHS均能影响患者的认知功能,而COPD-OSAHS重叠综合征患者随着低氧血症和睡眠紊乱加重,认知功能障碍(CI)发生率显著增加,严重影响患者生活质量,甚至增高了住院和死亡风险。研究[5]表明,炎症与CI密切相关。内皮素-1(ET-1)是目前已知最强的缩血管物质,能通过促进其他促炎介质的释放参与炎症反应[6]。中性粒细胞明胶酶相关脂质运载蛋白(NGAL)是一种脂质运载蛋白,与炎症和免疫应答的发生发展相关[7]。研究[8-9]表明,血清ET-1、NGAL水平升高与阿尔茨海默病患者认知功能有关。本研究分析COPD-OSAHS重叠综合征患者血清ET-1、NGAL水平变化与CI的关系,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2021年1月—2022年1月河北省张家口市第一医院收治的87例COPD-OSAHS重叠综合征患者为COPD-OSAHS组,其中男56例,女31例; 年龄35~82岁,平均(65.24±12.33)岁。另选取62例COPD患者为COPD组,其中男40例,女22例; 年龄35~82岁,平均(64.18±11.87)岁。2组患者一般资料比较,差异无统计学意义(P>0.05)。纳入标准: ① COPD符合《慢性阻塞性肺疾病基层诊疗指南(实践版·2018)》[10]诊断标准者; ② OSAHS符合《成人阻塞性睡眠呼吸暂停基层诊疗指南(实践版·2018)》[11]诊断标准者; ③ 年龄≥18岁者。排除标准: ① 合并肺结核、哮喘、肺肿瘤等其他肺部疾病者; ② 合并痴呆、阿尔茨海默病等认知损害疾病者; ③ 颅内感染或创伤者; ④ 发病前存在记忆力、计算力、定向力减退等认知功能损害者; ⑤ 中枢性、混合性OSAHS者; ⑥ 中枢神经损伤者; ⑦ 造血、免疫系统损害者; ⑧临床资料不全者,文盲、严重沟通障碍或依从性较差者; ⑨ 合并心、肝、肾等其他重要脏器功能损害者; ⑩ 长期滥用药物或有药物依赖史者。本研究患者及家属均知情研究内容,本研究经医院伦理委员会批准(LW2022003)。
1.2 方法
1.2.1 资料收集: 收集COPD-OSAHS重叠综合征患者临床资料,包括性别、年龄、体质量指数(BMI)、文化程度、吸烟史、既往史、COPD病程、OSAHS病程。COPD-OSAHS重叠综合征患者入院后24 h内评估COPD与OSAHS程度。COPD程度分级: 轻度为第1秒用力呼气容积(FEV1)≥80%; 中度为FEV1>50%~<80%; 重度为FEV1≤50%[10]。OSAHS程度分级: 轻度为呼吸暂停低通气指数(AHI)为5~15次/h, 最低血氧饱和度(LSaO2)为85%~90%; 中度为AHI>15~30次/h, LSaO2为80%~<85%; 重度为AHI>30次/h, LSaO2<80%[11]。
1.2.2 血清ET-1、NGAL水平检测: 采集2组研究对象入院次日清晨空腹静脉血5 mL, 1 000×g离心10 min, 取上层血清,采用酶联免疫吸附法(ELISA)检测血清ET-1、NGAL水平,所有操作严格按照试剂盒(上海酶研生物科技有限公司,货号为EK-H11291、EK-H12141)说明书进行。
1.3 CI诊断和分组
COPD-OSAHS组和COPD组在入院后24 h内采用中文版蒙特利尔认知评估量表(MoCA)评估CI情况,包括定向力、计算、抽象思维、视结构技能、语言、记忆、执行功能、注意与集中共8个认知领域,总分30分, <26分提示存在CI[12]。根据是否存在CI将COPD-OSAHS组患者分为CI组(n=41)与非CI组(n=46)。
1.4 统计学分析
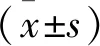
2 结 果
2.1 COPD-OSAHS组与COPD组MoCA评分比较
COPD-OSAHS组MoCA各项评分及总分均低于COPD组,差异有统计学意义(P<0.01), 见表1。

表1 COPD-OSAHS组与COPD组MoCA评分比较 分
2.2 COPD-OSAHS组与COPD组血清ET-1、NGAL水平比较及相关性分
COPD-OSAHS组血清ET-1、NGAL水平分别为(52.81±9.95) pg/mL、(7.63±1.62) ng/mL, 高于COPD组的(27.84±6.98) pg/mL、(3.13±1.19) ng/mL, 差异有统计学意义(P<0.01)。Pearson相关系数显示, COPD-OSAHS重叠综合征患者血清ET-1、NGAL水平与MoCA评分呈负相关(r=-0.622、-0.613,P<0.001)。
2.3 COPD-OSAHS重叠综合征患者CI的单因素分析
与非CI组患者比较, CI组患者年龄更大, BMI≥28 kg/m2、吸烟、COPD病程≥5年、重度COPD、OSAHS病程≥5年、重度OSAHS患者比率更高,ET-1、NGAL水平更高,差异有统计学意义(P<0.05)。见表2。
2.4 COPD-OSAHS重叠综合征患者CI的多因素Logistic回归分析
以年龄、BMI(≥28 kg/m2=1, <28 kg/m2=0)、吸烟史(有=1,无=0)、COPD病程(≥5年=1, <5年=0)、COPD程度(重度=1, 轻中度=0)、OSAHS病程(≥5年=1, <5年=0)、OSAHS程度(重度=1,轻中度=0)、ET-1、NGAL为自变量,以是否存在CI(是=1, 否=0)为因变量,建立多因素Logistic回归模型。结果显示,年龄、BMI≥28 kg/m2、重度COPD、OSAHS病程≥5年、重度OSAHS、ET-1、NGAL是COPD-OSAHS重叠综合征患者CI的独立危险因素(P<0.05)。见表3。

表2 COPD-OSAHS重叠综合征患者CI的单因素分析
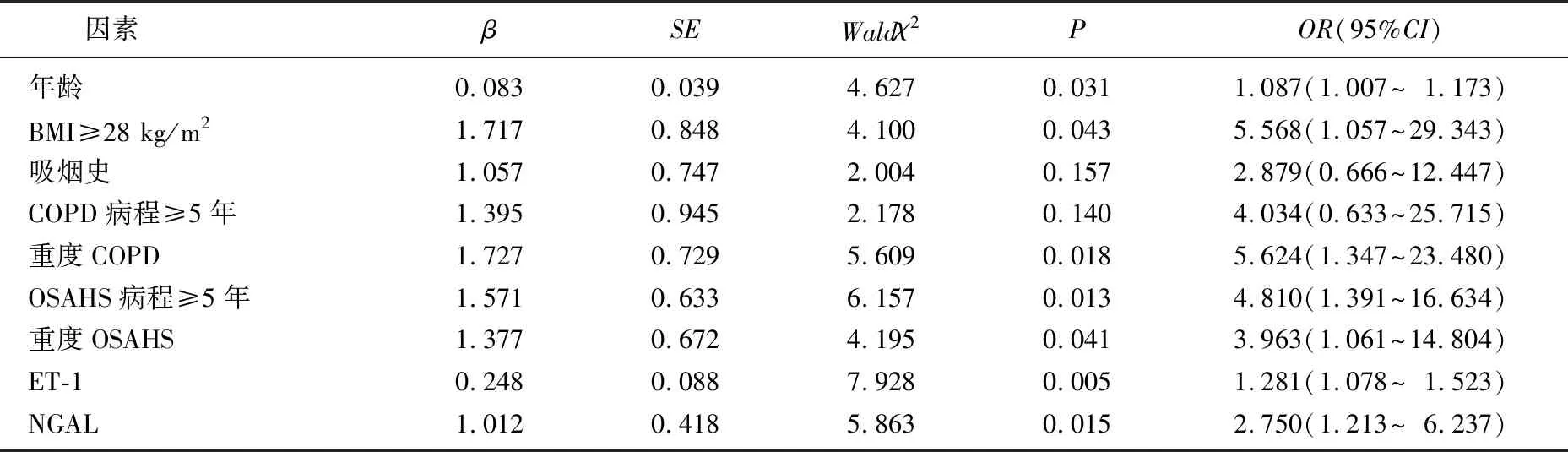
表3 COPD-OSAHS重叠综合征患者CI的多因素Logistic回归分析
2.5 血清ET-1、NGAL水平预测COPD-OSAHS重叠综合征患者CI的价值
ROC曲线显示,血清ET-1、NGAL联合预测COPD-OSAHS重叠综合征患者CI的AUC大于2个指标单独预测的AUC, 差异有统计学意义(Z=2.039、2.347,P=0.041、0.019)。见表4、图1。

表4 血清ET-1、NGAL水平预测COPD-OSAHS重叠综合征患者CI的价值

3 讨 论
COPD与OSAHS均作为呼吸系统疾病,既可单独发生,也可共同存在[10-11]。COPD-OSAHS重叠综合征患者存在2种疾病低氧病理生理过程的重叠,即使在睡眠期间可也发生低于起始基线的间歇性氧饱和度降低,严重的低氧血症可引起促炎介质大量释放,并引起中枢系统代谢紊乱和大脑半球损害,导致认知功能损害,严重者可进一步发展为阿尔茨海默病,明显降低患者生活质量[12-14]。本研究结果显示, COPD-OSAHS组MoCA各项评分和总分均显著降低,根据MoCA评分<26分定义为CI, 本组患者CI发生率为47.13%(41/87), 与谢星等[15]报道的48.15%接近,说明COPD-OSAHS重叠综合征患者存在明显的CI。
ET-1主要由内皮细胞分泌,在身体各个器官中,以肺部的表达水平最高,集中于肺血管平滑肌、气道和血管内皮,由肺和肝、肾清除,作为一种血管活性肽,ET-1能以自分泌和旁分泌的方式与内皮细胞或血管平滑肌中ET受体相互作用,调节血管收缩[6]。同时, ET-1也参与炎症反应,能通过促进血管细胞黏附分子表达和中性粒细胞活化,并促进白细胞黏附于血管内皮向炎症部位迁移,激活一系列炎症级联反应,放大炎症反应[16]。研究[17-18]报道, ET-1介导的炎症反应与COPD和OSAHS患者的肺毛细血管损伤和肺泡上皮细胞损伤等有关。ABDUL Y等[19]研究报道, ET-1能将小胶质细胞激活为促炎性M-1样表型,导致糖尿病后CI。因此作者推测ET-1可能与COPD-OSAHS重叠综合征患者CI有关。本研究结果显示, COPD-OSAHS组血清ET-1水平显著升高,分析是COPD-OSAHS重叠综合征存在2种疾病低氧病理生理过程的重叠,肺部损伤更严重,随着肺血管床通透性增加,导致ET-1大量渗漏至血液循环中。同时,肺作为ET-1清除途径之一, COPD-OSAHS重叠综合征严重损伤状态下,肺血管代谢功能障碍导致ET-1清除减少,导致血清ET-1水平升高。本研究结果显示, CI组血清ET-1水平显著高于非CI组,随着MoCA评分降低而升高,多因素Logistic回归分析显示,在排除其他因素影响后,高血清ET-1水平仍然是COPD-OSAHS重叠综合征患者CI的独立危险因素,说明ET-1与COPD-OSAHS重叠综合征患者CI密切相关,这与胡玲玲[20]研究报道血清ET-1水平是COPD-OSAHS重叠综合征患者CI下降的影响因素的结果一致。
海马体是与学习和记忆功能相关的大脑区域, COPD-OSAHS重叠综合征患者严重低氧血症导致的海马神经元细胞炎症是CI发生的重要原因[21]。神经血管单元内的神经元需要与内皮细胞相互依赖才能发挥相应作用,研究[22]表明, ET-1能通过激活NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体、胱天蛋白酶3等导致海马神经元细胞炎症,阻断ET-1能通过调节脑源性神经营养因子保护海马体。研究[23]还发现,ET-1引起的强烈血管收缩能降低海马中记忆缺陷和活动依赖性蛋白质翻译,导致记忆缺陷。中性粒细胞是一种帮助抵抗感染和愈合损伤的白细胞,其内包含许多能将细胞杀死的酶和蛋白,在炎症反应过程中会不受控制的释放以执行生物防御功能。NGAL是活化中性粒细胞释放的一种急性期糖蛋白,作为天然免疫的重要组成部分, NGAL在炎症过程中会大量表达[24]。本研究结果显示, COPD-OSAHS组血清NGAL水平显著升高,分析与炎症参与COPD与OSAHS病理过程有关, COPD-OSAHS重叠综合征作为一种重叠的病理生理过程,严重的低氧血症诱导的炎症反应更严重,外周中性粒细胞大量活化,引起NGAL大量释放。本研究结果显示, CI组血清NGAL水平显著高于非CI组,随着MoCA评分降低而升高,是COPD-OSAHS重叠综合征患者CI的独立危险因素,说明NGAL与COPD-OSAHS重叠综合征患者CI密切相关,其机制可能与NGAL参与海马神经元细胞炎症有关。
研究[25]显示, NGAL水平升高能引起老年脓毒症患者海马炎症,降低患者物体识别能力。在红藻氨酸诱导的癫痫小鼠模型中,敲除NGAL能通过抑神经炎症、氧化应激和铁死亡抑制小鼠神经元细胞死亡[26], 这与胡玲玲[20]研究报道血清NGAL水平不能独立影响COPD-OSAHS重叠综合征患者CI结果不一致,考虑与不同病例人群和不同研究方法有关。与本研究一样,胡玲玲[20]研究也根据MoCA评分<26分定义为CI,但该研究采用多元线性回归分析血清NGAL水平与COPD-OSAHS重叠综合征患者CI的关系,可能是MoCA评分作为分类变量,与连续变量的结果不一致。本研究结果还显示,除了COPD、OSAHS病程或病情严重程度能影响COPD-OSAHS重叠综合征患者CI外,年龄和BMI≥28 kg/m2也是COPD-OSAHS重叠综合征患者CI的独立危险因素,分析是随着年龄增加,神经元细胞会逐渐衰弱,进而影响认知功能。本研究评估了血清ET-1、NGAL水平对COPD-OSAHS重叠综合征患者CI的预测价值, ROC曲线分析显示,血清ET-1、NGAL水平单独与联合预测COPD-OSAHS重叠综合征患者CI的AUC分别为0.779、0.745、0.858,说明血清ET-1、NGAL水平均有助于COPD-OSAHS重叠综合征患者CI的预测,但联合检测能提高CI预测价值。
综上所述,COPD-OSAHS重叠综合征患者存在明显的CI, 血清ET-1、NGAL水平升高与COPD-OSAHS重叠综合征患者CI密切相关,并有助于COPD-OSAHS重叠综合征患者CI预测。

