不明病因儿童急性重症肝炎:数据及认识更新
张荔、谢黎、李昕玥、丁佳、邓强,3、吴健,4,5
1.复旦大学基础医学院病原生物学系、卫健委、教育部医学分子病毒重点实验室,上海200032; 2.上海市静安区中心医院消化科,上海200040; 3.上海市重大传染病和生物安全研究院,上海200032; 4.复旦大学上海医学院上海市肝病研究所; 5.复旦大学附属中山医院消化科,上海 200032
自英国首次通报苏格兰地区10例不明原因儿童急性重症肝炎病例以来,散发于全球各国的病例均在攀升,截至2022年5月初,已有多名患儿因重症肝衰竭需行肝移植治疗。目前初步排除肝炎病毒、药物和毒素等致病因素,结合流行病学调查及临床症状分析推测,感染因素可能是导致此次不明原因儿童急性重症肝炎发病的首要原因。病原检查结果表明,全球15个国家半数以上病例腺病毒检测阳性,在英国该检出率更是达到70%以上,经血清型分析18名患儿被鉴定为腺病毒41型(HAdV-41),然而仅在全血标本中检出HAdV-41,肝脏未检出腺病毒颗粒[1]。HAdV-41感染常表现为急性胃肠道炎及呼吸道症状,在免疫功能正常的人群中鲜有肝衰竭报道。春季正值腺病毒流行高峰期,腺病毒的检出似乎并不能作为此次不明原因儿童重症肝炎的病因诊断证据。有学者指出,新冠病毒超抗原介导的免疫激活可能与此次不明原因儿童重症肝炎发病相关[2]。基于先前报道[3],本文旨在根据近期信息更新对本病的认识。
1 流行病学分析
2022年4月5日,英国卫生安全局(UK Health Security Agency, UKHSA)向世界卫生组织(World Health Organization, WHO)和《国际卫生条例》(International Health Regulations, IHR)通报10例既往健康的10岁以下儿童不明原因急性重型肝炎病例,已排除甲、乙、丙、丁、戊5种肝炎病毒和其他可能导致急性肝炎的病毒感染[4]。截至5月30日,全球已有33个国家报告了至少650例疑似病例,其中英国155例,美国216例,日本31例,西班牙34例,意大利29例,比利时14例,以色列12例,且病例数呈持续增长趋势[5-7]。在这650例病例中,至少38例(6%)已接受了肝移植,累计报告死亡病例9例(1.4%)[7]。患儿主要表现为黄疸、呕吐和嗜睡,伴白陶土样便、皮肤瘙痒和恶心、腹泻等消化道症状,而发热和呼吸道症状少见,实验室检查天冬氨酸转氨酶(AST)或丙氨酸转氨酶(ALT)高于500 IU/L。除苏格兰2例病例在流行病学上存在关联外,其他病例多为散发,英国早期流行病学调查也未发现明确的旅行史、食物、药物和毒物等共同暴露因素[8]。目前,儿童急性重型肝炎暴发原因和发病机制仍在调查中。
为了更好地支持不明原因肝炎的流行病学调查,WHO欧洲区域办事处和欧洲疾病预防与控制中心(European Centre for Disease Prevention and Control, ECDC)联合建立了欧洲监测系统(The European Surveillance System, TESS),以统计英国和其他欧盟/欧洲经济区(EU/EEA)国家的报告病例[9]。ECDC使用了英国的诊断标准将病例分为确诊、可疑和流行病学相关3类(见表1)。截至5月31日,WHO公布了650例可能病例,在EU/EEA有信息的169例病例中,23例(13.6%)收入重症监护病房,131例中有20例(15.2%)因急性肝功能衰竭接受了肝移植(见表2、图1)。

表1 不明原因儿童急性重型肝炎诊断标准[6]
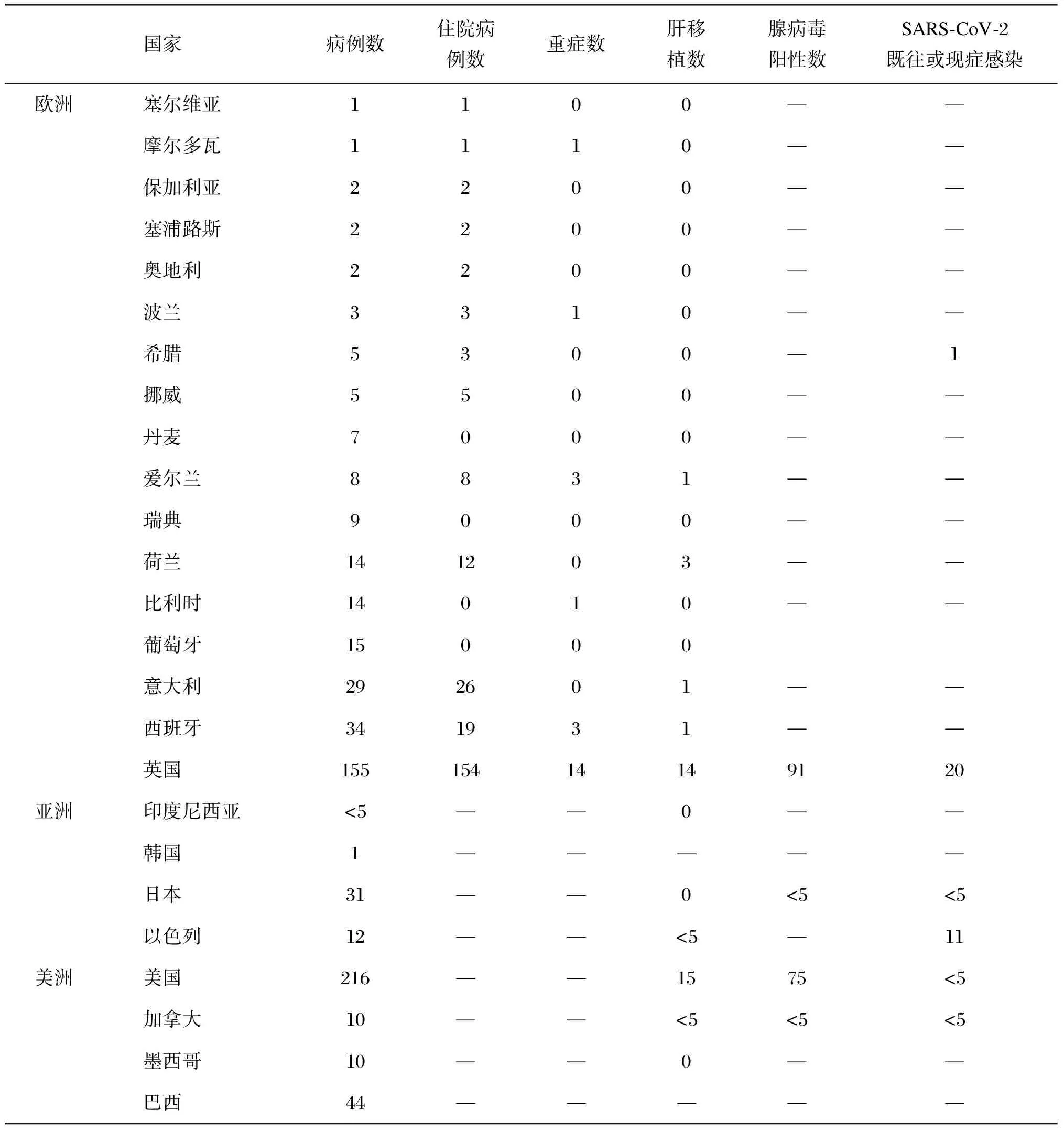
表2 全球主要国家不明原因儿童急性重型肝炎病例统计[9]

图1 不明病因儿童急性重症肝炎可能病例地区分布(截至2022年5月31日,n=650)[7]
2 病因分析及病理表现
27个国家的病例血清中均未检测到甲、乙、丙和戊型等可致急性肝损伤的肝炎病毒颗粒,但151例受检病例中有90例(59.6%)呼吸道、粪便、血清或全血样本中,聚合酶链式反应(polymerase chain reaction,PCR)检出人腺病毒(human adenoviruses,HAdV)为阳性[9]。在WHO最初发布的调查报告中,75.5%的英格兰病例以及50%的苏格兰病例中均检测到了腺病毒,这74例中有18例被鉴定为F亚型HAdV-41,20例检测到SARS-CoV-2,并有19例为SARS-CoV-2与HAdV合并感染[10-11]。美国亚拉巴马州9例患儿血液标本均检测到腺病毒感染,其中6例儿童肝穿病理报告显示不同程度的急性肝炎,呈小叶性、叶间或汇管区炎症。部分伴有毛细胆管性胆汁淤积,可见点状肝细胞坏死,无肝纤维化征象,也未见到腺病毒肝炎特征性的融合性坏死(confluent necrosis)[12]。而其他国家公布腺病毒的感染率达45%~77%,并且接受肝移植患儿体内腺病毒DNA水平是未接受肝移植患者的12倍。由此推测,不明原因肝炎可能与腺病毒感染相关,但也不排除与严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)相关的可能性[13]。
2.1 人腺病毒病原学
人腺病毒属于腺病毒科,哺乳动物腺病毒属,是一种无包膜球形DNA病毒颗粒,直径约90 nm[14]。主要由蛋白质衣壳及壳内包裹的线状双链DNA(35~36 kb)组成。衣壳呈规则20面体,含240个六邻体蛋白、12个五邻体,12根纤毛及其他结构蛋白(Ⅵ, Ⅷ, Ⅸ, Ⅲa和Ⅳa2等)。纤毛顶端形成头节区,使整个病毒颗粒外观形似通信卫星样结构(见图2)。腺病毒线性双链DNA基因组与蛋白V、VII和X紧密结合,形成病毒核心。DNA两末端有约36~200 bp的反向末端重复序列(ITR)封闭,其5’端以共价键与一个末端蛋白(TP)结合, 两者皆与腺病毒复制密切相关[15]。根据复制时限将腺病毒基因组分为编码早期(E)基因(E1~E4),延迟早期基因IX和IVa2,以及晚期(L)基因(L1~L5)。早期基因编码非结构蛋白,参与病毒DNA复制和转录的调节。晚期基因通常编码病毒结构蛋白(见图2)。已有证据表明,直接用腺病毒蛋白(E1B蛋白、六邻体蛋白、E3A糖蛋白和纤毛)刺激外周血T细胞,能诱导T细胞的增殖和活化[16]。其中,六邻体蛋白多肽更能触发T细胞应答。此外,腺病毒五邻体蛋白上也有T细胞所识别的多肽,该多肽与人组织相容性抗原结合成复合物,T细胞受体通过识别该复合物杀伤腺病毒感染细胞[16-19]。腺病毒的生物学特性决定了其对脂溶性消毒剂耐受,采用含过氯乙酸制剂或高温高压是有效的杀灭方法。

图2 人腺病毒基因组和编码蛋白
HAdVs感染宿主细胞分两步骤:首先纤毛头节区与细胞表面受体特异性结合,将病毒颗粒束缚在细胞表面,随后五邻体蛋白碱基构成的精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid,RGD)基序与细胞表面整合素相互作用,介导病毒内吞[20]。其中,纤毛头节区与细胞表面受体分子的相互作用决定了腺病毒的组织嗜性。至少有5种细胞表面受体参与病毒的黏附和进入宿主细胞,包括:柯萨奇病毒和腺病毒受体(coxsackie and adenovirus receptor,CAR)[21-22]、CD46[23]、桥粒芯糖蛋白-2(desmoglein-2,DSG-2)[24]、多聚糖GD1a[25]和聚唾液酸(polysialic acid)[26]。HAdV受体的多样性决定了其广泛组织嗜性。腺病毒传播主要通过接触被污染的物品或食物,可经呼吸道、消化道传播,导致呼吸道感染、眼结膜炎、急性胃肠炎等,也可引起心肌炎、急性肾炎、脑膜脑炎。根据HAdVs的生物学特性,血清中和试验、全基因序列测定和生物信息学分析,现已鉴定出至少113种基因型和52种血清型,分为A~G 7个亚属(见表3)[27]。

表3 不同型别腺病毒的组织嗜性及相关临床疾病
2.2 病因推测
2.2.1 可能存在尚未鉴定的变异性腺病毒由于HAdV的组织嗜性不同,感染后会引起广泛的临床表现,常见临床特征包括角膜炎(5, 8, 19及37型)、急性呼吸道症状(1~5, 7, 14及21型)和胃肠道症状等(31, 40及41型)[28-30],然而肝脏很少受累(见表3)。HAdV常表现为地方性稳态流行,在部分高流行地区感染率可达90%[31]。对于免疫健全个体,HAdV感染常为自限性,而对于免疫功能低下者,HAdV感染可能导致多器官受累。在1960—2012年报道的89例HAdV肝炎病例中,48%为肝移植受者,21%为骨髓移植受者,12% 接受过化疗,6%患有严重联合免疫缺陷[32]。此外,据斯坦福大学医学中心1995—2016年收集到的12例腺病毒肝炎病例报道,8例儿童患者中有7例接受了肝移植,1例正在接受化疗[33]。由此表明,HAdV肝炎主要发生于免疫低下患者,但仍有病例报道称毒性更强的类型(尤其是7型)可导致免疫功能健全儿童出现呼吸衰竭、休克和肝炎[34]。
本次不明原因急性重症肝炎检出HAdV-41型阳性者为免疫功能正常儿童,无免疫功能低下病史。然而,腺病毒可通过基因重组改变组织嗜性,增强其毒力及感染力。我国流行的HAdV-55是由HAdV-14与HAdV-11重组互换而成,导致了严重呼吸道感染疫情的爆发[35]。由此推测,本次不明原因肝炎疫情HAdV-41型若发生突变重组,则可能会引起组织嗜性及致病性的改变。然而,在本次疫情中肝脏活检未发现腺病毒感染的证据,如包涵体、免疫组化/原位杂交显示HAdV阳性、抗体阳性等,仅在全血中检测出低载量的腺病毒,甚至不足以做全基因组检测[1]。因此,目前无法判断此次检出的HAdV-41是否发生了重要的基因突变或重组[36]。
2.2.2 某些辅助因素诱导病毒嗜性改变由于隔离政策的实施,英国在2020年SARS-CoV-2大流行早期,即2020年第15~35周腺病毒感染率显著低于历年水平,此后社区中腺病毒感染,尤其是在儿童粪便样本中的检出率显著增加[1]。由此推测,严格的防护措施可能使得儿童社交疏离,缺乏预存免疫力,导致部分儿童对某些血清型腺病毒的暴露显著减少,从而增加了易感性。然而,出现不明原因肝炎疫情的美国亚拉巴马州并未实施过封城政策,这使得社交疏离致免疫力改变从而对腺病毒易感的说法存疑。另有推测提出,在既往感染SARS-CoV-2后续感染腺病毒或其他病毒,或SARS-CoV-2与腺病毒或其他病毒共感染的情况下,产生了不同寻常的免疫反应或临床表现[2]。在2019冠状病毒病大流行的背景下,18%的英国病例中发现了SARS-CoV-2感染[1],目前正在开展的血清学调查可能会发现更多急性重型肝炎儿童有SARS-CoV-2既往感染史。日本学者新近研究发现,在报告此病例的国家中,2021年12月—2022年4月底SARS-CoV-2奥密克戎(B.1.1.529)亚毒株感染基数为440万~1 190 万人次,而无此疾患的国家该毒株的感染数为50万~55万人次,显著低于发生该疾患的国家,提示奥密克戎亚毒株感染可能与该疾患的发生具有一定的关联性[37]。12名以色列患儿者中11人在最近数月感染过SARS-CoV-2[38]。一项回顾性研究表明,平均每 1 000 000 名SARS-CoV-2感染患者就中有5.1人并发儿童多系统炎症综合征(multisystem inflammatory syndrome,MIS-C)[39]。MIS-C临床症状与中毒性休克相似,主要表现为持续性发热、低血压、多器官受累以及炎性标记物增高。MIS-C的发生可能与SARS-CoV-2超级抗原(superantigen, SAg)序列有关。SARS-CoV-2刺突蛋白S1-S2切割位点附近结构域与金黄色葡萄球菌肠毒素B(staphylococcal enterotoxin B, SEB)氨基酸序列及构象相似[40],且重症患者表现出与超抗原激活一致的T细胞受体可变区β(T-cell receptor variable β, TCR Vβ)偏移。细菌 SAg 通过不依赖于互补决定区 3(CDR3-independent)的方式,在其可变结构域与 TCR 的特定 β 链结合来激活 T 细胞,具有特定 Vβ 链和不同抗原特异性的 T 细胞在暴露于 SAg 后患者的 TCR 库中过多。因此,TCR Vβ偏移可作为SAg介导T细胞激活的直接证据[41]。由于SAg可不依赖主要组织相容性复合体(major histocompatibility complex, MHC)抗原提呈激活T细胞,因此低浓度的SAg即可激活大量非特异性T细胞,随即引起细胞因子风暴造成机体损伤。此外,儿童鼻拭子PCR实验结果转阴周期与成人无差异,而肛拭子转阴周期却较成人长1倍余[42],这可能是由于儿童免疫系统尚未健全,病毒感染后机体更易产生免疫耐受,从而使得病毒逃逸,并在胃肠道中滞留,病毒蛋白在肠上皮细胞内反复释放超抗原持续激活免疫,导致广泛的T细胞激活。由此推测,SARS-CoV-2 在儿童肠道内长期滞留,其通过类似SEB的SAg序列大量激活T细胞,从而引发免疫介导的肝脏衰竭。
尽管MIC-S患者急性肝炎被报道过[37],但尚未见SARS-CoV-2合并腺病毒感染的临床报告。一项动物研究表明,小鼠在感染腺病毒后SEB介导的中毒性休克发病风险会明显增加,继而导致肝衰竭[43]。由以上研究推测,本次不明原因肝炎患儿可能为感染过或正在感染并一直携带SARS-CoV-2病毒的儿童,胃肠型腺病毒的感染诱发了SARS-CoV-2超抗原介导的中毒性休克,继而免疫偏移触发IFN-γ大量释放,介导肝细胞凋亡,从而临床表现为肝衰竭[2]。这一假设可以部分解析本疾患的病理生理机制,后续须检测患儿粪便中的SARS-CoV-2水平,并分析TCR偏移及IFN-γ上调的情况,从而为免疫调节治疗提供支持性证据。然而,目前尚不清楚胃肠道腺病毒共感染如何实现SARS-CoV-2 超抗原激活,以上推测只是该病机制的科学猜想而非定论,须进一步研究证实。
2.2.3 其他病因推测因病因仍不明晰,儿童急性重症肝炎尚未完全排除如毒素、药物等致病因素;也尚未鉴定新型嗜肝病毒感染的可能;不排除单独感染或共同感染其他病原体或新型病原体的可能;新冠病毒新型变异株也须纳入排除之列。以上诸多种因素均可导致免疫性肝损伤等。ECDC 概述了儿童肝炎的一些最常见的非传染性原因[8](见表4),并建议对代谢和自身免疫性疾病进行实验室筛查,以排除儿童急性肝炎的非感染性因素。

表4 导致肝炎的非感染性因素
3 实验室检查和病原学检测
因年龄和病因的不同,儿童急性肝功能衰竭前驱期症状表现为疲劳、不适、恶心和腹痛等非特异性肝损伤征象,难以判定确切的感染与发病时间。无肝移植时代,儿童急性肝功能衰竭的死亡率约70%~95%[44],应早期识别反映肝功能不全和肝性脑病(hepatic encephalopathy,HE)发生的行为或注意力改变,进行连续的全身和神经系统检查。实验室检查包括肝脏损伤和肝脏储备功能的评估:凝血酶原时间(PT)/INR(国际标准化比值)、总胆红素/结合胆红素、白蛋白/总蛋白、谷丙转氨酶/谷草转氨酶(ALT/AST)、谷氨酰转肽酶、血氨、铁蛋白和血糖。多系统评估包括血常规、血气和血电解质(包括钙、磷、镁)、脑钠肽前体、血淀粉酶和脂肪酶等指标。
对于病原学检测,ECDC推荐对患儿全血样本、咽拭子、肛拭子及尿液标本进行病原学检测(见表5)。这些检测有助于明确流行病因关联、排除其他病原因素,为进一步明确病因积累临床数据。

表5 ECDC 推荐检测的病原种类[8]
4 治疗
由于此次儿童急性重症肝炎的病因不明,文献报道60%~80%的患儿(其中美国亚拉巴马州66.67%[12],以色列83.33%[38],苏格兰61.54%[11])接受内科对症支持治疗后缓解痊愈;欧洲报道约20% 患儿进展至急性肝功能衰竭(INR>2)[45]。本病无公认诊疗指南,以对症处理和支持疗法为主。下述疗法具有一定的探索性。在无确凿自身免疫亢进证据的情况下,采用糖皮质激素治疗有可能促使病毒复制,延长病毒清除时间。如病毒感染明确,可以尝试抗病毒治疗。美国亚拉巴马州在全血样本中检出腺病毒41型的患儿,3例进展至急性肝功能衰竭,其中2例接受糖皮质激素和西多福韦(cidofovir,非获批适应证)治疗,以及后续肝移植治疗[12]。西多福韦能够通过选择性抑制病毒DNA的合成而抑制病毒复制,FDA批准的适应证为治疗艾滋病患者巨细胞病毒(CMV)视网膜炎。个案报道西多福韦可用于治疗免疫抑制儿童重症腺病毒肝炎[46-47]。截至2022年5月10日,英国报道176例中11例患儿接受肝移植治疗[5]。其中1名3岁血检腺病毒阳性的女童出现咳嗽、腹痛、黄疸等症状和体征,8天后出现急性肝功能衰竭(高血氨和INR>2),转入重症监护室(ICU)先后接受抗感染、西多福韦抑制病毒复制和血浆置换等治疗后,肝功能衰竭未好转,并于起病17天后接受其父亲活体肝移植治疗后痊愈[48]。因此,在提供内科支持治疗的同时,须基于患儿年龄、体格检查和实验室检查结果,监测血糖、血氨、电解质紊乱、腹水、肝性脑病、脑水肿、凝血功能障碍、感染、肾损伤、心血管功能障碍等指标,以判断急性肝功能衰竭的程度、进展,警惕多器官衰竭等并发症的发生[49],动态评估病情并及时做出治疗决策,选择合适的时机进行支持治疗和肝移植,可显著提高重症患儿的生存率。
5 现行病例的隔离管理及预防消毒措施
由于不明原因儿童急性重症肝炎正在全球范围流行与发展,其病因可能涉及腺病毒及新型冠状病毒感染,甚至存在尚未鉴定的新型嗜肝病毒等可能性,不确定性因素多,流行趋势很难判断及预测,因此现行病例必须严格按标准管理,并采取严格的隔离与消毒措施,即在当下病原体不明确且其传播途径不确定的时期,默认患者血液、体液、分泌物、排泄物及皮肤和黏膜均具有传染性,采取相应的防护措施[50]。UKHSA和ECDC均建议在儿童生活的环境(如日托场所)中,注意手卫生和呼吸道礼仪,加强物体表面的清洁与消毒,避免儿童不洁饮食。工作人员换洗尿布时,须佩戴一次性手套,并观察儿童是否出现黄疸体征(如巩膜、皮肤及尿颜色改变)。腺病毒易黏附在衣物如毛巾等物体表面,在室温下可存活10天,不易被酒精灭活,因此日托和医疗场所需要适宜浓度的漂白剂溶液或高效消毒剂进行日常消杀。根据已有的流行病学证据,WHO并不推荐对报告病例的地区实行旅行或贸易限制,须研判疫情的发展趋势,实施相应级别的防控措施。
6 结论
不明病因儿童急性重症肝炎是新发感染性疾病,已在多个国家相继报道,截至2022年5月30日,病例已达650余例,累计死亡9例,肝移植39例。现病因未明,可能与腺病毒感染有一定的关联性,在SARS-CoV-2感染基础上形成超级抗原所激发的免疫偏向,从而导致中毒性休克及广泛肝细胞凋亡,目前被认为是最具说服力的假设,也不排除其他因素如腺病毒基因重组和辅助因素诱导的腺病毒嗜性改变等病理机制。目前在病因不确定、机制不明的前提下,密切关注这一严重危害儿童健康的新发疾患,对认识该病的转播与流行、预先制定防控措施极为重要。同时,按要求做好相关病原学检测及基础研究,有助于揭示该病的发病机制,建立相应的诊疗规范,提高重症患儿的救治率,降低死亡率。因此,各级医疗单位应加强对本病的认识和警惕,完善相应病原检测体系、预警报告方案,不遗漏、延迟或错报相关病例,发现疑似病例及时报告、隔离、治疗,并切断可能的转播途径,做好环境消毒。

