藏红花素调控Nrf2/HO-1通路改善血管性认知障碍大鼠学习记忆能力实验研究
郭粉娥,李世英,郝乃猛
(邯郸市中心医院,河北 邯郸 057150)
血管性认知障碍(Vascular cognitive impairment,VCI)是指脑血管疾病及其危险因素所致脑区低灌注而引发的认知障碍综合征,主要表现为学习记忆能力下降,若不积极治疗,超过1/3的VCI患者将逐渐发展为血管性痴呆[1]。海马体是负责学习记忆的脑功能区,其中海马体CA1区是信息整理与转存的关键区域,并且CA1区神经元对缺血缺氧非常敏感[2-3]。长期血流低灌注导致海马体神经元损伤是VCI的病理基础,其中氧化应激和炎症损伤是造成海马体神经元损伤的重要原因[4-6]。
中医没有VCI病名的记载,根据临床表现可将其归入“痴呆”“呆病”“不慧”“健忘”“善忘”等范畴,其病机在于气虚血亏、精损髓减或痰瘀。研究报道,活血化瘀治疗可明显改善血管性认知障碍症状[7]。藏红花是我国珍贵中药材,取其柱头入药,可活血化瘀、散郁开结。藏红花的主要有效成分为藏红花素,Nrf2/HO-1是调控氧化应激和炎症反应的关键信号通路[8-10]。本研究旨在探讨藏红花素对VCI大鼠学习记忆能力的影响及相关机制,以期为VCI的治疗提供新的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:120只清洁级雄性SD大鼠购自河北伊维沃生物科技有限公司[SYXK(冀)2020-002],体重230~260 g。分笼饲养,室温23~25 ℃,相对湿度55%~65%。
1.1.2 实验药物与试剂:纯度≥98%的藏红花素(批号E190407b);盐酸多奈哌齐片(国药准字H20030472,规格:5 mg/片);注射用硝普钠(国药准字H11021635,规格:50 mg/瓶,批号201126)。末端脱氧核苷酰基转移酶切口末端标记(TUNEL)试剂盒(批号20210519);丙二醛(MDA)试剂盒(批号BC0020);超氧化物歧化酶(SOD)试剂盒(批号BC0170);谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号BC1190);肿瘤坏死因子-α(TNF-α)试剂盒(批号SEKR-0009);白细胞介素-1β(IL-1β)试剂盒(批号SEKR-0002);二辛可宁酸(BCA)试剂盒(批号PC0020);二氨基联苯胺(DAB)试剂盒(批号DA1015);Nrf2抗体(批号bs-1074R);HO-1抗体(批号bs-23397R);核因子κB(NF-κB)抗体(批号bs-23217R);β-actin抗体(批号bs-0061R);IgG二抗(批号bs-0295G)。
1.2 实验方法
1.2.1 造模、分组与给药:随机选取120只SD大鼠中的100只,参照文献[11]报道的方法制备VCI大鼠模型。术前禁食12 h,3 ml/kg腹腔注射10%水合氯醛溶液实施麻醉后取仰卧位,沿颈正中切口钝性分离两侧颈总动脉,2.5 mg/kg腹腔注射硝普钠诱导低血压,夹闭两侧颈总动脉10 min后,松开动脉夹恢复血流10 min,再夹闭两侧颈总动脉10 min,然后恢复血流,逐层缝合,手术过程保持肛温(37±0.5)℃。将100只VCI模型大鼠按随机数字表法分为模型组、多奈哌齐组和藏红花素低、中、高剂量组,每组20只;剩余20只大鼠设为假手术组(暴露双侧颈总动脉但不夹闭)。造模完成后,藏红花素低、中、高剂量组分别腹腔注射10、20、40 mg/kg[12]藏红花素,多奈哌齐组腹腔注射0.5 mg/kg[13]多奈哌齐,假手术组和模型组给予0.9%氯化钠溶液,各组注射体积均为5 ml/kg,1次/d,疗程4周。
1.2.2 学习能力和记忆能力评测:①Morris水迷宫定位航行实验评测大鼠学习能力。将平台装置于Morris水迷宫第3象限,治疗完成后每组随机取10只大鼠,由第1、2、4象限放入水中并引导大鼠寻到第3象限平台,5次/d,训练3 d,第4天分别由第1、2、4象限放入水中,记录每只大鼠寻到第3象限平台的时间,即逃避潜伏期。②Morris水迷宫空间探索实验评测大鼠记忆能力。定位航行实验完成后去掉平台,将大鼠由第1象限放入水中,记录120 s内穿越平台次数。
1.2.3 海马体CA1区病理学变化和神经元凋亡观察:每组取10只大鼠脑组织,经多聚甲醛固定、包埋、切片、脱蜡、透明后,实施HE染色(苏木精染色5 min,1%伊红染色2 min)和TUNEL染色,显微镜观察CA1区病理学变化和神经元凋亡状况,胞核黄褐色为阳性着色,在400倍显微镜下,每张切片取5个视野计数细胞总数和凋亡细胞数,计算凋亡指数。
1.2.4 海马体氧化应激指标和炎症因子水平检测:取各组剩余大鼠海马体,冰上匀浆、裂解后离心取上清,按照试剂盒说明处理后,通过分光光度计检测氧化应激指标[抗氧化酶(SOD、GSH-Px)活力和MDA含量],通过酶标仪检测炎症因子TNF-α、IL-1β水平。
1.2.5 海马体Nrf2、HO-1、NF-κB蛋白表达检测:取海马体裂解溶液,4 ℃、12000 r/min离心取上清,BCA法总蛋白定量,SDS-PAGE电泳分离蛋白、湿法转膜、5%蛋白封闭液室温封闭1 h,4 ℃孵育Nrf2(1∶800)、HO-1(1∶1000)、NF-κB(1∶800)、β-actin(1∶2000)一抗过夜,室温孵育二抗(1∶2000)1 h,DAB显色后计算条带灰度值。
1.3 统计学方法 采用SPSS 21.0统计学软件处理数据。计量资料以均数±标准差表示,若方差齐,组间比较行单因素方差分析和LSD-t检验;若方差不齐时,组间比较行Kruskal-WallisH和Mann-WhitneyU检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠学习能力和记忆能力比较 见表1。与假手术组比较,模型组大鼠逃逸潜伏期显著延长(P<0.05);与模型组比较,藏红花素中、高剂量组和多奈哌齐组大鼠逃逸潜伏期显著缩短(P<0.05);藏红花素对VCI大鼠逃逸潜伏期的作用具有剂量依赖性,藏红花素低、中、高剂量组组间比较差异具有统计学意义(P<0.05);与多奈哌齐组比较,藏红花素高剂量组逃逸潜伏期显著缩短(P<0.05)。

表1 各组大鼠学习能力和记忆能力比较
与假手术组比较,模型组穿越平台次数显著减少(P<0.05);与模型组比较,藏红花素中、高剂量组和多奈哌齐组穿越平台次数显著增多(P<0.05);藏红花素对VCI大鼠穿越平台次数的作用具有剂量依赖性,藏红花素低、中、高剂量组组间差异具有统计学意义(P<0.05);与多奈哌齐组比较,藏红花素高剂量组穿越平台次数显著增多(P<0.05)。
2.2 各组大鼠海马体CA1区病理学改变及神经元凋亡比较 见图1、2(表2)。假手术组海马体CA1区神经元未见异常。模型组CA1区神经元由类圆形变为三角形或不规则多边形,松散紊乱、无层次感,胞体固缩,凋亡神经元数量增多,凋亡指数较假手术组显著升高(P<0.05)。与模型组比较,藏红花素低、中、高剂量组和多奈哌齐组海马体CA1区病理学改变不同程度减轻,凋亡神经元数量不同程度减少,藏红花素对VCI大鼠CA1区病变的改善作用和神经元凋亡的抑制作用具有剂量依赖性,藏红花素低、中、高剂量组间凋亡指数比较差异具有统计学意义(P<0.05);与多奈哌齐组比较,藏红花素高剂量组凋亡指数显著降低(P<0.05)。
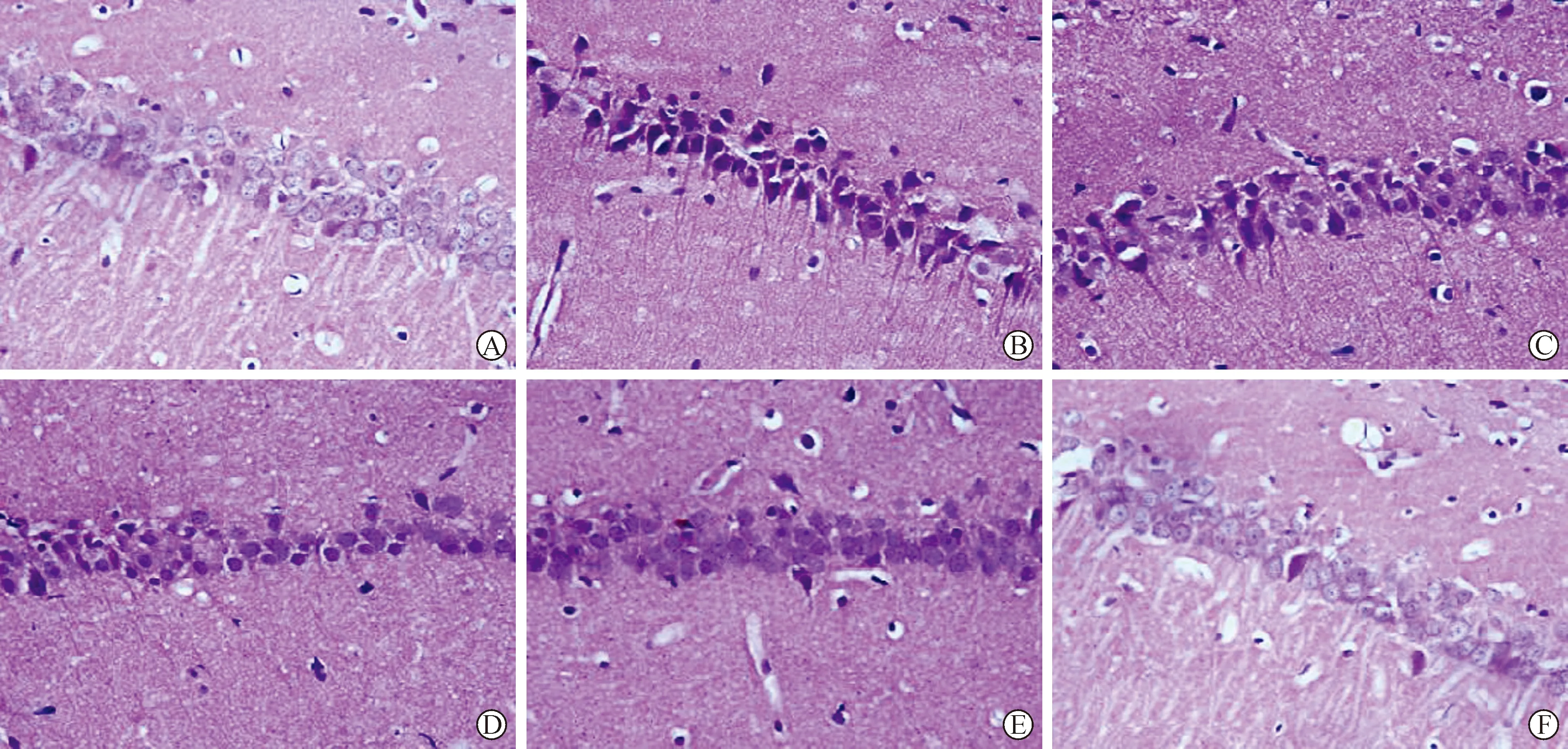
A:假手术组;B:模型组;C:藏红花素低剂量组;D:藏红花素中剂量组;E:藏红花素高剂量组;F:多奈哌齐组
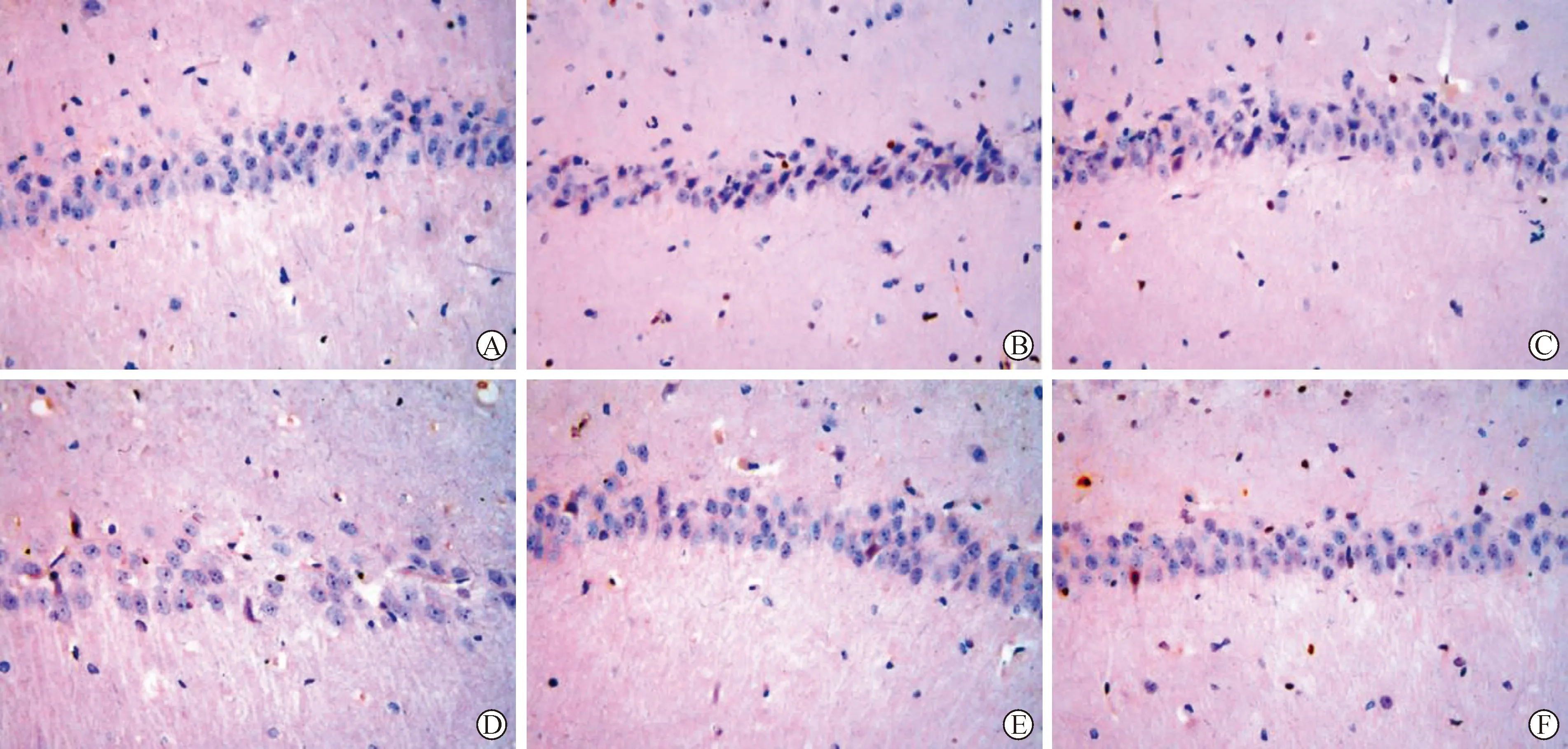
A:假手术组;B:模型组;C:藏红花素低剂量组;D:藏红花素中剂量组;E:藏红花素高剂量组;F:多奈哌齐组

表2 各组大鼠海马体CA1区神经元凋亡指数比较(%)
2.3 各组大鼠海马体氧化应激指标和炎症因子水平比较 见表3、4。与假手术组比较,模型组SOD、GSH-Px活力降低,MDA、TNF-α、IL-1β水平升高(P<0.05)。与模型组比较,藏红花素中、高剂量组和多奈哌齐组SOD、GSH-Px活力升高,MDA、TNF-α、IL-1β水平降低(P<0.05)。与藏红花素低剂量组比较,藏红花素中、高剂量组和多奈哌齐组SOD活力升高,MDA、TNF-α水平降低(P<0.05),藏红花素高剂量组GSH-Px活力升高(P<0.05),藏红花素高剂量组和多奈哌齐组IL-1β水平降低(P<0.05)。与藏红花素中剂量组比较,藏红花素高剂量组SOD活力升高,TNF-α、IL-1β水平降低(P<0.05)。与多奈哌齐组比较,藏红花素高剂量组SOD活力升高,MDA、TNF-α水平降低(P<0.05)。
2.4 各组大鼠海马体Nrf2、HO-1、NF-κB表达比较 见图3(表5)。与假手术组比较,模型组Nrf2、HO-1相对表达量降低,NF-κB相对表达量升高(P<0.05)。与模型组比较,藏红花素低、中、高剂量组和多奈哌齐组Nrf2、HO-1相对表达量升高,NF-κB相对表达量降低(P<0.05)。藏红花素对VCI大鼠海马体Nrf2、HO-1、NF-κB表达的影响具有剂量依赖性,藏红花素低、中、高剂量组间差异具有统计学意义(P<0.05);与多奈哌齐组比较,藏红花素高剂量组Nrf2、HO-1相对表达量升高,NF-κB相对表达量降低(P<0.05)。

表3 各组大鼠海马体氧化应激指标水平比较

表4 各组大鼠海马体炎症因子水平比较

A:假手术组;B:模型组;C:藏红花素低剂量组;

表5 各组大鼠海马体Nrf2、HO-1、NF-κB表达比较
3 讨 论
藏红花是《中国药典》收录的中药之一,其主要有效成分藏红花素具有抗氧化、抗炎等药理学作用[14-15]。多奈哌齐是临床治疗VCI的一线用药,也是VCI动物实验研究的常用阳性对照药物[16-17]。本研究采用反复夹闭双侧颈总动脉的方法建立VCI动物模型,发现VCI模型大鼠学习能力和记忆能力明显下降,海马体CA1区呈现神经元数量减少、松散紊乱、形态不规则、胞体固缩等病理改变,与杨文强等[11]研究报道一致。经藏红花素或多奈哌齐治疗能够有效改善VCI大鼠学习能力和记忆能力,改善海马体CA1区神经元病变,减轻神经元凋亡,藏红花素上述作用呈现一定剂量依赖性,并且藏红花素高剂量上述作用强于多奈哌齐,说明藏红花素能够减轻VCI大鼠海马体CA1区损伤、改善学习能力和记忆能力。
VCI多继发于脑血管病及危险因素所引发的脑血流低灌注,而大脑海马体CA1区是对缺血缺氧最敏感的区域[18]。脑区持续血流低灌注导致线粒体电子传递链断裂引发活性氧簇(Reactive oxygen species,ROS)大量生成,SOD、GSH-Px等能够清除ROS的抗氧化酶被过度消耗,破坏“ROS-抗氧化酶”动态平衡,ROS过度蓄积可破坏蛋白质、DNA、多肽等生物大分子结构而诱导细胞凋亡[19];并且ROS攻击破坏细胞膜、线粒体膜,并生成具有生物毒性的MDA,导致VCI后海马体CA1区神经元病变持续加重[20]。此外,脑区持续血流低灌注释放病理性刺激炎症因子,诱发炎症反应,其中TNF-α、IL-1β具有炎性趋化因子属性,能够刺激中性粒细胞等进一步释放白细胞介素、前列腺素、单核细胞趋化蛋白等加重炎症反应[21]。Nrf2是真核细胞中普遍存在的一种核转录因子,侯书鹏[22]发现Nrf2可促抗氧化酶表达,从而降低氧化应激损伤。HO-1能够被Nrf2诱导表达,可促使血红素分解、还原清除NO,降低氧化应激损伤[23]。NF-κB能够与染色体特定位点结合诱导炎症因子TNF-α、IL-1β等表达与释放,进而加重炎症损伤[24]。本研究发现,经藏红花素或多奈哌齐治疗能够明显提高VCI大鼠海马体SOD、GSH-Px活力并降低MDA、TNF-α、IL-1β水平,上调Nrf2、HO-1表达,下调NF-κB表达,藏红花素上述作用呈现一定剂量依赖性,并且藏红花素高剂量对MDA、TNF-α水平,SOD活力及Nrf2、HO-1、NF-κB表达的作用强于多奈哌齐,说明藏红花素可激活Nrf2/HO-1通路、减轻VCI大鼠海马体氧化应激和炎症损伤。
综上,藏红花素可能通过激活Nrf2/HO-1通路降低海马体氧化应激损伤,对VCI大鼠学习记忆能力起到改善作用。但VCI病理机制复杂,藏红花素治疗VCI的作用机制有待进一步研究。

