编辑烤烟多酚氧化酶基因NtPPO8后的效应分析
代卓毅,李洪亮,姚怡帆,张希,薛刚,丁永乐,张智强,杨铁钊*
编辑烤烟多酚氧化酶基因后的效应分析
代卓毅1,李洪亮2,姚怡帆1,张希3,薛刚1,丁永乐1,张智强1,杨铁钊1*
1 河南农业大学烟草学院,郑州 450002;2 许昌市烟草公司襄城县公司,河南许昌 461700;3 陕西中烟工业有限责任公司技术中心,陕西宝鸡 721013
【目的】探究基因在烟草中的功能以及对烟叶耐烤性和烤后烟质量的影响。【方法】以烤烟品种NC89为材料,利用CRISPR/Cas9技术对进行定向编辑,获得纯合突变植株,测定并分析原品种和突变体在叶龄60 d时的基因表达量和植物多酚氧化酶(Polyphenol oxidase,PPO)活性差异,探究基因对烘烤过程中的PPO活性以及烤后烟的多酚物质含量的影响。【结果】(1)共获得6株T0代纯合突变体,突变均发生在靶位点上,为1个碱基的插入突变。(2)4个T1代编辑株系的表达水平显著下降,所有编辑株系的PPO活性显著下降。(3)T1代编辑株系烘烤过程中的PPO活性低于原品种,烤后中部叶总酚含量显著高于原品种。【结论】定向编辑基因后,降低了其在烟叶中的表达量,抑制了烟叶在烘烤过程中的PPO活性,有助于烤后烟多酚类物质的积累。
烤烟;CRISPR/Cas9;;基因编辑;多酚氧化酶
植物多酚氧化酶(Polyphenol oxidase,PPO)是一种含铜的氧化还原酶[1-2],在作物生长发育过程中主要参与酶促棕色化反应,即将酚类物质催化生成醌类物质,对虫害、病原菌等有防御作用[3],醌类物质又会影响农产品的品质,降低其使用价值。目前调控PPO活性有3种方法:物理方法[4-7]、化学方法[8-13]和生物技术方法[14]。其中生物技术手段被认为是最有前景的方法[15]。池明等[16]采用人造小RNA(amiRNA)技术抑制了马铃薯PPO基因家族中的单个和多个基因,降低了PPO总蛋白量、PPO活性和块茎褐变潜力,揭示了不同PPO基因的贡献率。姚恒等[17]利用CRISPR/Cas9技术定点敲除了烟草中的多酚氧化酶基因,降低了基因表达量,创制了新型突变材料。段杜薇等[18]敲除/过表达烟草多酚氧化酶基因后,发现烟叶的PPO活性有所降低/升高,多酚物质含量升高/降低。因此,采用基因编辑和RNA干扰等生物技术调控植物体内PPO活性是有效的。
烟叶烘烤过程中PPO活性可作为评判烟叶耐烤性的指标之一。在烟叶定色前期PPO活性偏高易导致烟叶挂灰、烤黑、烤糟,影响烤后烟叶品质[19]。目前,降低烟叶PPO活性,改善烟叶耐烤性的研究主要集中在栽培措施[20-21]、成熟度[22-23]等方面,在生物技术方面的研究较少。本研究以烤烟品种NC89为材料,利用CRISPR/Cas9技术构建了在烟草叶片中优势表达的[24](NCBI登录号:NW_015805026.1)的基因编辑载体,获得转化植株,筛选出纯合突变体。通过检测突变体在叶龄60 d时的相对表达量和PPO活性,以及烘烤过程中PPO活性和烤后烟叶多酚物质含量,旨在探讨基因敲除后对中部叶耐烤性和烤后烟品质的影响。
1 材料与方法
1.1 烟草材料及载体试剂盒
供试烟草品种NC89种子由河南农业大学烟草育种实验室提供。CRISPR/Cas9载体试剂盒由武汉天问生物科技公司提供,检测引物由武汉天问生物科技有限公司合成。测序和基因表达量的测定由河南百奥泰生物科技有限公司完成。
1.2 方法
1.2.1 CRISPR/Cas9载体构建
首先,根据的序列信息,设计2个CRISPR靶位点,以提高基因打靶效率。靶点长20 bp,靶位点1序列:CTAGGTTTAGGAGGTCTCTA;靶位点2序列:AGAATAAGGTACTGGTACAC。其次,根据靶位点序列信息设计靶位点PCR扩增引物(表1),并采用重叠PCR扩增出含有靶位点的片段,利用重组酶将PCR扩增片段克隆至最终的CRISPR表达载体。最后,将构建的CRISPR载体电转入大肠杆菌,通过菌落PCR以及测序筛选阳性克隆。具体方法见图1:利用Golden Gate将两个sgRNA组合在1个载体中,分别用引物对P1-P3和P4-P5获得两个单独的PCR产物。采用重叠PCR法利用引物对P2-P6将上述两个片段连接,扩增出含有靶位点的目标片段。采取一步克隆法将目标序列连接到两个I酶切位点之间。为进一步确定靶位点的准确性,靶位点片段与表达载体重组后,转化大肠杆菌TOP10,挑选5个克隆,利用载体引物P6进行菌落PCR检测并且进一步测序验证。
表1 PCR扩增引物

Tab.1 PCR primers
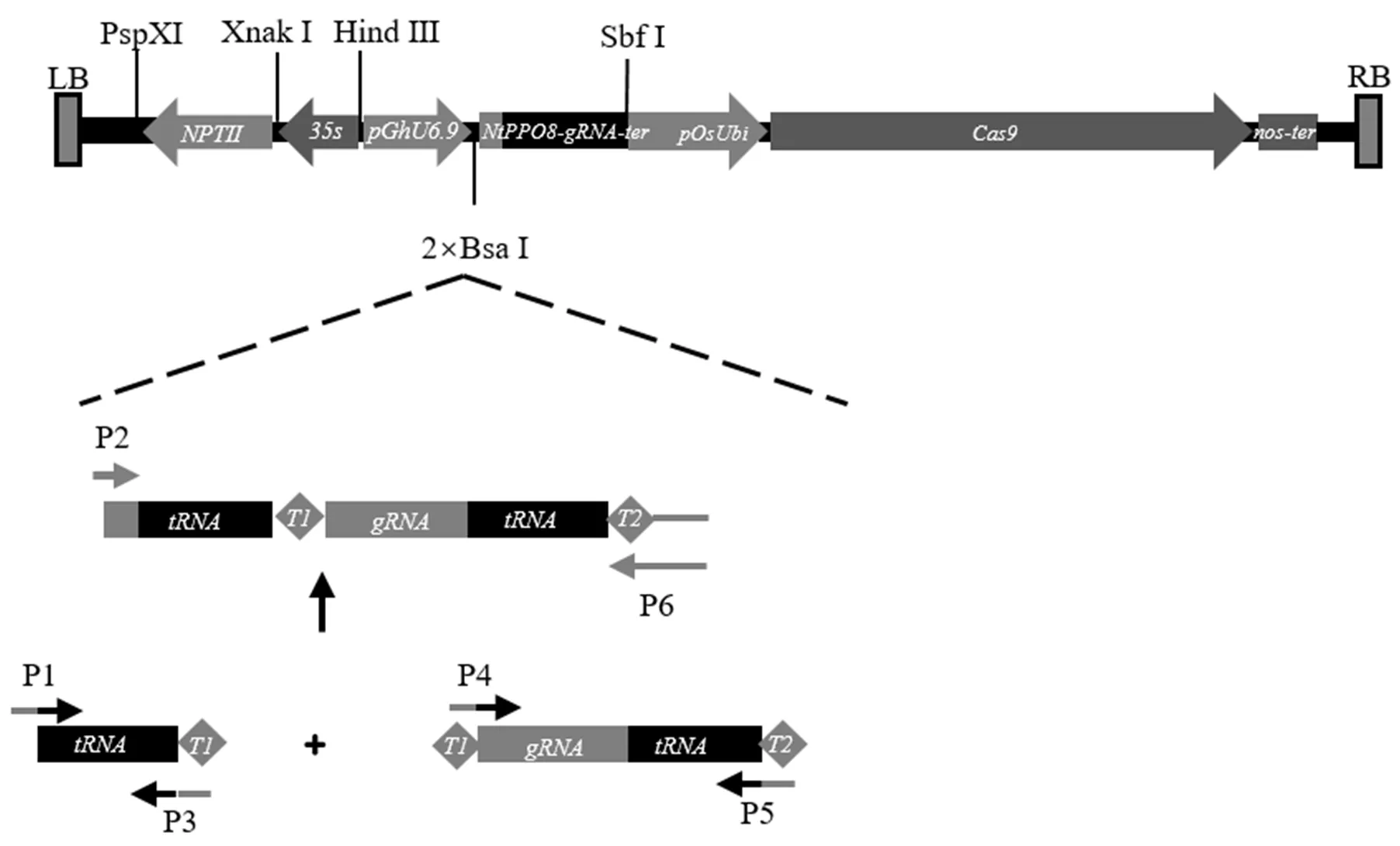
注:LB:左边界;RB:右边界。
1.2.2 烟草遗传转化和目标基因靶位点序列突变检测
参照曾千春等[25]的方法,在河南农业大学育种实验室进行种子萌发培养,待发芽后置于恒温恒湿人工光照培养箱内培养45 d,光周期为14 h光照/10 h黑暗;光强度为1500 Lx,温度为(27±1)℃。使用打孔器取0.5 cm左右的叶片,光照培养2 d后,使用农杆菌菌液侵染叶盘,转入筛选培养基进行光照培养,待分化后进行生根培养,培养30 d后可转移到土里培养。剪取再生植株叶片,利用CTAB法抽提取DNA,利用NPT II特异引物进行PCR检测。NPTIIF68:ACTGGGA CAACAGACAATCG;NPTIIR356:GCATCAGCCATG ATGGATACTTT。配制1%的琼脂糖凝胶,进行电泳检测。确认外源DNA片段插入后,根据基因序列及靶位点位置,设计测序引物对阳性植株进行PCR检测。NtPPO8-F:TGTGCAATAGCACACCACTCA;NtPPO8-R:CATGAGAAGCTGGCCGAATAC。PCR扩增体系:1 μL DNA,2 μL 10×PCR buffer,0.4 μL dNTP mixture (2 mmol/L),正反引物各 0.2 μL,0.2 μL rTaq DNA polymerase (1 U/μL),ddH2O加至20 μL。PCR反应程序:94℃ 3 min,94℃ 30 s,55℃ 30 s,72℃ 30 s,30个循环后72℃ 10 min,25℃ 1 min。
1.2.3 转基因植株的筛选及种植
的PCR扩增产物经过测序、比对后,将基因编辑成功的转基因阳性T0代编辑植株移栽至河南省漯河市台陈镇荆李村,按照《农业转基因生物安全管理条例》进行大棚种植,后分单株套袋自交收获T0代编辑植株的种子。将T0代编辑植株的种子进行播种、育苗、种植,调查记录植株的生长发育情况,在每个株系中选取10株有代表性的T1代编辑植株进行DNA提取,检测的突变情况,并分析突变类型。在该过程中,调查记录T0代和T1代编辑植株的生长发育情况。
1.3 取样与测定
中部叶在叶龄60 d时(以幼叶长1.5 cm时开始计算叶龄),在10株代表性T1代编辑植株中随机选取5株,剪取第12叶片(自下而上数)放入液氮保存,用于基因表达量和PPO活性的测定。在中部叶烘烤0 h、24 h、48 h、7 2h、96 h时,剪取同一叶片位置的烟叶放入液氮保存用于检测烘烤过程中的PPO活性。取烤后烟叶进行多酚物质含量检测。每个处理设置5次生物学重复,3次技术重复。
1.3.1 T1代编辑植株基因相对表达量的测定
烟草的Real time-PCR检测按照Quant qPCR-PCR kit(SYBR Green)(Thermo Fisher公司)使用说明在QPCR仪器(Thermo Fisher公司)上进行qRT-PCR检测,设置5个生物学重复。利用Excel进行统计分析和制图。分析基因的相对表达量,内参基因为ND-26S rRNA-F:GAAGAAGGTCCCAA GGGTTC;ND-26S rRNA-R:TCTCCCTTTAACACC AACGG。所需引物为P-NtPPO8-F:GGTTTAGGAGGT CTCTATGGTGC;P-NtPPO8-R:AGAATAAGGTACTG GTACAC。
1.3.2 烟草叶片PPO活性测定
多酚氧化酶活性采用试剂盒测定,所用方法为微量法,试剂盒由Solarbio公司提供。
PPO(U/g 质量)=ΔA÷0.005×V反总÷(W×V 样÷V 样总)÷T =120×ΔA÷W
注:式中,V反总为反应体系总体积,0.3 mL;V样为加入反应体系中样本体积,0.05 mL;V样总为加入提取液体积,1 mL;W为样本质量,g;T为反应时间,10 min。
1.3.3 烤后烟多酚物质含量检测
绿原酸、芸香苷和莨菪亭等多酚类物质含量测定采用YC/T202—2006《烟草及烟草制品多酚类化合物绿原酸、莨菪亭和芸香苷的测定》的标准[26]。总酚含量为绿原酸、芸香苷和莨菪亭含量之和。
1.4 数据处理
采用Excel 2016对数据进行统计分析。
2 结果与分析
2.1 NtPPO8靶位点的选择与载体构建
分别构建靶位点1和靶位点2的表达载体pRGEB32-Cas9-NPT Ⅱ--gRNA(图2)。检测结果如图3显示,共筛选到4个阳性克隆,长度约在250~400 bp,5号克隆(长度约350 bp)的测序结果表明(图4),2个靶位点序列都与所设计靶位点序列相同,说明构建的基因载体可以进行下一步农杆菌介导的遗传转化。

注:方框中字母为靶位点序列,绿色为PAM序列。
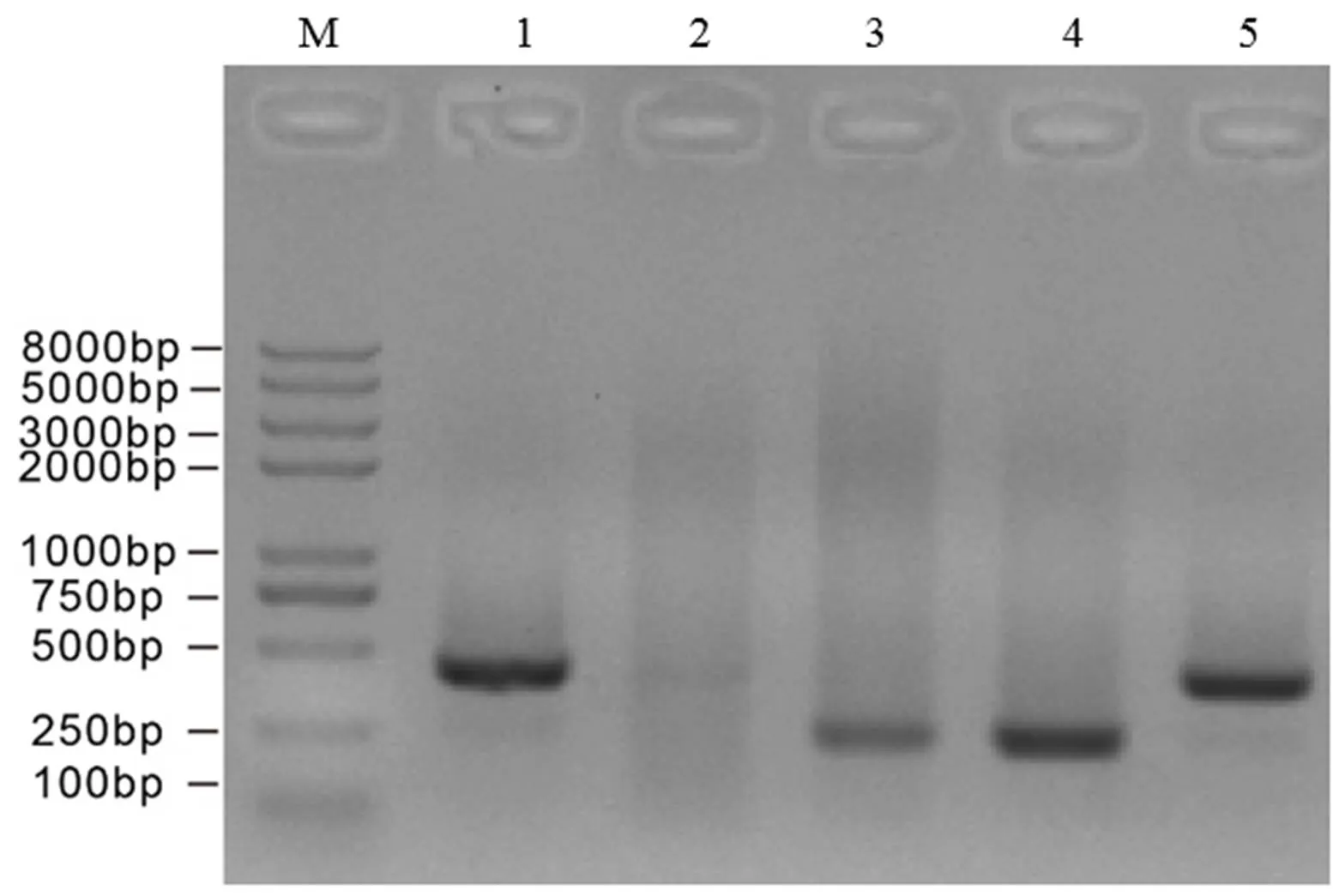
注:M为Trans2K DNA Marker;1~5为阳性克隆。
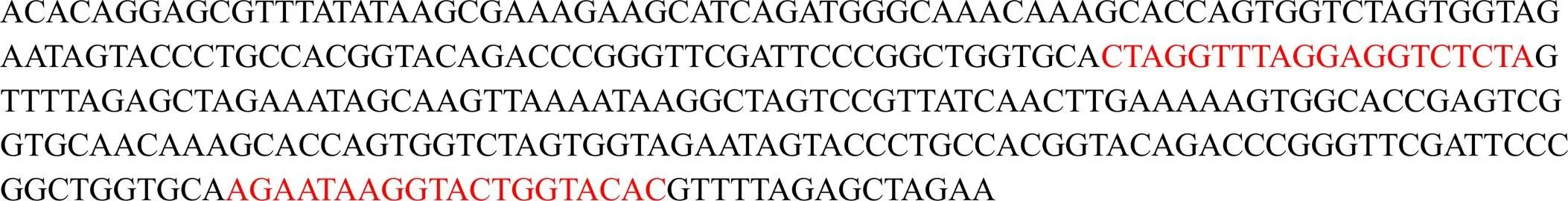
注:红色部分表示靶位点。
2.2 烟草遗传转化与PCR检测
将筛选出来的基因编辑载体,利用农杆菌叶盘法转化烟草,经组培获得T0代编辑植株(如图5)。从T0代编辑植株叶片提取DNA,利用NPTⅡ特异引物进行PCR检测,扩增产物大小约360 bp。筛选出15株阳性植株,株号为2、3、4、5、6、7、8、10、11、12、13、14、15、16和17(图6)。

图5 烟草遗传转化过程
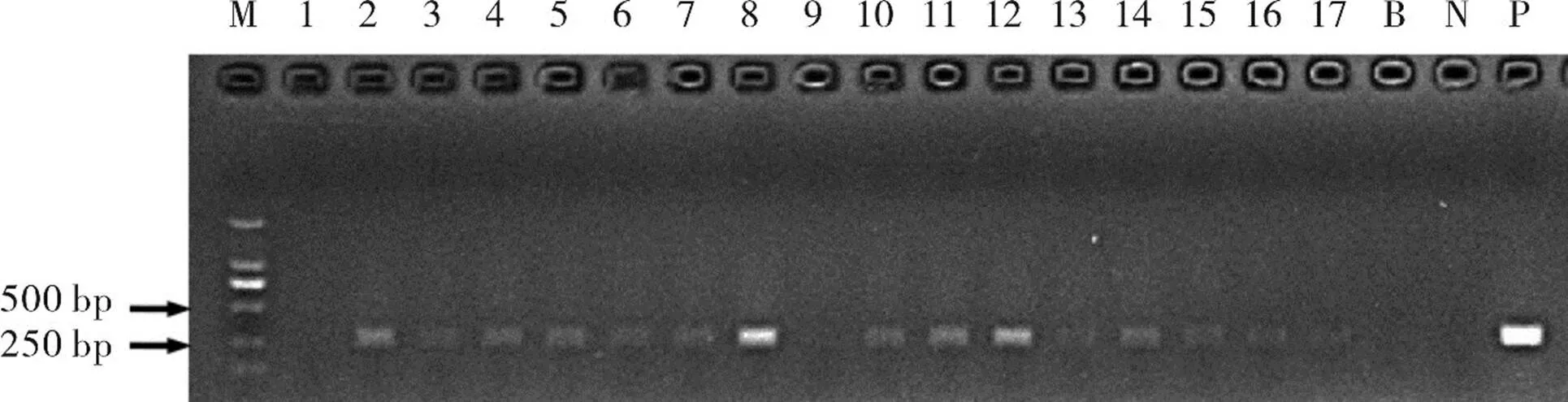
注:从左到右泳道内被检测样品株系编号依次是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16和17,图中B代表空白对照,N代表阴性对照,P代表阳性对照。
2.3 T0代和T1代编辑植株测序验证
分别对编辑植株和原品种NC89进行基因测序分析,并用测序峰图进行验证(图7),结果表明:突变均发生在第2个靶位点上;T0-6、T0-12和T0-15基因序列没有发生改变;T0-2、T0-3、T0-4、T0-7、T0-8和T0-14植株在第2个靶位点附近发生了碱基的插入或缺失,但是测序峰图出现紊乱现象,说明这些编辑植株均为杂合植株;T0-5、T0-10、T0-11、T0-16和T0-17在靶位点上插入了一个T碱基,其中T0-13在靶位点上插入了一个A碱基,测序峰图没有紊乱的现象,说明这些编辑植株都为纯合突变体。对纯合突变体植株编码蛋白的氨基酸序列进行预测比对(图8),结果显示:第二个靶位点上插入的单个碱基T/A引起了移码突变,导致编码肽链(从碱基插入位置大约42个碱基后)提前遇到终止密码子,而使翻译的氨基酸链大幅缩短。将T0-5、T0-10、T0-11、T0-13、T0-16和T0-17进行套袋自交,收获T0代编辑植株的种子。将T0代编辑植株的种子按株系播种育苗、移栽种植,每个株系选取10棵单株进行进行测序,测序结果显示,T1代编辑植株的基因序列与对应母本相同,说明编辑后的纯合突变体能够稳定遗传。在T0代和T1代编辑植株的种植管理过程中,并未发现与原品种NC89在生长发育方面存在差异。
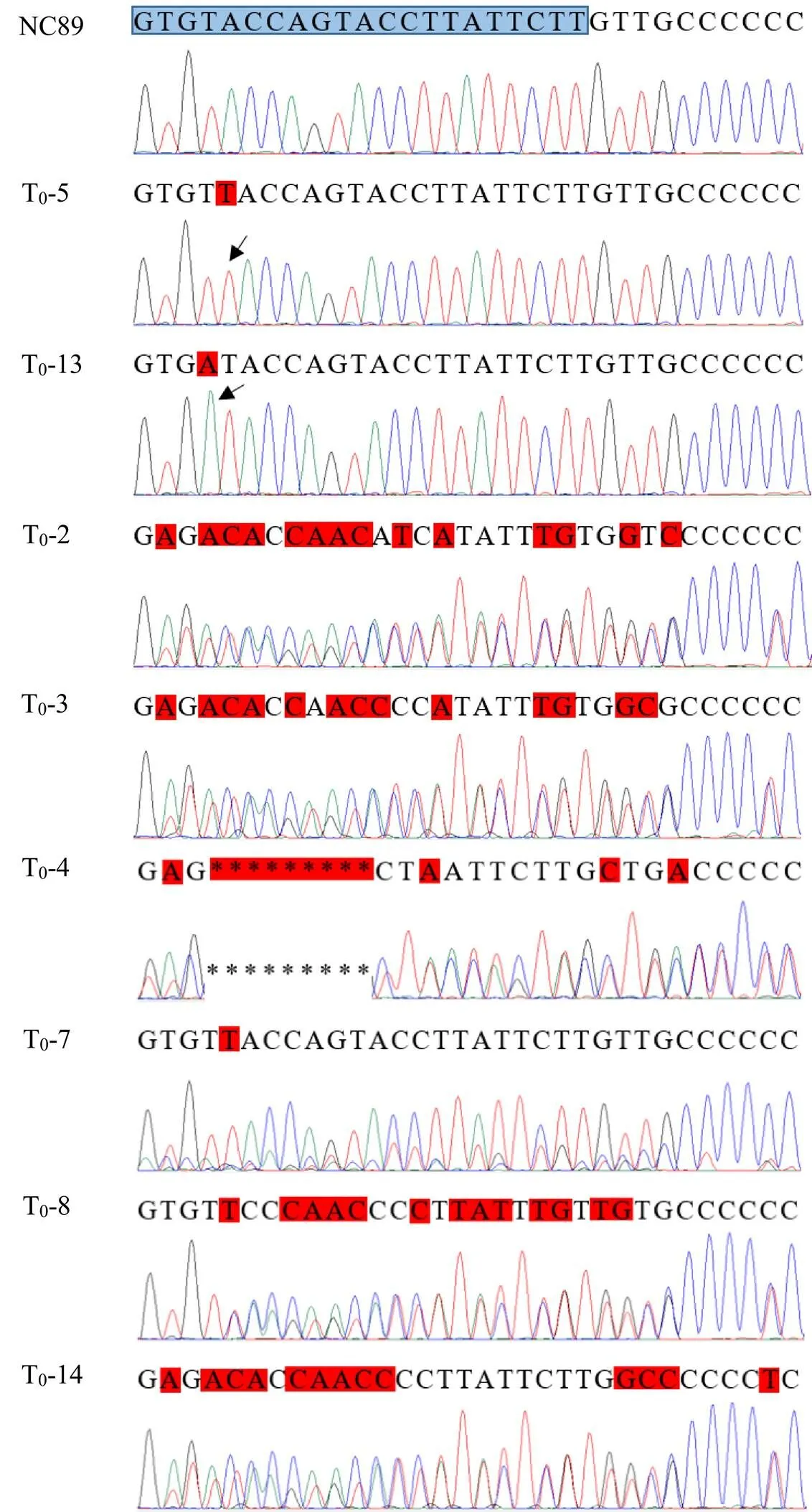
注:黑色箭头指示突变起始位置;*表示碱基缺失;红色部分为碱基的替换、缺失或插入;蓝色部分为PAM靶位点序列;T0-10、T0-11、T0-16和T0-17同T0-5。
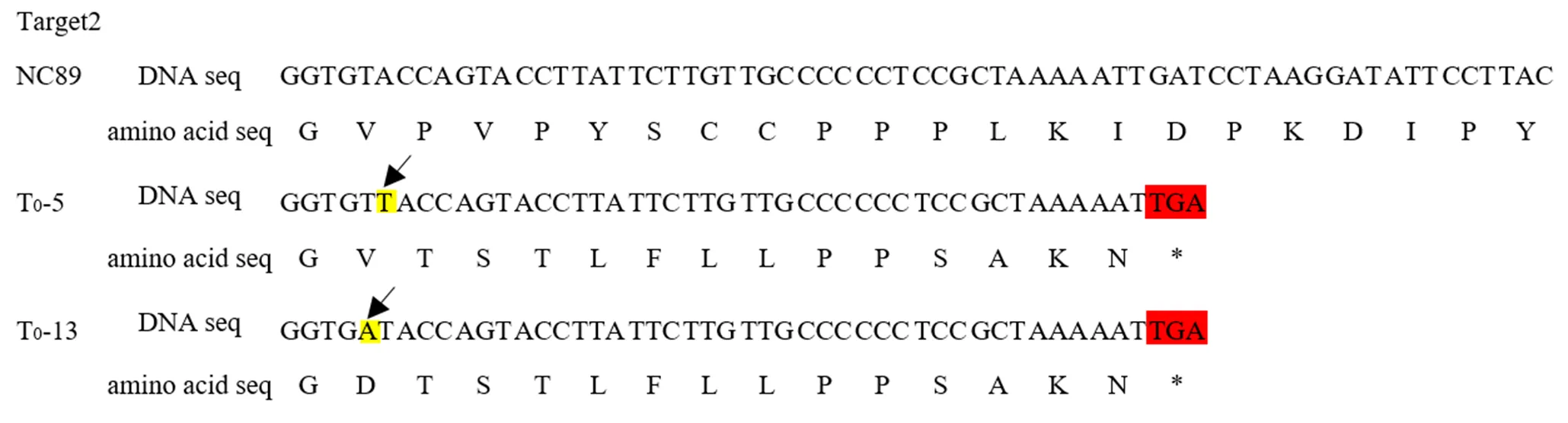
注:黑色箭头指示突变起始位置;红色部分为终止密码子;*代表翻译终止;T0-10、T0-11、T0-16和T0-17同T0-5;黄色部分为碱基插入;蓝色部分为靶位点2处生成的氨基酸序列。
Note:The black arrow indicates the starting position of the mutation; the red part is the stop codon; * means end of translation; T0-10, T0-11, T0-16 and T0-17 are the same as T0-5; the yellow part is the base insertion; the blue part is the amino acid sequence generated at target site 2.
图8 原品种NC89与T0代编辑植株预测氨基酸序列分析
Fig.8 Analysis of the predicted amino acid sequences of original variety and T0generation edited plants
2.4 T1代编辑植株的NtPPO8基因表达量和PPO活性
在叶龄60 d时,对获得的T1代编辑植株叶片中基因表达量和PPO活性进行测定(图9,图10),结果表明:相对于原品种NC89,不同编辑植株的基因的表达量都有不同程度的下降,T1-10、T1-13、T1-16和T1-17的表达量显著下降,分别相当于对照的48%、22%、51%和70%;基因编辑植株T1-5和T1-11的表达量下降不显著,分别相当于对照的87%和85%。相对于原品种NC89,不同编辑植株的PPO活性均显著下降。其中,T1-13的PPO活性下降幅度最大(43%),与基因表达量下降趋势一致。说明利用CRISPR/Cas9技术创制的突变体影响了基因的表达,并降低了叶片中PPO的活性。
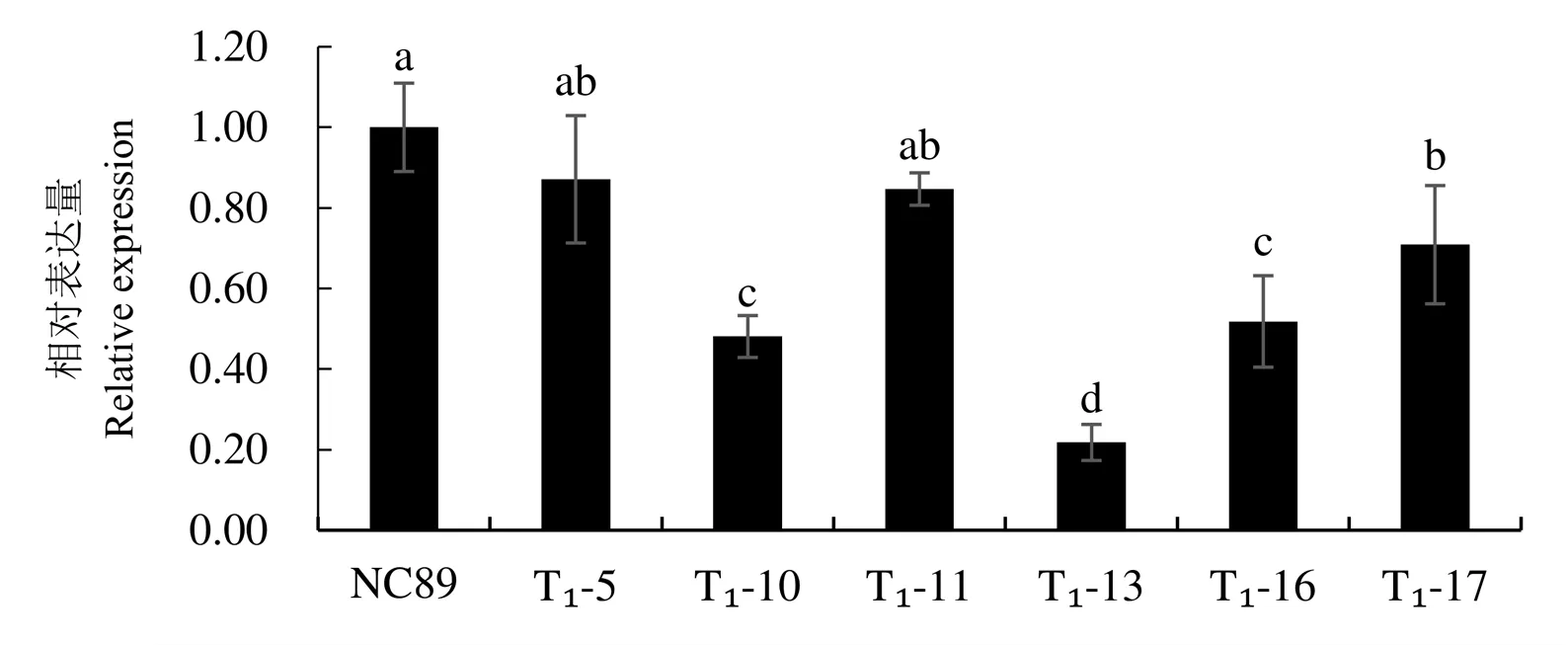
注:柱中带有不同小写字母表示P< 0.05水平上的差异显著性;误差线表示SD,下同。
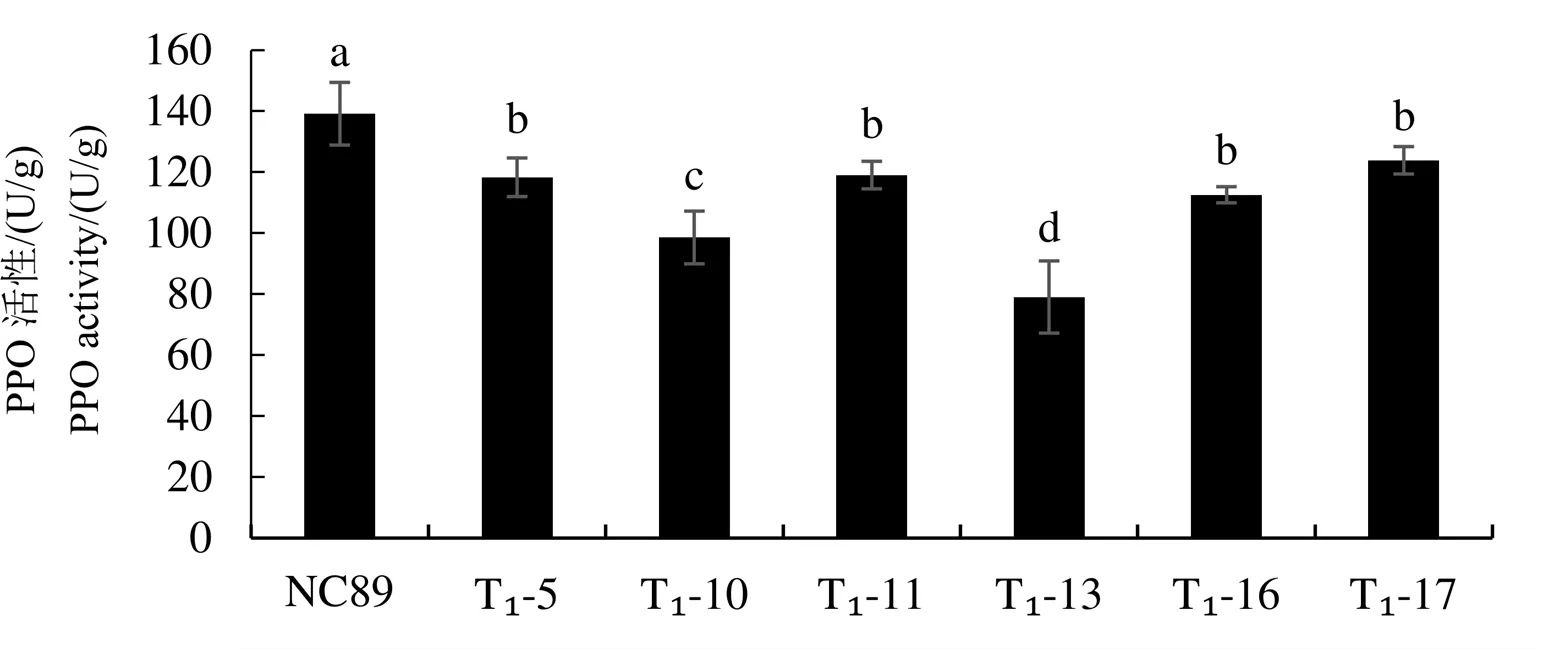
图10 T1代编辑植株PPO活性
2.5 T1代编辑植株烘烤过程中的PPO活性变化差异
不同编辑植株中部叶在烘烤过程中的PPO活性变化趋势均呈抛物线型(图11),烘烤进程至48 h时(变黄后期)达到最大值,且以原品种NC89的PPO活性最高,而不同编辑植株的叶片在烘烤过程中PPO活性均有所降低。对T1代编辑植株进行比较,以T1-13叶片在烘烤过程中PPO活性最低,且变化趋势较其它株系相对缓和。综上所述,基因编辑后,不同程度地抑制了烘烤过程中叶片的PPO活性,有助于烟叶耐烤性的改善。
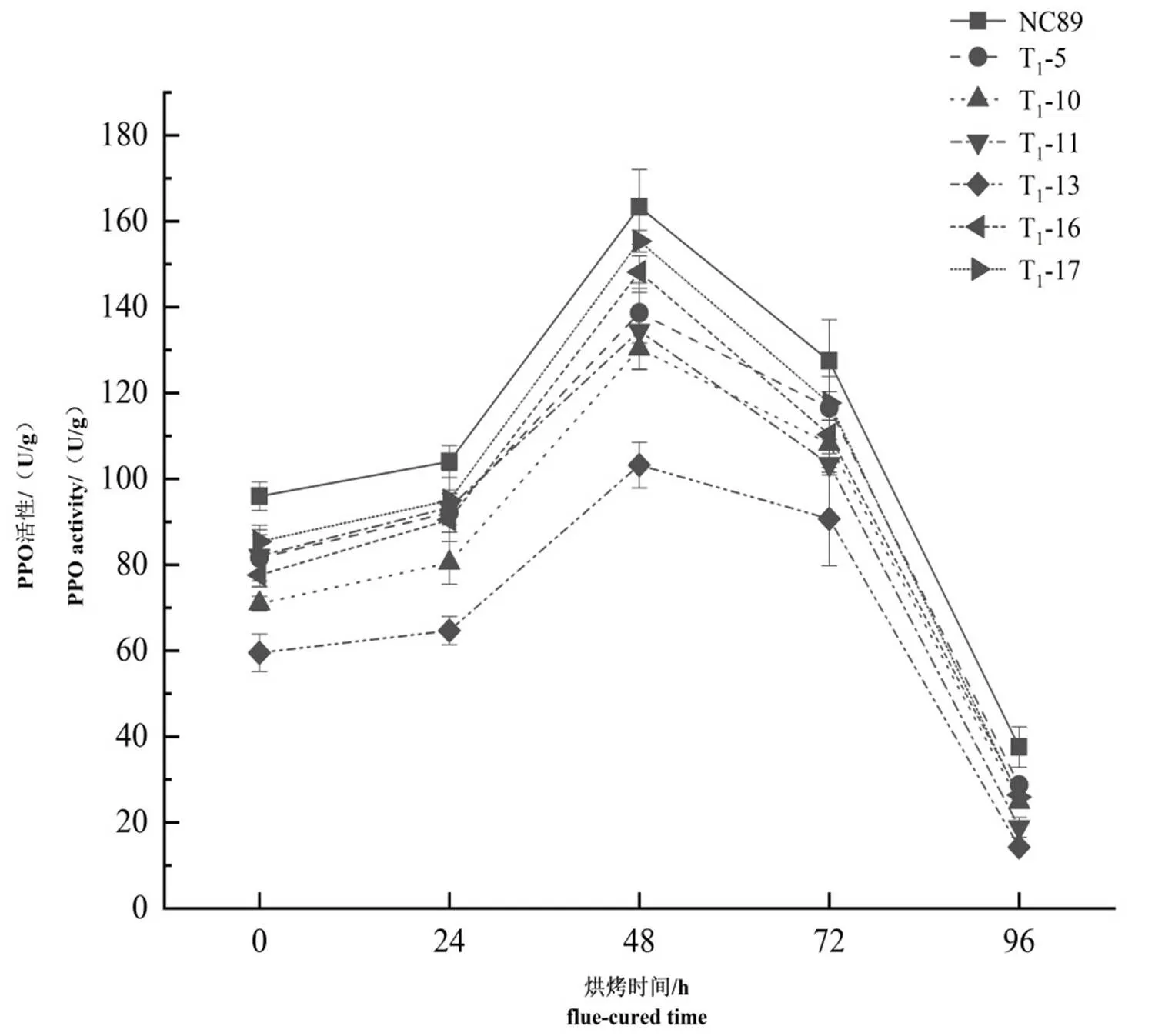
图11 T1代编辑植株烘烤过程中的PPO活性变化
2.6 T1代编辑植株烤后烟叶的多酚类物质含量差异
不同编辑植株的多酚物质含量存在差异(表2)。绿原酸含量表现为T1-13> T1-10> T1-11> T1-16> T1-5>NC89> T1-17,除T1-17外绿原酸含量在不同程度上高于原品种,其中T1-13、 T1-10和 T1-11与原品种相比差异显著。芸香苷含量表现为T1-13> T1-10> T1-17> T1-5> T1-16> T1-11> NC89,编辑植株的芸香苷含量均高于原品种。莨菪亭含量占总酚比例最小,T1-10和 T1-13莨菪亭含量显著高于原品种,其余处理差异不大。不同编辑植株的总酚含量表现为T1-13> T1-10> T1-5> T1-11> T1-16> T1-17> NC89,除T1-17外其他处理的总酚含量均显著高于原品种。总体来看,相比原品种NC89,T1代编辑植株的莨菪亭和芸香苷含量都有所上升,绿原酸除T1-17外都有所上升,最终表现为基因编辑植株的总酚含量显著高于原品种。说明编辑基因后能够提高烟株的多酚类物质含量。
表2 T1代编辑植株烤后烟叶的多酚类物质含量差异
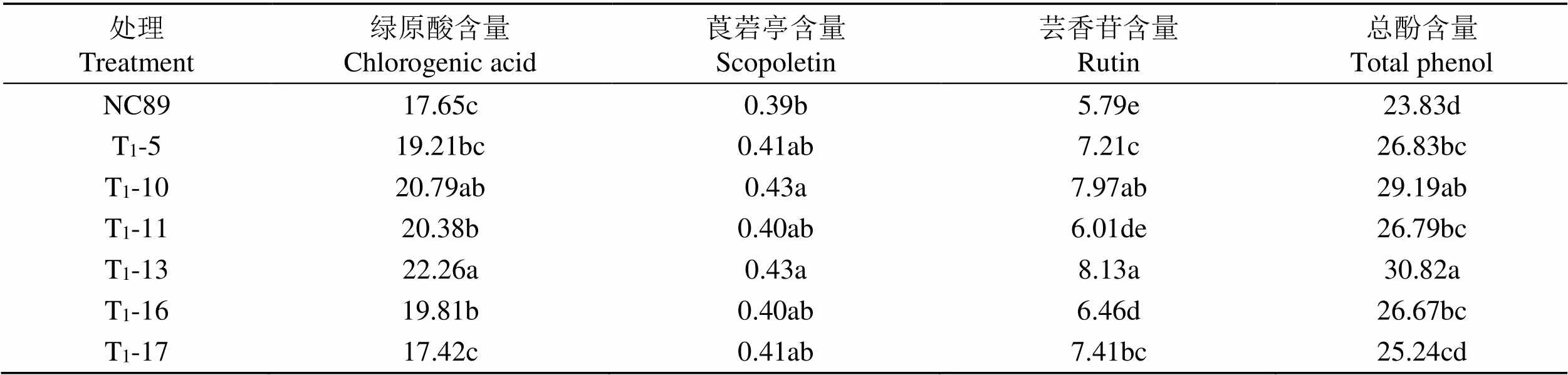
Tab.2 Content difference of polyphenols in T1 generation edited paints after curing
注:同组数字后标有不同小写字母表示处理间差异达到显著(<0.05)。
Note:The numbers in the same group are marked with different lowercase letters, indicating that the difference between treatments is significant (<0.05)
3 讨论
本研究利用CRISPR/Cas9技术,共获得6株纯合突变体,突变均发生在第二个靶位点序列上,突变比例达35.3%。基因测序峰图表明已经被定向编辑,其中T1-10、T1-13、T1-16和T1-17的基因表达量显著下降,这与张思琦等[27]、杜想想等[28]的研究结果一致。对纯合突变体氨基酸序列进行预测,由于在第2个靶位点上插入了单个碱基T/A引起了移码突变,导致编码肽链提前遇到终止密码子,翻译的氨基酸链大幅缩短。本研究结果表明,在叶龄60 d时,编辑株系的PPO活性显著低于原品种。
烟叶的耐烤性是指烤烟对烘烤环境的耐受程度,烟叶容易定色且不容易烤黑,说明烟叶的耐烤性好[29]。而在烟叶烘烤过程中,变黄后期和定色前期的PPO活性过高易导致酶促棕色化反应的发生,造成烟叶挂灰、蒸片、黑糟等。因此,降低变黄后期和定色前期的PPO活性能抑制烟叶酶促褐变的发生,有助于耐烤性的改善,减少烤黑现象的出现[30]。本研究结果表明,在烘烤过程中编辑植株的PPO活性低于原品种NC89,这说明基因编辑后能达到降低烟叶烘烤过程中PPO活性的目的,推测烟叶的耐烤性在一定程度上得到改善。
多酚类物质是烟草中重要的香气前提物质,与烟叶香气类型和香气量密切相关,对烟叶色泽和生理强度也都有很重要的作用[31]。烟草多酚类物质含量与烟草制品等级呈正相关[32]。适当地增加烟叶多酚类物质含量,有利于提高烟叶外观质量和感官质量。有研究表明,PPO酶活性与总酚含量呈显著负相关[18]。本试验研究结果表明,基因编辑后,烤后烟叶的总酚含量除T1-17外均显著高于原品种NC89,其中T1-13的绿原酸、莨菪亭和芸香苷以及总酚含量最高。这是由于基因编辑后,烘烤过程中的PPO活性下降导致酶促褐变消耗多酚类物质减少,这与前人研究结果相符[33]。
研究表明,PPO由多家族基因控制。李琼等[24]利用生物信息学方法从普通烟草基因组中鉴定出了10个基因;姚恒等[17]发现普通栽培烟草中的基因至少有15个(研究尚未发表)。单独编辑一个基因可能会引起其他基因在功能上的互补,出现烟株PPO活性下降不显著的现象。本研究单独编辑了基因,虽然对烟叶耐烤性的改善和烤后烟品质的提高有一定帮助,但想要使烟叶在烘烤过程中不易烤黑、容易定色,需要进一步研究其他基因对PPO活性的贡献率,以及基因之间的互补效应,有针对性地编辑多个基因,创制低PPO活性突变材料。
4 结论
本研究利用CRISPR/Cas9技术成功创制了6个定点突变材料,在纯合突变体中的基因表达量在一定程度上有所下降,突变植株的PPO活性显著下降,多酚类物质含量显著上升。为烟草基因功能的研究、烟叶耐烤性的改善和烤后烟品质的提高提供了可行方法。
[1] 张永芬,王平. 烟草多酚氧化酶生物信息学分析[J]. 湖北农业科学,2020, 59(8): 161-163.
ZHANG Yongfen, WANG Ping. Bioinformatics analysis of tobacco polyphenol oxidase[J]. Hubei Agricultural Sciences, 2020, 59(8): 161-163.
[2] 王丽,王万兴,索海翠,等. 植物中多酚氧化酶基因研究进展[J].分子植物育种,2020, 18(14): 4629-4636.
WANG Li, WANG Wanxing, SUO Haicui, et al. Research progress of polyphenol oxidase gene in plants[J]. Molecular Plant Breeding, 2020, 18(14):4629-4636.
[3] Boeckx Tinne, Winters Ana L, Webb K Judith, et al. Polyphenol oxidase in leaves: is there any significance to the chloroplastic localization?[J]. Journal of Experimental Botany, 2015, 66(12): 3571-9.
[4] 韩富根,赵铭钦,朱耀东,等. 烟草中多酚氧化酶的酶学特性研究[J]. 烟草科技, 1993(6): 33-36.
HAN Fugen, ZHAO Mingqin, ZHU Yaodong, et al. Study on the enzymatic characteristics of polyphenol oxidase in tobacco[J]. Tobacco Science & Technology, 1993(6): 33-36.
[5] 韩富根,焦桂珍,刘学芝,等. 烟草叶片多酚氧化酶的提取及其特性研究[J]. 河南农业大学学报,1995(1): 98-102.
HAN Fugen, JIAO Guizhen, LIU Xuezhi, et al. Study on the extraction of polyphenol oxidase from tobacco leaves and its characteristics[J]. Journal of Henan Agricultural University, 1995(1): 98-102.
[6] 宫长荣. 烟草调制学[M]. 北京:中国农业科技出版社,2003: 189-194.
GONG Changrong. Tobacco curing[M].Beijing: China Agricultural Science and Technology Press, 2003:189-194.
[7] 雷东锋,蒋大宗,王一理. 烟草中多酚氧化酶的生理生化特征及其活性控制的研究[J]. 西安交通大学学报,2003(12): 1316- 1320.
LEI Dongfeng, JIANG Dazong, WANG Yili. Physiological and biochemical characteristic of tobacco polyphenol oxidase and control way for its activity[J]. Journal of Xi'an Jiaotong University, 2003(12): 1316-1320.
[8] 雷东锋,马长德,莫晓燕,等. 几种抑制剂对烟叶PPO活性的影响[J]. 农学生物技术学报,2002, 10 (增刊): 67-68.
LEI Dongfeng, MA Changde, MO Xiaoyan, et al. Inhibition of several inhibitors on activity of polyphenol oxidase in tobacco leaves[J]. Journal of Agricultural Biotechnology, 2002, 10(s): 67-68.
[9] Liu Weiqun, Rao Xueming, Pan Jicheng, et al. Kinetics of inhibition of polyphenol oxidase obtained from tobacco ()[J]. Tsinghua Science and Technology, 2004, 9 (1) :94-97.
[10] 肖厚荣,徐小龙,解永树,等. 胱氨酸与烟草多酚氧化酶相互作用的研究[J]. 光谱学与光谱分析,2004(12): 1618-1622.
XIAO Hourong, XU Xiaolong, XIE Yongshu, et al. Study on the interaction of cystine and polyphenol oxidase from[J]. Spectroscopy and Spectral Analysis, 2004(12): 1618-1622.
[11] 肖厚荣,朱仁发,徐小龙,等. 硫酸铜诱导烟草多酚氧化酶抗变性的研究. 安徽省,中国科学技术大学,2009-01-01.
XIAO Hourong, ZHU Renfa, XU Xiaolong, et al. Studies on Cu2+-induced resistant-denaturation of PPO from[J]. Chinese Journal of Chemical Physics, 2004(5): 587-591.
[12] 李明. 抑制剂对PPO活性及烟叶烘烤效果影响的研究[D]. 泰安:山东农业大学,2009.
LI Ming. Effect of inhibition on PPO activity and flue-curing impact of tobacco leaves[D]. Shandong Agricultural University, 2009.
[13] 张元. Cu2+对植物多酚氧化酶源酶促氧化合成茶黄素效果的影响[D]. 杨凌: 西北农林科技大学,2015.
ZHANG Yuan. Cu2+effect on different kinds of plants polyphenol oxidase enzymatic oxidation synthesizing thea-flavins[D]. Northwest A&F University, 2015.
[14] 雷东锋,冯怡,梅建生,等. 烟草中多酚氧化酶的特征分析及应用展望[J].中国烟草科学, 2003(2):2-5.
LEI Dongfeng, FENG Yi, MEI Jiansheng, et al. Charactization and prospect of application of polyphenol oxidase in tobacco plants. Chinese Tobacco Science, 2003(2):2-5
[15] 李玉娥, 尹启生, 宋纪真, 等. 烟草酶促棕色化反应及调控技术研究进展[J].中国烟草科学, 2008, 29(6):71-77.
LI Yue, YIN Qisheng, SONG Jizhen, et al. Research advances in tobacco enzymatic browning reaction and its control techniques[J]. Chinese Tobacco Science, 2008, 29(6):71-77.
[16] 池明.采用人造小RNA技术抑制马铃薯多酚氧化酶的研究[D].杨凌:西北农林科技大学, 2014.
CHI Ming. Reduced polyphenol oxidase gene expression in potato (L.) with artificial micrornas[D]. Northwest A&F University ,2014.
[17] 姚恒,杨大海,白戈,等. 利用CRISPR/Cas9技术定点敲除烟草多酚氧化酶基因[J].生物技术通报,2018, 34(11): 97-102.
YAO Heng, YANG Dahai, BAI Ge, et al. CRISPR/Cas9-mediated targeted knockout of polyphenol oxidasegene in[J]. Biotechnology Bulletin, 2018, 34(11): 97- 102.
[18] 段杜薇,田培,李芳芳,等. 多酚氧化酶基因差异表达的效应分析[J]. 分子植物育种,2021, 19(3): 724-729.
DUAN Duwei, TIAN Pei, LI Fangfang, et al. Effect of differential expression of polyphenol oxidase gene[J]. Molecular Plant Breeding, 2021, 19(3): 724-729.
[19] 王传义,吕国新,朱启法,等. 烤烟烘烤特性与烟草多酚氧化酶活性相关性研究[J]. 湖北农业科学,2016, 55(6): 1495-1499, 1503.
WANG Chuanyi, LV Guoxin, ZHU Qifa, et al. Study on the correlation between the leaf flue-curing characteristics and polyphenol oxidase activity of different flue-cured tobacco[J]. Hubei Agricultural Sciences, 2016, 55(6):1495-1499, 1503.
[20] 曹阳. 种植密度对烤烟成熟期光合特性和烘烤特性的影响[D].广州:华南农业大学,2019.
CAO Yang. Effects of planting density on photosynthetic at maturity stage characteristics and curing characteristics of flue-cured tobacco leaves [D]. South China Agricultural University, 2019.
[21] 武圣江,涂永高,詹军,等. 不同打顶方式对烤烟上部叶烘烤特性的影响[J]. 江西农业学报,2019, 31(6): 68-73.
WU Shengjiang, TU Yonggao, ZHAN Jun, et al. Effects of different topping methods on curing characteristics of upper flue-cured tobacco leaves[J]. Acta Agriculturae Jiangxi, 2019, 31(6): 68-73.
[22] 武圣江,莫静静,娄元菲,等. 不同烤烟品种不同成熟度上部叶烘烤特性研究[J]. 核农学报,2020, 34(6): 1337-1349.
WU Shengjiang, MO Jingjing, LOU Yuanfei, et al. Difference of curing characteristics of upper leaves with different maturity in different flue-cured tobacco varieties[J].Journal of Nuclear Agricultural Sciences, 2020, 34(6):1337-1349.
[23] 李贤慧,俞锞,李峥,等. 成熟度对烟叶烘烤特性及烤后品质的影响[J]. 天津农业科学,2020, 26(4): 60-63.
LI Xianhui, YU Ke, LI Zheng, et al. Effect of maturity on curing characteristics and quality of tobacco leaves[J]. Tianjin Agricultural Sciences, 2020, 26(4):60-63.
[24] 李琼,王雪云,宋卫武,等. 普通烟草基因家族的鉴定与表达分析[J]. 烟草科技,2018, 51(8): 9-13.
LI Qiong, WANG Xueyun, SONG Weiwu, et al. Identification and expression analysis ofgene family in[J]. Tobacco Science, 2018, 51(8): 9-13.
[25] 曾千春,李旭刚,马炳田,等. 有效去除农杆菌和籼稻转化系统优化[J]. 分子植物育种,2003(Z1): 783-790.
ZENG Qianchun, LI Xugang, MA Bingtian, et al. Efficient elimination ofand optimization of- mediated transformation of indica rice[J]. Molecular Plant Breeding, 2003(Z1): 783-790.
[26] 国家烟草专卖局. YC/T 202—2006烟草及烟草制品多酚类化合物绿原酸、莨菪亭和芸香苷的测定[S]. 北京:中国标准出版社. 2006.
State Tobacco Monopoly Administration. YC/T 202-2006 Determination of chlorogenic acid, scopolamineand rutin in tobacco and tobacco products[S]. Beijing:China Standards Press, 2006.
[27] 张思琦,何佳,贺凌霄,等. 基于CRISPR/Cas9技术的烟草基因敲除及功能分析[J]. 烟草科技,2020,53(5): 17-25.
ZHANG Siqi, HE Jia, HE Lingxiao, et al. CRISPR/Cas9-mediated targeted mutagenesis and function analysis ofin[J]. Tobacco Science, 2020, 53(5):17-25.
[28] 杜想想,赵亚帆,赵晨云,等. 基于CRISPR/Cas9技术的水稻突变体的构建[J]. 华北农学报,2021, 36(3): 7-14.
DU Xiangxiang, ZHAO Yafan, ZHAO Chenyun, et al.Construction of ricemutant based on CRISPR/Cas9 technology[J]. Acta Agriculturae Boreali-Sinica, 2021, 36(3):7-14.
[29] 王传义. 不同烤烟品种烘烤特性研究[D]. 北京:中国农业科学院,2008.
WANG Chuanyi. Study on the leaf curing characteristics of different varieties of flue-cured tobacco[D]. Chinese Academy of Agricultural Sciences, 2008.
[30] 杨树勋. 烟草酶促棕色化反应机理及其调控研究进展[J]. 作物研究,2019, 33(3): 246-250.
YANG Shuxun. Study on mechanism and regulation technology of enzymatic browning oftobacco[J].Crop Research, 2019, 33(3): 246-250.
[31] 贺文俊,何佳,孙志浩,等. 烟草烟叶多酚类物质代谢影响因素的研究进展[J]. 贵州农业科学,2019, 47(2): 4-7.
HE Wenjun, HE Jia, SUN Zhihao, et al. Research progress on factor affecting metabolism of polyphenols in flue-cured tobacco leaves[J].Guizhou Agricultural Sciences, 2019, 47(2): 4-7.
[32] 杨慧芹,王莎莎,金云峰,等. 生长温度对不同生育期烟草多酚物质代谢的影响[J].基因组学与应用生物学,2015, 34(9): 1957-1974.
YANG Huiqin, WANG Shasha, JIN Yunfeng, et al.Effects of different growth temperature on polyphenols metabolism in tobacco(L.) leaves at different growth stages[J]. Genomics and Applied Biology, 2015, 34(9): 1957-1974.
[33] 孟莉,郭世英,符云鹏,等. 吉林晒烟多酚类物质及其相关酶活性的变化动态[J]. 中国烟草科学,2014, 35(6): 59-64.
MENG Li, GUO Shiying, FU Yunpeng, et al. Dynamic changes of polyphenol contents and enzyme relating to polyphenol synthesis in sun-cured tobacco in Jilin[J].Chinese Tobacco Science|Chin Tob Sci, 2014, 35(6):59-64.
Effect analysis of editing flue-cured tobacco polyphenol pxidase gene
DAI Zhuoyi1, LI Hongliang2, YAO Yifan1, ZHANG Xi3, XUE Gang1, DING Yongle1, ZHANG Zhiqiang1, YANG Tiezhao1*
1 College of Tobacco,Henan Agricultural University, Zhengzhou 450002, China;2 Xiangxian Branchof Xuchang Tobacco Company, Xuchang 461000, China;3 Technology Center, China Tobacco Shaanxi Industrial Co., Ltd., Baoji 721013, China
[] This study aims to explore the function ofgene in tobacco as well as its influence on tobacco leaf curing tolerance and quality of flue-cured tobacco. [] Using flue-cured tobacco variety NC89 as material,was directionally edited by CRISPR/Cas9 technology to obtain homozygous mutant plants. The differences in gene expression levels and plant polyphenol oxidase (PPO) activity between the original variety and the mutant at leaf age of 60 days were determined and analyzed, so as to explore the effect ofgene on the PPO activity during the curing process and the content of polyphenols in the tobacco after curing. [] (1) A total of 6 strains of T0homozygous mutants were obtained, all mutations occurred at the target site, which belong to 1 base insertion mutations. (2) The expression levels ofin the four T1generation edited lines were significantly decreased, and the PPO activities of all edited lines were significantly decreased. (3) The PPO activity of the edited lines in T1generation during curing was lower than that of the wild type, and the total phenolic content of the middle leaves after curing was significantly higher than that of the original variety. [] Directional editing of thegene reduced its expression in tobacco leaves, inhibited the PPO activity of tobacco leaves during the curing process, and contributed to the accumulation of polyphenols in tobacco after curing.
flue-cured tobacco;CRISPR/Cas9;;gene editing;polyphenol oxidase(PPO)
. Email:yangtiezhao@126.com
代卓毅,李洪亮,姚怡帆,等. 编辑烤烟多酚氧化酶基因NtPPO8后的效应分析[J].中国烟草学报,2022,28(5).
DAI Zhuoyi, LI Hongliang, YAO Yifan, et al. Effect analysis of editing flue-cured tobacco polyphenol pxidase gene NtPPO8[J]. Acta Tabacaria Sinica, 2022,28(5).
10.16472/j.chinatobacco. 2021.T0249
河南省烟草公司许昌市公司科技项目“彰显NC89浓香型风格配套标准化技术体系构建研究”(No.2020411000240069)
代卓毅(1997—),硕士研究生,主要从事烟草遗传育种与品质改良,Tel:18703971647,Email:daizhuoy@163.com
杨铁钊(1956—),教授,博士生导师,主要从事烟草遗传与育种以及新品种选育研究,Tel:0371-63558093,Email:yangtiezhao@126.com
2021-12-31;
2022-06-22

