吉富罗非鱼组蛋白酶B基因克隆及无乳链球菌感染后的表达分析
朱佳杰,敖秋桅,谭芸,罗永巨,蒋和生
(1广西水产科学研究院,广西南宁 530021;2广西民族大学,广西南宁 530006;3广西大学,广西南宁 530004)
0 引言
【研究意义】罗非鱼是我国重要的水产养殖品种,随着养殖规模及集约化程度的不断提高,其病害频繁暴发,尤其是无乳链球菌病已成为制约罗非鱼养殖业发展的瓶颈难题(郭富强等,2018;罗伟等,2018;敖秋桅和朱佳杰,2020)。培育优良品种是解决罗非鱼病害问题的有效途径之一。抗病性状是水产养殖品种选育的重要经济性状,筛选出抗病力强、养殖成活率高的品种,才能获得更高的经济效益。近年来,利用与目标性状紧密连锁的基因对经济性状进行选择,已成为鱼类育种的主流方向(鲁翠云等,2019)。鱼类抗病性状是受多基因调控的数量性状,寻找抗病关键基因对后续开展分子育种显得尤为重要(陈松林等,2008;沈夏霜等,2018),即开展鱼类抗病相关基因的筛选及功能研究可为其抗病分子育种提供基因资源。【前人研究进展】组织蛋白酶B(Cathepsin B,CtsB)属于半胱氨酸蛋白酶家族(Zhang et al.,2008;Toomey et al.,2014;黄媛等,2016;徐扬等,2021),主要位于溶酶体中,参与机体多种生理和生物学过程,尤其在宿主防御病原体感染过程中发挥重要作用(Niu et al.,2013;朱鹏等,2020)。鉴于CatB基因在机体抵抗病原侵染中的重要性,已在多个水产物种上得到研究报道。牙鲆(Paralichthys olivaceus)CatB基因cDNA序列全长1801 bp,共编码330个氨基酸残基,牙鲆感染弹状病毒后其脾脏、头肾、肠道、鳃和肌肉等组织中的CatB基因相对表达量较感染前上调10倍以上(Zhang et al.,2008)。皱纹盘鲍(Haliotis discus hannai)感染弧菌后多个组织的CatB基因表达上调,且CatB重组蛋白对鳗弧菌具有明显的抗性作用,表明在皱纹盘鲍抵御细菌侵染过程中CatB主要参与免疫反应(Qiu et al.,2013)。斑点叉尾鮰(Ictalurus punctatus)感染柱状黄杆菌和爱德华氏菌后,其黏膜中的CatB基因表达量显著上调,暗示CatB基因在黏膜免疫中发挥重要作用(Li et al.,2015)。此外,过表达CatB基因可显著抑制卵形鲳鲹(Trachinotus ovatus)感染爱德华氏菌,敲除CatB基因后卵形鲳鲹对爱德华氏菌的敏感性增加(Shen et al.,2021)。【本研究切入点】至今,CatB基因已在多个水产物种上得到研究报道,但有关罗非鱼CatB基因的研究尚无文献报道。【拟解决的关键问题】从不同抗性吉富罗非鱼感染无乳链球菌后脾脏转录组数据库中筛选出显著差异表达的CatB基因,通过RACE克隆罗非鱼CatB基因cDNA序列,并探究感染无乳链球菌前后的表达差异,为深入研究罗非鱼抗无乳链球菌感染的免疫应答机制及通过SNP分子标记/基因组编辑技术快速获得吉富罗非鱼抗病新品种提供科学依据。
1 材料与方法
1.1 试验鱼来源及样品采集
供试吉富罗非鱼取自广西水产科学研究院那马中试基地,在前期选育的吉富罗非鱼抗病家系和易感家系中各随机筛选100尾,平均体重约60 g/尾。运回实验室暂养1周,待鱼适应实验室环境后再开展人工感染无乳链球菌试验。无乳链球菌(HN016菌株)由广西水产科学研究院鱼病研究室提供,菌株复壮后通过人工腹腔注射的方法分别感染抗病群体和易感群体,菌株半数致死浓度为1.1×108CFU/mL,注射剂量为0.2 mL/尾,以注射等量PBS为空白对照,攻毒后的鱼群置于30℃的大水桶中养殖观察(沈夏霜等,2018)。于感染前(0 h)、感染后5 h、感染后50 h及感染后7 d分别随机挑选抗病群体、易感群体及对照组群体罗非鱼各9尾,采集其脑、鳃、肝脏、脾脏、头肾、肠道、皮肤和肌肉等组织样品,-80℃保存备用。
1.2 基因组DNA/RNA提取与反转录
采用海洋动物基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取基因组DNA,以0.8%琼脂糖凝胶电泳检测DNA提取效果。同时采用TRIzol Reagent试剂盒(OMEGA)提取总RNA,以核酸蛋白定量仪(Bio-Rad Smart Spec Plus)检测RNA纯度及完整性,并用cDNA Synthesis Reagent Kit试剂盒(TaKaRa)反转录合成cDNA。
1.3 CtsB基因cDNA序列扩增
根据从吉富罗非鱼转录组数据库(Zhu et al.,2018)检索的CtsB基因部分序列,设计RACE扩增引物(表1)用于扩增CtsB基因cDNA序列。RACE反应体系25.0μL:2×ESTaqMasterMix(含染料)12.5μL,通用引物UPM 1.0μL,3′-GSPs 1.0μL,3′-cDNA模板1.0μL,RNase-free H2O 9.5μL。扩增程序:94℃预变性2 min;94℃30 s,60℃30 s,72℃2 min,进行40个循环;72℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳回收后克隆至pMD18-T载体上,并送至上海捷瑞生物工程有限公司测序。
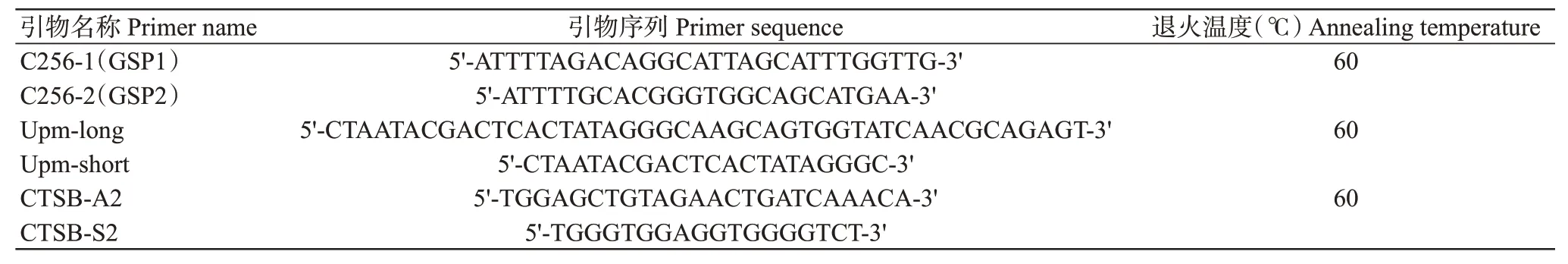
表1 吉富罗非鱼CtsB基因扩增引物序列信息Table 1 Primer sequence information of CtsB gene in GITF tilapia
1.4 生物信息学及系统进化分析
采用DNAMAN 6.0对测序结果进行编辑,并与原始基因片段进行拼接整合,得到完整的CtsB基因cDNA序列;使用SMART和Splign分析基因结构,运用MEGA v6.0和BoxShade进行氨基酸序列比对分析。从NCBI下载已公布的其他物种CtsB基因cDNA序列,通过Lasergene 7.0的MegAlign程序进行多序列比对分析及构建系统发育进化树。
1.5 实时荧光定量PCR扩增
按照TaKaRa SYBR®Green I Premix ExTaqTM试剂盒(TaKaRa)说明进行实时荧光定量PCR扩增,反应体系20.0μL:SYBR qPCR Master Mix 10.0μL,上、下游引物各0.4μL,cDNA模板5.0μL,ddH2O 4.2μL。扩增程序:95℃预变性5 min;95℃10 s,60℃30 s,进行40个循环(扩增读取荧光信号);95℃15 s,65℃1 min(读取熔解曲线);95℃15 s,40℃30 s(冷却)。以β-actin为内参基因(GenBank登录号XM_003455636),采用2-ΔΔCt法计算CtsB基因相对表达量,并以SPSS 22.0进行单因素方差分析(One-way ANOVA)及Duncan's多重比较。
2 结果与分析
2.1 吉富罗非鱼CtsB基因cDNA序列分析结果
经测序比对获知,吉富罗非鱼CtsB基因cDNA序列全长1746 bp,其中5′端非编码区(5′-UTR)为161 bp,3′端非编码区(3′-UTR)为592 bp,开放阅读序列(ORF)为993 bp,共编码331个氨基酸残基,包括218个保守氨基酸残基(图1)。
2.2 吉富罗非鱼CtsB蛋白二、三级结构预测结果
SOMPA预测结果(图2)显示,吉富罗非鱼CtsB蛋白二级结构包含42个α-螺旋(占16.94%)、49个β-转角(占19.76%)、23个无规则卷曲(占9.27%)和134个延伸链(占54.03%)。以SWISS-MODEL预测吉富罗非鱼CtsB蛋白三级结构,结果发现吉富罗非鱼CtsB蛋白三级结构与人类CtsB蛋白的结构相似(图3)。
2.3 吉富罗非鱼CtsB氨基酸序列同源比对分析结果
吉富罗非鱼CtsB氨基酸序列与其他19个物种的CtsB氨基酸序列进行同源比对分析,结果显示,吉富罗非鱼与奥利亚罗非鱼(O.aureus,XP_0315867 61.1)的CtsB氨基酸序列相似性最高,为99.39%。基于CtsB氨基酸序列相似性,构建吉富罗非鱼与奥利亚罗非鱼、乌鳢(Channa argus,KAF3686289.1)、大菱鲆(Scophthalmus maximus,XP_035484582.1)、牙鲆(XP_019935873.1)、鲤鱼(Cyprinus carpio,XP_018937282.2)、欧洲鳗鲡(Anguilla anguilla,KAG 5847099.1)、黄金鲈(Perca flavescens,TDH17225.1)、卵形鲳鲹(QCV57273.1)、军曹鱼(Rachycentron canadum,AWM30698.1)、尖吻鲈(Lates calcarifer,XP_018522457.1)、点带石斑鱼(Epinephelus coioides,AHF27212.1)、鳜鱼(Siniperca chuatsi,XP_0440368 81.1)、黄鳍棘鲷(Acanthopagrus latus,XP_0369519 29.1)、大黄鱼(Larimichthys crocea,XP_010730616.2)、大刺鳅(Mastacembelus armatus,XP_026149893.1)、大口黑鲈(Micropterus salmoides,XP_038557705.1)、青鱂(Oryzias latipes,XP_020555295.2)及半滑舌鳎(Cynoglossus semilaevis,XP_024911145.1)的系统发育进化树,结果(图4)显示,吉富罗非鱼先与奥利亚罗非鱼聚为一小分支,再与乌鳢聚为一支,即吉富罗非鱼与奥利亚罗非鱼的亲缘关系最近,而与鲤鱼、大菱鲆、牙鲆、半滑舌鳎等物种相距较远。
2.4 吉富罗非鱼CtsB基因组织表达谱
实时荧光定量PCR检测结果显示,CtsB基因在吉富罗非鱼的肝脏、脾脏、鳃、前肾、脑、肠道、皮肤和肌肉等组织中均有表达(图5)。其中,以鳃组织中的相对表达量最高,是其他器官组织的2.0~3.0倍(P<0.05,下同);其次在肠道、肝脏和皮肤中也检测到较高水平的相对表达量,而在脾脏、肌肉、脑和头肾等组织中的相对表达量较低。
2.5 感染无乳链球菌后CtsB基因的表达变化
2.5.1 感染无乳链球菌后CtsB基因在吉富罗非鱼脾脏中的表达变化吉富罗非鱼抗病家系和易感家系感染无乳链球菌(HN016菌株)后,CtsB基因在其脾脏中的表达情况如图6所示。在人工感染前(0 h),易感家系脾脏的CtsB基因相对表达量是抗病家系的3.0倍;感染后5 h,2个家系的CtsB基因相对表达量均呈显著的上调趋势,且抗病家系的上调表达倍数高于易感家系;感染后50 h,2个家系的CtsB基因相对表达量均达峰值,与感染前(0 h)相比其相对表达量分别显著上调7.2倍和2.1倍;至感染后7 d,2个家系的CtsB基因相对表达量呈明显下调趋势,且抗病家系的下调幅度大于易感家系。
2.5.2 感染无乳链球菌后CtsB基因在吉富罗非鱼肾脏中的表达变化感染无乳链球菌后,吉富罗非鱼抗病家系和易感家系CtsB基因在肾脏中的表达情况如图7所示。在人工感染前(0 h),易感家系和抗病家系肾脏中的CtsB基因相对表达量差异不显著(P>0.05,下同);感染后5 h,2个家系的CtsB基因相对表达量均显著上调,且抗病家系的上调幅度大于易感家系;至感染后50 h,抗病家系和易感病家系的肾脏CtsB基因相对表达量均达峰值,与感染前(0 h)相比分别显著上调14.6倍和10.9倍;至感染后7 d,2个家系的CtsB基因相对表达量均下调至感染前的水平。
2.5.3 感染无乳链球菌后CtsB基因在吉富罗非鱼肝脏中的表达变化感染无乳链球菌后,吉富罗非鱼抗病家系和易感家系CtsB基因在肝脏中的表达情况图8所示。在人工感染前(0 h),抗病家系和易感家系肝脏中的CtsB基因相对表达量也无显著差异;感染后5 h,2个家系的CtsB基因相对表达量显著上调并达峰值,抗病家系和易感家系的上调倍数分别为5.0倍和4.1倍;至感染后50 h,2个家系的CtsB基因相对表达量均呈下降趋势,但相对表达量仍高于感染前(0 h);至感染后7 d,2个家系的CtsB基因相对表达量均下调至感染前的水平。
3 讨论
CtsB是一种半胱氨酸蛋白酶,广泛存在于动植物体内的多各器官中(黄媛等,2016)。大量研究表明,脊椎动物中的CtsB基因参与多种生理生化反应,且在不同器官组织中其功能和作用各不相同(黄媛等,2016)。在哺乳动物中,普遍认为CtsB在抗原降解和抗原提呈的过程中发挥关键性作用(Wei et al.,2014)。本研究克隆吉富罗非鱼CtsB基因cDNA序列,并分析不同抗性吉富罗非鱼感染无乳链球菌后CtsB基因的表达差异,研究结论有助于深入了解罗非鱼抗病免疫的分子机制,为罗非鱼抗病育种提供新思路。
本研究通过RACE扩增获得吉富罗非鱼CtsB基因cDNA序列,其cDNA序列全长1746 bp,包括161 bp的5′-UTR、592 bp的3′-UTR及993 bp的ORF,共编码331个氨基酸残基;将吉富罗非鱼CtsB基因cDNA序列提交至NCBI并与其他鱼类的CtsB基因进行比对分析,结果发现鲤鱼(Tan et al.,2006)、牙鲆(Zhang et al.,2008)、斑点叉尾鮰(Li et al.,2015)的CtsB基因cDNA序列全长分别为1580、1801和1470 bp,但均编码330个氨基酸残基。不同硬骨鱼类间的CtsB基因cDNA序列长度差异可能与其进化过程有关。此外,本研究基于CtsB氨基酸序列相似性采用MEGA v6.0中的邻接法构建系统发育进化树,结果显示,吉富罗非鱼与同为丽鱼科的奥利亚罗非鱼聚为一支,而与鲤鱼(鲤科)、大菱鲆(菱鲆科)、牙鲆(鲆科)、半滑舌鳎(舌鳎科)等物种相距较远,进一步验证CtsB基因在鱼类的进化过程中具有高度保守性。
为阐明CtsB基因在吉富罗非鱼抵抗无乳链球菌侵染过程中发挥的作用机制,本研究通过构建吉富罗非鱼CtsB基因的组织表达谱,并比较不同抗性吉富罗非鱼感染无乳链球菌后CtsB基因在免疫相关组织(脾脏、肾脏和肝脏)中的表达差异,结果发现,CtsB基因在吉富罗非鱼的肝脏、脾脏、鳃、前肾、脑、肠道、皮肤和肌肉等组织中均有表达,且以鳃组织中的相对表达量最高,是其他器官组织的2.0~3.0倍,说明在正常状态下CtsB基因主要参与机体的能量代谢;但大菱鲆以肌肉中的CtsB基因相对表达量最高(Xiao et al.,2010),牙鲆以鳃组织和肠道中的CtsB基因相对表达量较高(Ahn et al.,2013),黄花鱼则以脾脏中的CtsB基因相对表达量最高(Li et al.,2014)。可见,CtsB基因在不同物种中的表达模式存在明显差异,故推测CtsB在不同物种中的作用也不同。
硬骨鱼类主要的免疫器官是脾脏和肾脏。本研究结果表明,在感染前(0 h)吉富罗非鱼易感家系脾脏的CtsB基因相对表达量是抗病家系的3.0倍,但无乳链球菌感染后5和50 h抗病家系的上调幅度显著大于易感家系,说明CtsB基因高表达有助于减轻无乳链球菌对脾脏组织的损失,进而降低吉富罗非鱼发病死亡率。肾脏是吉富罗非鱼的重要排泄器官,吉富罗非鱼抗病家系和易感家系在感染前(0 h)的CtsB基因相对表达量差异不显著,至感染后50 h时达峰值,与感染前(0 h)相比分别显著上调14.6倍和10.9倍,且抗病家系的相对表达量显著高于易感家系,表明CtsB基因高表达还有助于缓解无乳链球菌对肾脏的损伤,减轻肾小管的变性与坏死。肝脏是鱼类能量合成和解毒的重要器官,也是机体维持生理机能的核心,在病原菌侵染下肝脏也会出现不同程度的损伤,并影响其生理功能(刘问,2019)。本研究发现,在无乳链球菌感染后5 h,吉富罗非鱼抗病家系和易感家系肝脏的CtsB基因相对表达量显著上调并达峰值,可能是肝脏需要合成更多的能量物质以应对病原菌入侵,而感染后50 h的CtsB基因相对表达量显著下降,说明肝脏组织因无乳链球菌入侵已受损,进而影响机体的能量合成和解毒机能,导致其抗病能力下降。综上所述,CtsB基因在吉富罗非鱼抵御无乳链球菌入侵过程中发挥着重要的免疫作用。
4 结论
CtsB基因在鱼类的进化过程中具有高度保守性,但在不同物种中的表达模式存在明显差异。CtsB基因是吉富罗非鱼的重要免疫因子,在抵御无乳链球菌入侵过程中发挥着重要的免疫作用,可作为罗非鱼抗病育种的SNP分子标记给予开发利用。

