低温冻存胃肠道肿瘤样本对其生物大分子的影响
吴彬,孙溶励,杨心妮,赵明洲,李玉强
(锦州医科大学附属第一医院临床生物样本中心,辽宁 锦州 121000)
在人类疾病的研究中,生物样本在由临床向基础医学转化的过程中发挥着不可替代的作用。随着现代生物医学技术的不断更新与发展,在全球范围内越来越多的研究加大了研究对象的规模以及通量,而这些研究对生物样本的数量以及质量提出了更高的要求[1-2]。研究表明使用优质的生物样本才能得到精准的实验结果,才能为之后的研究提供有价值的信息,而使用低质量生物样本的研究可能由于数据不准确,不能更好地反馈临床疾病的治疗,因此高质量的生物样本才是临床疾病与转化医学研究中的重要保障[3-4]。
随着样本存储方式的多元化,传统的石蜡包埋样本在实验研究中的优势渐弱,其很难满足日益增长的高质量肿瘤标本的需求[5]。以往众多研究采用的肿瘤标本仅依据课题需要临时收集,导致研究结果对比性差、时间跨度小、连贯性差,也造成许多有价值的肿瘤标本及其相关数据的流失。生物样本库中存储的肿瘤组织能弥补这方面的不足,开始成为肿瘤基础研究和临床研究的重要标本来源[6]。而长时间低温冻存肿瘤组织标本是否影响其生物大分子活性与完整性,学术界一直存在争议[7]。目前认为低温保存下组织样本的生物大分子基本不会发生降解,可用于不同的实验研究,然而长时间的低温冻存可能会影响其稳定性,带来一定程度的降解。为阐明这一问题,本研究选择我院外科胃肠道肿瘤组织标本库内冻存时间长短不一的胃癌及结直肠癌标本作为研究对象,对存储组织样本的DNA、RNA及蛋白质的纯度和完整性进行分析,旨在了解长期冻存对胃肠道肿瘤组织生物大分子的影响。
1 材料与方法
1.1 组织样本
随机选取2014年1月至2021年1月间锦州医科大学附属第一医院临床生物样本中心采集、冻存的结直肠癌样本及胃癌样本的癌组织、癌旁组织及正常组织共96份。所有组织样本的切取均由资深临床外科医生操作,组织样本在离体后30 min内完成采集,分装到装有RNA保存液的冻存管中,快速转入液氮内,然后放入-80 ℃冰箱中冻存。采集顺序按正常组织(距肿瘤边缘>5 cm)、癌旁组织(距肿瘤边缘≤3 cm)、肿瘤组织分别进行切取,癌旁组织、正常组织取相同部位的“黏膜组织”样本,每份样本大小约为0.5 cm3。所选取样本的患者在术前均未接受过放化疗。样本编号与肿瘤部位、冻存时间的对应关系,见表1,其中用T代表肿瘤组织,P代表癌旁组织,N代表正常组织,S代表胃部,C代表结直肠。
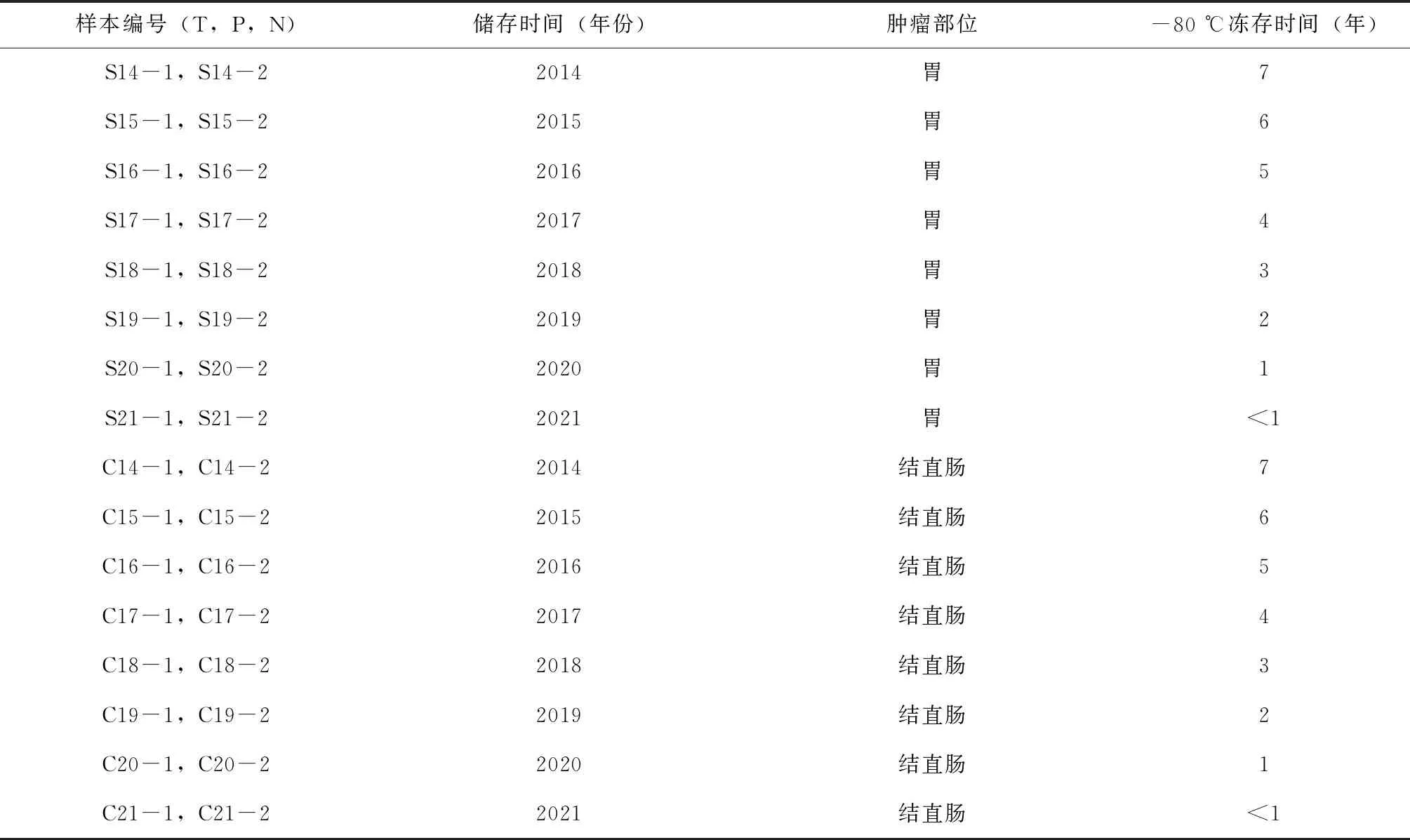
表1 样本编号与肿瘤部位、冻存时间的对应关系
1.2 癌组织样本肿瘤含量评估
本中心每一例患者的组织均会分装成体积相等的3~5管进行冻存,取出1管癌组织经固定、水洗、浸蜡以及包埋后进行组织切片,由资深的病理医师阅片,评估该组织中肿瘤细胞含量。本研究所有癌组织中肿瘤细胞的含量均大于60%。
1.3 核酸提取及质量控制
DNA采用Tissue DNA Kit(OMEGA,美国)进行提取。DNA纯度A260/A280比值的测定采用分光光度计(Thermo,NanoDrop 2000,美国)。DNA完整性通过1%琼脂糖凝胶电泳评估,组织样本的上样量为5 μL,电泳时间30 min,电泳条带利用垂直电泳系统(ChemiDoc XRS,BIO-RAD,美国)和凝胶成像系统观察。RNA采用Tissue RNA Kit(OMEGA,美国)进行提取。RNA纯度A260/A280比值的测定采用分光光度计(Thermo,NanoDrop 2000,美国)。RNA完整性通过生物分析仪(Agilent 2100,美国)测定RNA分子完整数(RNA integrity number,RIN)。
1.4 蛋白质提取及质量控制
采用M-PER哺乳动物总蛋白提取试剂盒(Pierce,美国)抽提组织中蛋白质。蛋白质浓度通过BCA法(碧云天)进行测定。考马斯亮蓝(SIGMA 公司,美国)法测定蛋白质分子完整性[8]。蛋白质样本经聚丙烯凝胶电泳2 h后,将整块凝胶置于固定液中固定1 h,再染色30 min,最后用脱色液反复多次对凝胶进行脱色,直至肉眼可见清晰条带。
1.5 统计学方法
应用SPSS 22.0软件对所有实验数据进行统计学分析。采用单因素方差分析DNA的A260/A280比值、RNA 的A260/A280比值、RIN值以及蛋白质浓度。采用卡方检验分析DNA和蛋白质的完整性。设定P<0.05为差异有统计学意义。
2 结 果
2.1 DNA分子的纯度及完整性
组织样本DNA的完整性采用1%琼脂糖凝胶电泳图进行分析,依据电泳条带的清晰程度及拖尾情况对其进行质量分级。A级:电泳条带无拖尾情况,且清晰明亮;B级:条带有一定的拖尾,清晰;C级:电泳无清晰条带,泳道呈弥散带状,见图1。选取的胃肠道肿瘤组织样本提取DNA进行的纯度测定(A260/A280)及质量分级结果见表2。可见,A、B、C这3个质量分级中癌组织、癌旁组织及正常组织的样本数目比分别为(23∶7∶2)、(22∶10∶0)和(12∶17∶3),正常组织与癌组织有显著性差异(P=0.020),正常组织与癌旁组织有显著性差异(P=0.021),癌组织与癌旁组织无显著性差异(P=0.279)。胃癌与结直肠癌样本中A、B、C级别的数量比为(30∶15∶3)vs(25∶21∶2),经统计学分析,未见显著性差异(P=0.437)。将存储年限分为≤2年、3~5年和≥6年3个组,A260/A280值无显著性差异(P>0.05),且A、B、C质量级别的数量比分别为(22∶13∶1)、(19∶15∶2)和(15∶7∶2),经统计学分析均无显著性差异(P>0.05),见图2。

表2 样本DNA纯度值及完整性分级
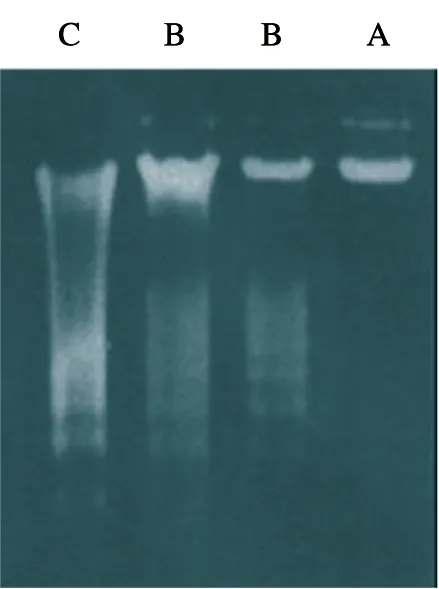
图1 DNA完整性分级标准示图
图2 不同存储年限组织样本DNA A260/A280比较
2.2 RNA分子的纯度及完整性
不同存储年限的胃癌和结直肠癌样本提取的RNA检测A260/A280及RIN值见表3。可见,胃肠道肿瘤在≤2年、3~5年和≥6年不同存储时间的组织样本RNA纯度(A260/A280)均无显著性差异(P>0.05),见图3。Agilent 2100生物分析仪采用1~10的编号系统,其中1表示RNA降解最为严重,10表示RNA最完整。通过对比样本RIN值的差异,发现胃癌与结直肠癌组织样本RNA完整性无显著性差异(P>0.05),见图4。而存储≥6年的样本RNA完整性较存储3~5年及≤2年均有显著下降(P<0.05),见图5。提示组织样本在冷冻保存6年以上时间后,RNA发生严重降解。
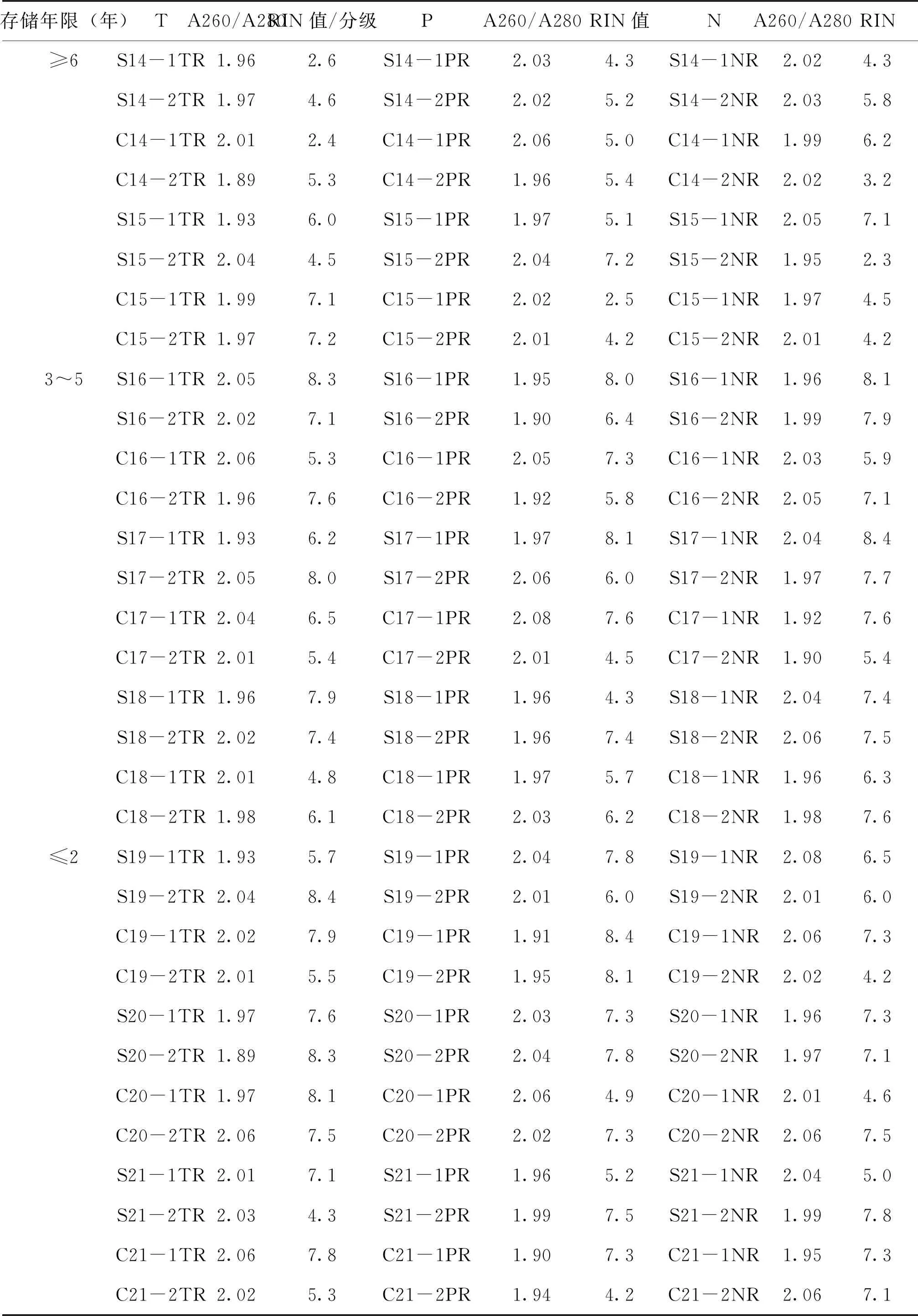
表3 样本RNA A260/A280及RIN值
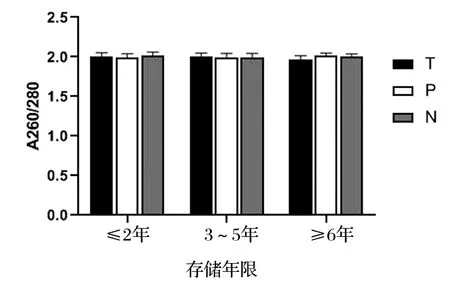
图3 不同存储年限组织样本RNA A260/A280比较
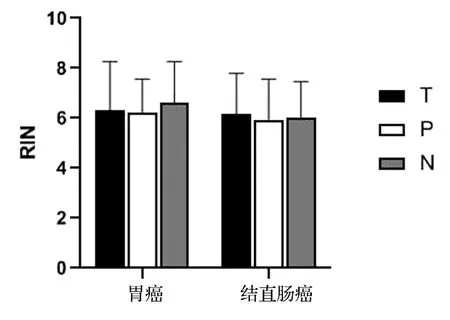
图4 胃癌与结直肠癌RIN值比较
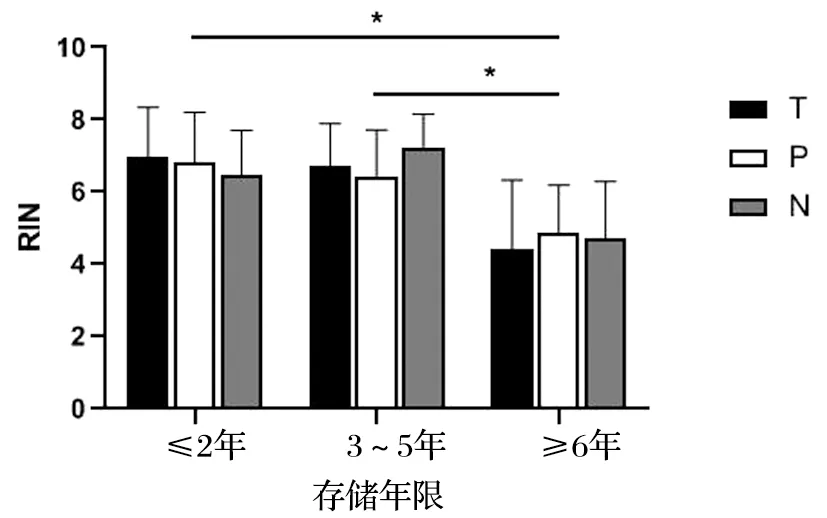
图5 不同存储年限组织样本RIN值比较
2.3 蛋白质的浓度及完整性
检测并记录每个组织样本蛋白质的浓度(μg/μL),发现不同存储时间(≤2年、3~5年、≥6年)蛋白质浓度无显著性差异(P>0.05),见图6。采用考马斯亮蓝染色来检测胃肠道肿瘤各组织样本在低温冻存不同时间后蛋白质的完整性,见图7。图中可以看出,组织样本存储时间≤2年的蛋白质条带清晰且数目较多,存储时间在3~5年的蛋白质条带数目相较于≤2年有所减少,而存储时间≥6年的组织中提取的蛋白质条带模糊且肉眼可见少于3条。因此,根据电泳条带的状态将蛋白质完整性进行质量分级:(1)A级,低分子量到高分子量的蛋白质条带均清晰可见;(2)B级,清晰条带数目在5条以上;(3)C级,条带模糊,条带数目在5条以下。蛋白质浓度及完整性分级见表4。胃癌与结直肠癌样本中蛋白质完整性A、B、C分级之比为(17∶27∶4)和(19∶23∶6),两者在蛋白质完整性无显著性差异(P>0.05)。癌组织、癌旁组织及正常组织的样本数目比分别为(14∶15∶3)、(11∶17∶4)和(11∶18∶3),三者无显著性差异(P>0.05)。组织样本存储时间≤2年、3~5年和≥6年的蛋白质完整性分级A、B、C级数目之比分别为(22∶14∶0)、(14∶20∶2)和(0∶16∶8),经统计学分析,组织样本存储时间≤2年与3~5年的蛋白质完整性无显著性差异(P>0.05),而存储时间≥6年与≤2年与3~5年有显著性差异(P<0.05),提示蛋白质在低温冻存超过6年时间后发生降解。
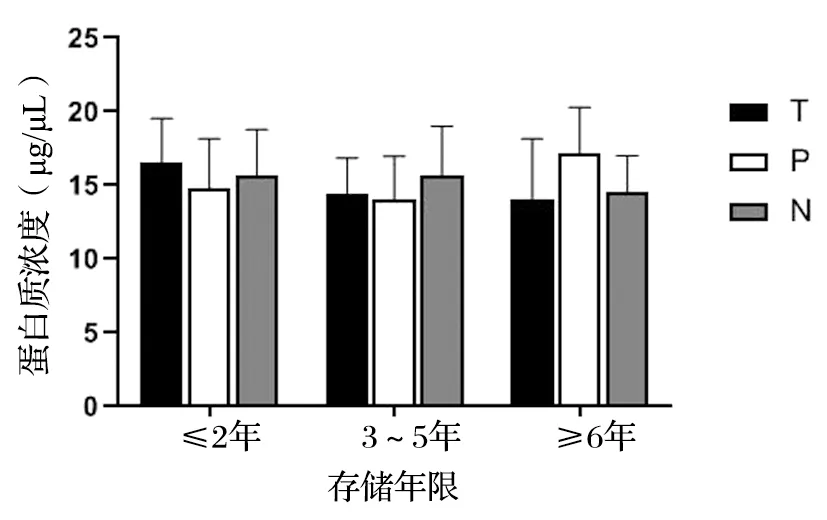
图6 不同存储年限蛋白质浓度
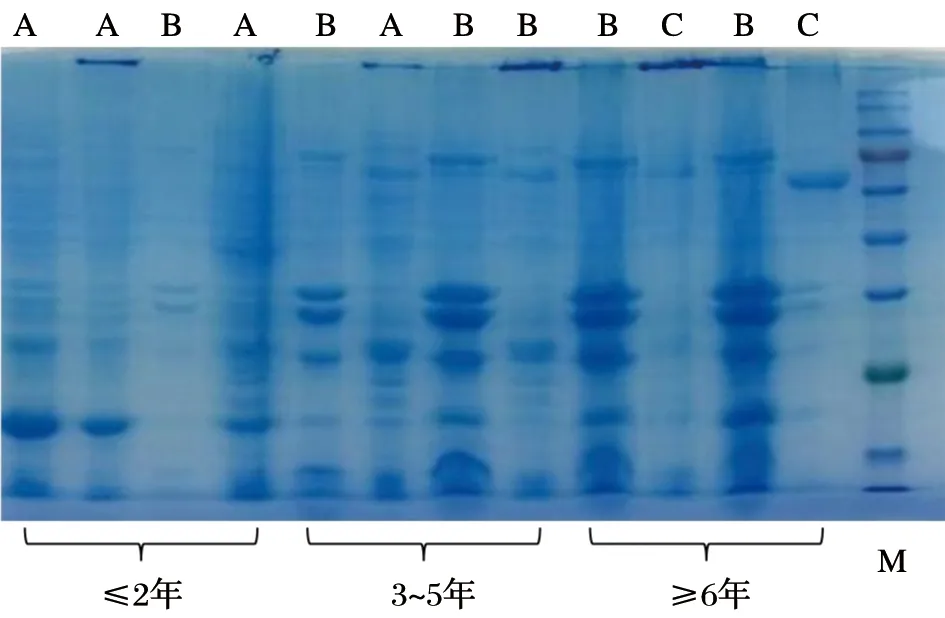
图7 不同存储年限蛋白染色图
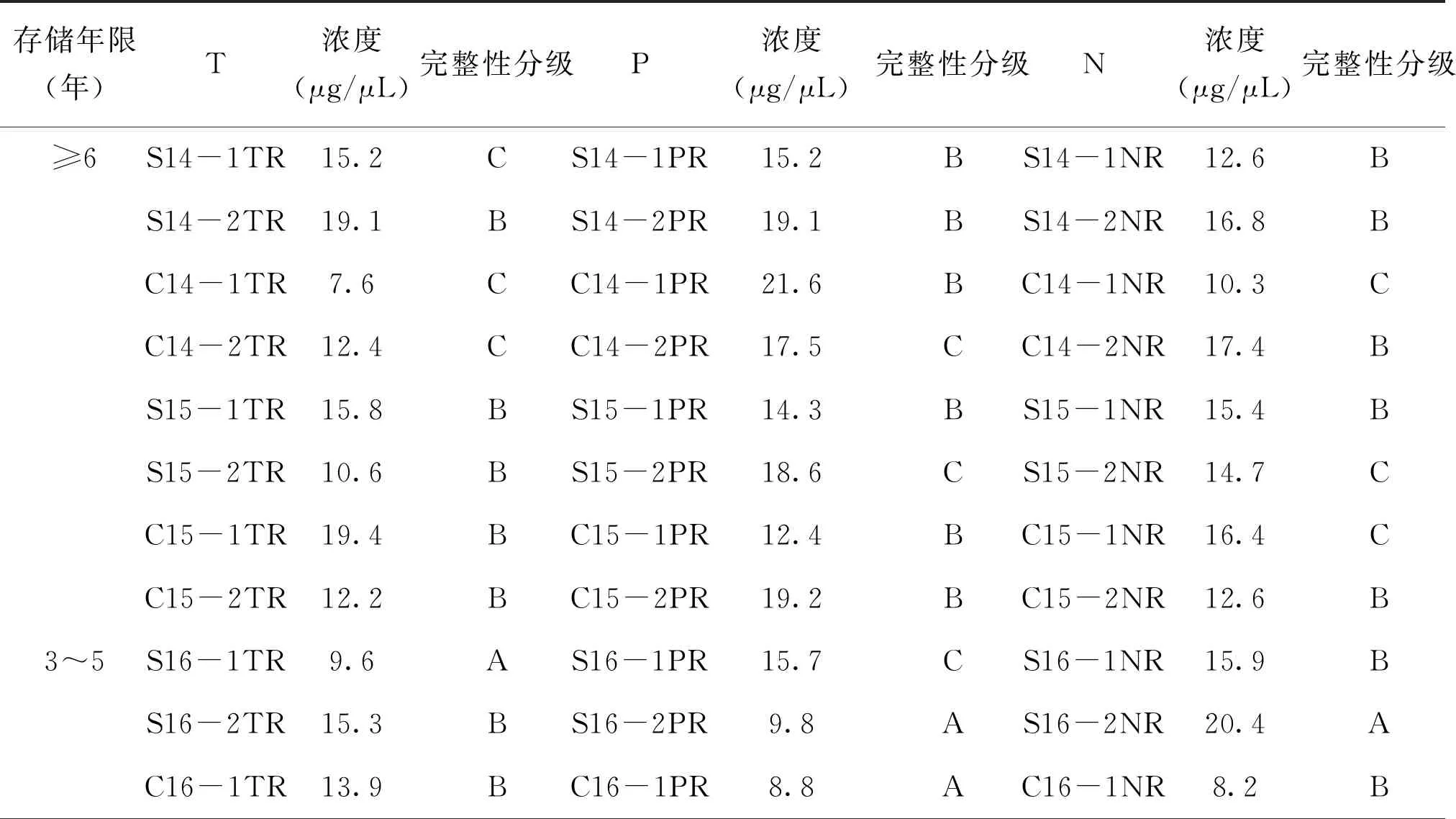
表4 样本蛋白质浓度值及完整性分级
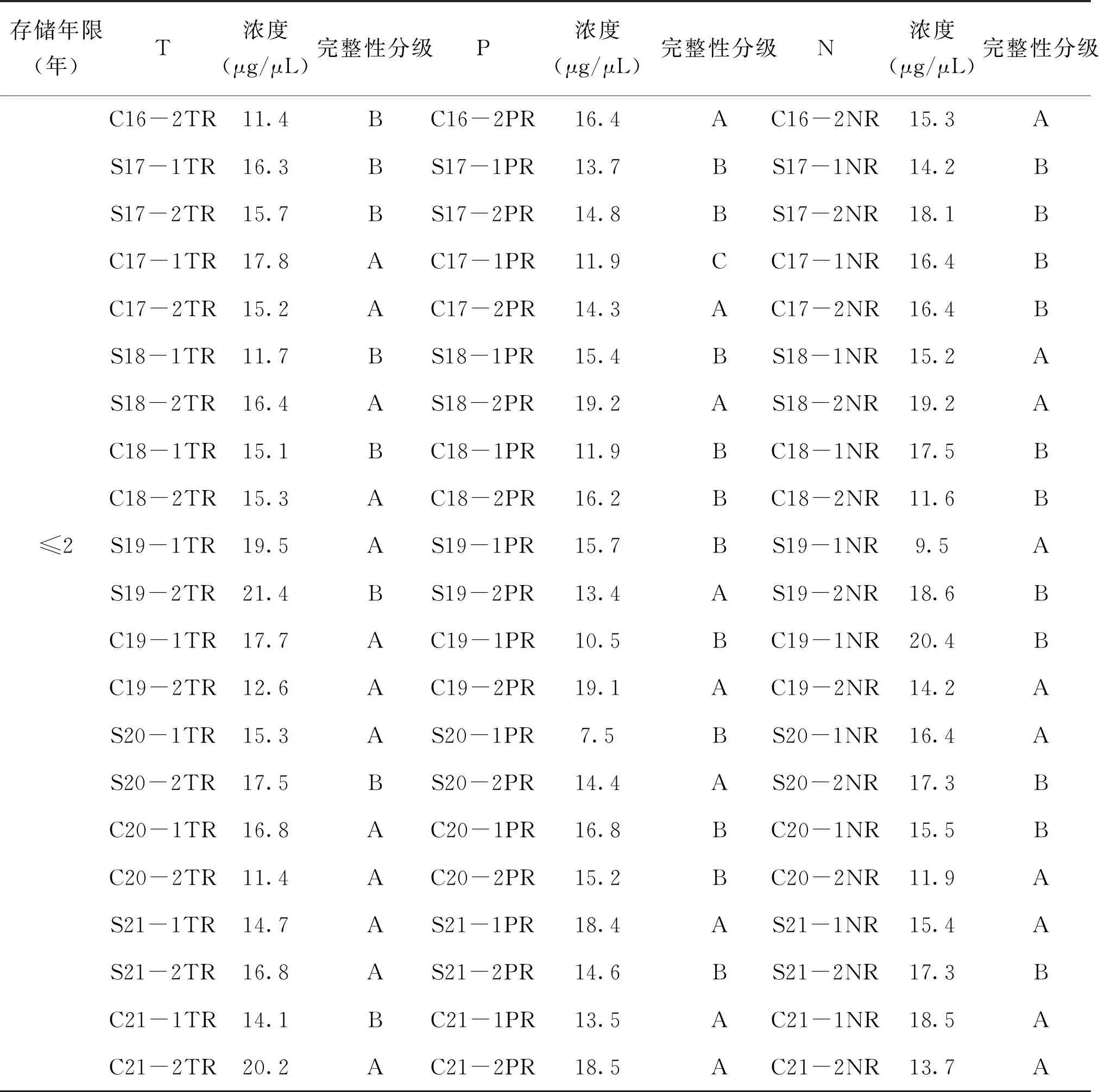
续表
3 讨 论
生物样本在长时间低温存储后,定期检测其质量,验证是否发生质量的改变已成为生物样本库工作的重中之重,因为高质量的肿瘤样本是保障实验研究有效进行的首要条件[9]。长期低温冻存的组织样本提取的生物大分子是否能满足基础实验和临床研究的需求,国内外的报道尚不多见。目前国际上对于不同存储方式提取的生物大分子并没有固定的衡量标准,能否有效地应用于科学研究完全取决于该研究对生物大分子纯度和完整性的要求。RIN值≥7被认为是高质量的RNA,可用于基因芯片等[10],Aye Yüzbaolu[11]指出全基因组表达分析也需要RNA保持较高的完整性。而RIN值≥5表示RNA具有良好的完整性,可用于一般的分子生物学研究,如RT-PCR分析[12]。对于降解较严重的RNA样本,需要进一步研究是哪些因素导致降解,方便后续样本的存储及利用。
低温冻存温度、冻存时间等因素都能导致生物大分子质量发生改变。在低于生物样本正常生理温度的环境下,细胞都会受到寒冷刺激,而这种刺激将直接影响细胞正常的生理代谢,进而对生物大分子的质量或表达产生影响,只是由于存储温度高低和时间长短的不同,造成影响大小的差异性[13]。研究表明[14],长时间冻存于-80 ℃环境中的组织样本能获得高质量的DNA,本文结果与文献一致。但是由于RNA与蛋白质的不稳定性,长时间保存可能带来不同程度的降解。冻存时间对RNA与蛋白质的影响研究主要集中在完整性,普遍认为保存较长时间后会发生降解,胃肠、胰腺等产生消化酶较多的组织样本RNA与蛋白质降解较快,而有些肿瘤如乳腺癌等则可保存更长时间,这和保存对象的组织自身特征有关[15]。低温对蛋白质的影响不仅体现在完整性上,在酶功能、二级结构及表达量等方面也有一定影响。Rouy等[16]研究发现将样本储存在-80 ℃环境中,随着时间的不断延长,基质金属蛋白酶-9(MMP-9)会逐步发生降解。Mazur等[17]认为,暴露于高浓度溶液中的细胞内蛋白质在低温冷冻时发生了不可逆的结构转变。在受到酸、碱、重金属盐等作用下,蛋白质发生的不可逆改变将失去原有的生理作用。Hubel等[18]的研究结果表明肺癌和乳腺癌细胞表面蛋白在冻存后的表达量出现下调。有研究指出[19-21],低温保护剂的加入能一定程度上延长生物大分子的降解时间。目前,低温冻存依然是维持组织样本蛋白质活性与完整性的主要手段,国际国内对此研究还不足够深入,因此在今后的研究与实践中还需不断探索条件,积累经验,建立最优的低温保存方法以便更长时间地维持蛋白质活性与稳定性。
对低温存储组织样本生物大分子的质量研究可为研究胃肠道肿瘤的发生、发展机制以及个体化治疗和转化医学提供宝贵的临床样本资源,不仅可以缩短科研工作周期,加快医学转化及研究进程,还可确保科研工作的正确性和科学性,对促进胃肠道肿瘤的发展具有十分重要的医学意义。

