基于α谱的尿中237 Np的测量方法
文 雯,王 孟,娄海林,文富平
1.南华大学 核科学技术学院,湖南 衡阳 421001;2.中国原子能科学研究院 核安全研究所,北京 102413
由于20世纪50—60年代大气核武器试验、核燃料后处理厂的排放以及核电站事故(1986年切尔诺贝利事故),向环境中释放了大量的放射性锕系元素Np、Pu、Am等,造成环境的放射性污染[1]。据统计,由于核武器试验、核电站、乏燃料后处理厂排放以及核事故等人类核活动,全球大约有4.0×1013Bq237Np[2]被释放到环境中。随着商业核能的发展,237Np总量不断增加,尽管与其他放射性核素相比,237Np在环境样品和高放射性核废物中的浓度非常小,但从长期来看,237Np将是此类废物中残留的最危险物质[3-5]。
在放射性废物中237Np的活度浓度相比于Am和Pu来说比较低,但237Np在环境中易于迁移,较Pu和Am等超铀元素具有更高的迁移性和生物吸附性[6-9],因此随着食物链的迁移进入人体后,易对周围组织产生α辐射危害。同时,在放射源生产、反应堆检修、乏燃料后处理等开放性操作环境中的工作人员可能会吸入237Np,在人体内产生内照射危害[10]。即使人体内的237Np在低剂量水平下也可能会引发恶性肿瘤,且通过促排也难以将其完全排出,若引发肿瘤,便难以治愈[11]。
为工作人员的身体健康考虑,有必要对237Np的职业照射进行常规监测,确保工作人员受到的照射不超标[12]。人体吸收的Np主要经尿液排出,对尿液中的237Np进行分析测定是一种间接监测方法[13]。在237Np的分析过程中,需要加入一种示踪剂示踪其化学回收率。理想情况下,通常加入待测核素的同位素示踪化学回收率,237Np的同位素示踪剂一般是239Np、235Np和236Np,其中239Np是β核素,半衰期短(T1/2=2.35 d),一般使用γ谱仪测量,需要定期制备和标定,费时费力[14];235Np和236Np半衰期较长,是较为合适的示踪剂,但制备235Np的副反应中会产生237Np,会干扰低水平237Np的测量,而236Np的生产成本高,不易获取[15]。因此,在实验中会选择非同位素示踪剂236Pu或242Pu示踪237Np的化学回收率。Np和Pu同属锕系元素,由于Np(6.27 eV)和Pu(6.03 eV)的第一电离能相近,以及Np(Ⅳ)(90 pm)和Pu(Ⅳ)(92 pm)离子半径接近的性质,四价Np和Pu在HNO3和HCl介质中具有相似的化学行为[16]。因此,在国内外237Np的分析研究中,以α谱仪进行测量时,由于242Pu的α能谱峰与237Np的α能谱峰接近,从而广泛使用236Pu作为237Np的示踪剂[17-19]。237Np和236Pu均为α核素,α谱仪灵敏度高和分辨率好,对仪器运行条件要求低,操作简便,可以满足两者的常规分析要求。目前关于237Np的分析已向着灵敏、精确和快速的方向发展,但国内以尿样为样本对237Np的监测分析研究较少。本工作对尿液中237Np的分析分为化学前处理和α谱仪测量两个部分,以236Pu作为示踪剂示踪237Np的化学回收率、以α谱仪为测量方法,系统地研究大体积尿样中237Np的分析方法。通过磷酸盐共沉淀预浓集尿中的锕系元素,TEVA萃取色谱树脂分离纯化,电沉积法制备测量源,采用α谱仪测量,计算237Np的化学回收率和浓度,探究确定最佳条件,建立准确的分析流程。
1 实验部分
1.1 仪器与试剂
TEVA萃取色谱树脂:粒径为100~150μm,法国Triskem公司;Eesemble-8 PIPSα谱仪,美国ORTEC公司;萃取色层柱:内径为5 mm,高150 mm,自制;DH171BE-3型直流电源,0~3 A,北京大华无线电仪器厂;四联电沉积槽,内径为14 mm、高70 mm,自制;HZT-A+200型分析天平,精度0.1 mg,福州华志科学仪器有限公司;4-5N低速常温离心机,湖南恒诺仪器有限公司。
88.9 Bq/L237Np标准溶液、30 Bq/L236Pu标准溶液,英国国家物理实验室,使用前均进行活度标定;1 000μg/L铀标准溶液,核工业北京化工冶金研究院;其他化学试剂均为分析纯,中国国药集团化学试剂有限公司;尿液样品为未从事放射性操作的普通人的24 h尿样。
1.2 实验方法
1.2.1 样品前处理 取1.6~2.0 L尿样,分别加入30 m L浓HNO3和20 m L 30%(质量分数)H2O2,再加入236Pu标准溶液作为示踪剂,在电热板上加热煮沸40 min至尿样为澄清透明状。
1.2.2 共沉淀 余耀先等[20]研究了磷酸铋共沉淀富集浓缩237Np,采用三月桂胺-聚三氯乙烯色层柱进行分离纯化,α谱仪测量。共沉淀过程中,加入的铋载体质量达300 mg,易造成沉淀溶解不完全,引入的铋元素可能增加实验的不确定性。Qiao等[17-18]研究了MnO2和Fe(OH)3共沉淀对Np化学回收率的影响,使用Mn O2共沉淀过程中p H值的准确控制是保证高化学回收率的关键,p H值存在偏差易导致化学回收率大幅度下降。采用Fe(OH)3共沉淀法的研究发现,237Np化学回收率仅为50%~65%。Maxwell等[19]使用磷酸钙共沉淀法载带尿样中的锕系元素,分析测量得到237Np化学回收率在90%以上。本工作选择磷酸盐共沉淀进行富集浓缩,将1.2.1节消解酸化后的尿样置于恒温90℃下,加入5 m L磷酸,在磁力搅拌器作用下,边搅拌边加入氨水,调节p H为8~9,继续搅拌40 min,静置2 h以上,4 000 r/min离心5 min,弃去上清液。加入30 m L浓HNO3和20 m L 30%H2O2溶解沉淀,加热至近干,呈白色残渣。再用15 m L 3 mol/L HNO3溶解尿样残渣,依次加入0.5 m L 2 mol/L盐酸羟胺、1 mol/L(NH4)2Fe(SO4)2和4 mol/L NaNO2将尿中的Np和Pu调节为Np(Ⅳ)和Pu(Ⅳ),搅拌10 min使充分反应后,在30 min内上柱,防止Np(Ⅳ)被氧化为Np(Ⅴ)。
1.2.3 TEVA树脂柱分离纯化Np和Pu Horwitz等[21]研究了HNO3介质下Np、Pu、Th等锕系元素在TEVA树脂上的吸附行为。在3 mol/L HNO3条件下,TEVA树脂对Np(Ⅳ)和Pu(Ⅳ)的分配系数达到最大(K′为103~104),U的分配系数K′<10。随着酸度的降低,Np(Ⅳ)和Pu(Ⅳ)的分配系数降低(K′<10),从而解吸出Np和Pu。因此,本工作使用TEVA萃取色谱树脂进行分离纯化,用30 m L 3 mol/L HNO3预处理树脂。将1.2.2节的尿样转移至树脂柱中,并用15 m L 3 mol/L HNO3分多次洗涤烧杯,洗涤液转移至树脂柱中,以0.5 m L/min的流速完全通过树脂后,再用30 m L 8 mol/L HNO3冲洗去除U,用30 m L 9 mol/L HCl冲洗去除Th,然后用15 m L 0.1 mol/L HCl-0.05 mol/L HF在0.5 m L/min的流速下解吸得到Np和Pu。
1.2.4 电沉积制备样品源 采用(NH4)2SO4为电沉积液进行电镀。将1.2.3节步骤中解吸得到的纯化溶液蒸至近干,加入5 m L 0.36 mol/L Na HSO4-1 mol/L H2SO4溶液溶解,将尿样的盐酸体系转为硫酸体系,蒸至近干。将尿样残渣用10 m L(NH4)2SO4电沉积液分多次溶解,转移至电沉积槽,加入1~3滴百里酚蓝指示剂,加入氨水调节p H为2.0~2.5。插入铂丝作为阳极,不锈钢片作为阴极,连接循环水进行冷却,接通电源,在恒流下进行电沉积,终止前加入1 m L浓氨水,继续电沉积1 min;电沉积结束后,切断电源,立即倒出电沉积残液,取出阴极片并用去离子水和乙醇洗涤;再将其置于电热板上烘干,备用待测。在该过程中为了验证Np和Pu的化学行为一致性,研究了不同因素对两者的影响。实验采用水溶液为介质进行研究,在电沉积管中加入(NH4)2SO4溶液,准确加入100μL237Np标准溶液(8.89 mBq)和100μL236Pu(3 mBq)标准溶液,电沉积一定时间。采用控制变量法,分别对(NH4)2SO4溶液浓度、电流密度和电沉积时间进行探讨(n=5)。
1.2.5 α谱仪测量 将1.2.4节制备的α样品源置于8道高分辨α谱仪测量,计算237Np的化学回收率和浓度。
1.2.6237Np的化学回收率和放射性活度浓度237Np的化学回收率(Y)按照式(1)进行计算。

式中:ns,样品源中236Pu相应通道区的计数率,s-1;n0,236Pu相应通道区的本底计数率,s-1;E,α谱仪对237Np标准平面电镀源的探测效率,%;A0,示踪剂236Pu加入活度,Bq。尿样中237Np的放射性活度浓度按照式(2)进行计算。

式中:C,237Np的放射性活度浓度,Bq/L;nc,样品237Np相应通道区的计数率,s-1;n1,测定237Np相应通道区的本底计数率,s-1;V,分析尿样的体积,L。
2 结果与讨论
2.1 分离纯化过程对化学回收率的影响
分别考察不同上柱酸度和解吸体积对化学回收率的影响,以确定最佳分离纯化条件。
2.1.1 上柱酸度 对1.2.2节步骤中不同上柱酸度对化学回收率的影响进行了讨论。取未从事放射性操作的普通人员24 h(1.6~2.0 L)尿样,平均分成5等份,尿样前处理和共沉淀完成后,分别用1、2、3、4、5 mol/L HNO3溶液溶解尿样残渣,加入100μL237Np标准溶液(8.89 mBq)和100μL236Pu(3 mBq)示踪剂。料液上柱,用8 mol/L HNO3和9 mol/L HCl冲洗去除U和Th,再用0.1 mol/L HCl-0.05 mol/L HF洗脱得到Np和Pu。通过(NH4)2SO4体系电沉积制备测量源,置于α谱仪测量,计算237Np和236Pu的化学回收率,结果示于图1。由图1可知:在1~3 mol/L HNO3下,Np和Pu的化学回收率随HNO3浓度的升高而增加;在3~5 mol/L HNO3浓度下,通过加标实验,237Np和236Pu的化学回收率随浓度的升高而达到稳定,经5次重复实验,化学回收率可维持在80%~95%。同时,该实验表明在分离纯化过程中236Pu和237Np的化学性质相似,通过236Pu示踪237Np的化学回收率误差小,结果较准确。由于洗脱酸度较低,为了保证低酸度条件下可以高效地解吸出Np和Pu,本工作中上柱酸度选择3 mol/L HNO3。

图1 上柱酸度的变化对化学回收率的影响Fig.1 Effect of acidity of upper column on chemical recovery
2.1.2 解吸体积 讨论1.2.3节步骤中解吸Np和Pu的解吸体积,确定化学回收率最高时的解吸体积。同样,取未从事放射性操作的普通人员24 h(1.6~2.0 L)尿样,待尿样前处理和共沉淀完成后,用3 mol/L HNO3溶液溶解尿样残渣,加入100μL236Pu(3 mBq)示踪剂。TEVA树脂柱进行分离纯化,用8 mol/L HNO3和9 mol/L HCl去除U和Th等杂质后,用15 mL 0.1 mol/L HCl-0.05 mol/L HF以0.5 m L/min的 速 率 解吸,每2 m L接1个样品进行电沉积制备测量源,用于α谱仪测量,计算化学回收率,结果示于图2。由图2可知:随着解吸体积的增加,237Np的化学回收率增大;当解吸体积为12 m L时,解吸过程的总化学回收率达到最大。重复5次实验,按照式(3)计算标准偏差(s),s<10%。因此,当解吸体积大于12 m L时,可以将Np和Pu完全解吸出来,本工作中选择15 m L解吸液即可。
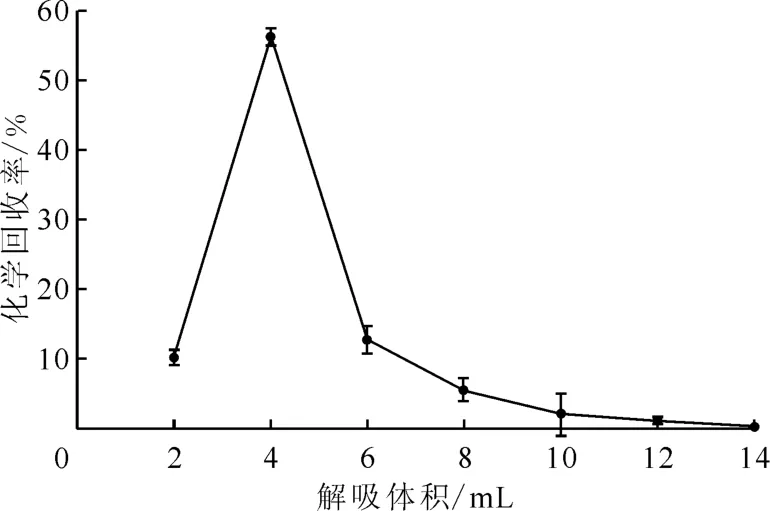
图2 解吸体积对化学回收率的影响Fig.2 Effect of desorption volume on chemical recovery

式中:N,尿样个数(N≥5);Xi,尿样1,2,……i,……,N的测量值;-X,所有尿样测量值的平均值。
2.2 电沉积参数的选择
由于本工作中使用非同位素示踪剂236Pu监测237Np的化学回收率,在电沉积实验中主要讨论电沉积液浓度、电流密度和电沉积时间对Np和Pu电沉积率的影响。
2.2.1 电沉积液浓度的选择 按照1.2.4节步骤中的条件不变,改变(NH4)2SO4溶液的浓度,观察电沉积率(Y′)的变化。结果列入表1。由表1可知,(NH4)2SO4溶液浓度在0.1~0.4 mol/L时,Np和Pu的电沉积率均大于96%。但随着(NH4)2SO4浓度的升高,源层颜色加深,导致其他一些稳定的金属阳离子形成不溶的氢氧化物,造成Np和Pu的电沉积率下降。因此,本实验选择(NH4)2SO4浓度为0.1 mol/L。
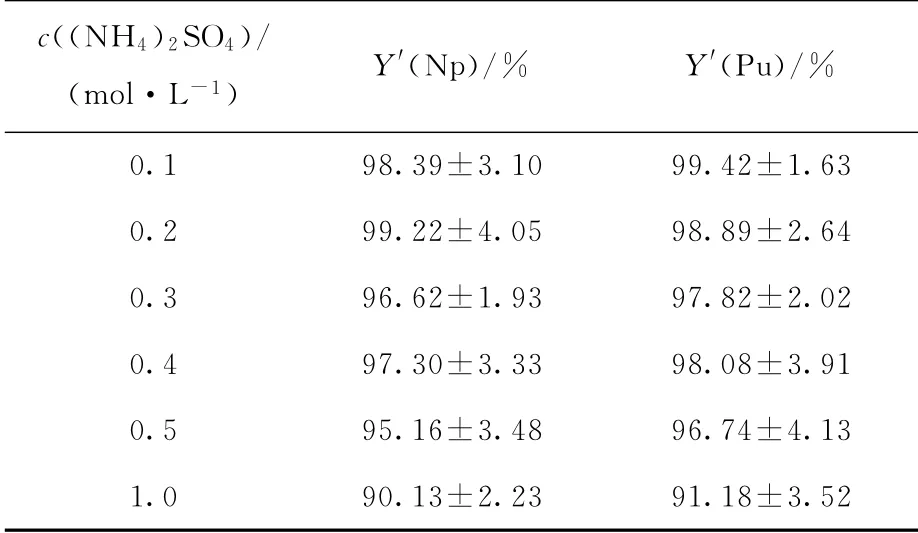
表1 (NH 4)2 SO4浓度对Np和Pu电沉积率的影响Table 1 Influence of(NH 4)2 SO4 concentration on electrodeposition rate of Np and Pu
2.2.2 电流密度对电沉积的影响 取8个电沉积管,根据1.2.4节步骤操作,其他条件不变,改变电流密度,研究电流密度对Np和Pu电沉积率的影响,结果示于图3。由图3可知:当电流密度在0.3~0.7 A/cm2时,Y′(Np)和Y′(Pu)均大于97%;当电流密度大于0.7 A/cm2时,电镀片出现源层分布不均匀的颗粒现象,Y′(Np)和Y′(Pu)有所降低。在本工作中选择电流密度为0.6 A/cm2。

图3 电流密度对Np和Pu电沉积率的影响Fig.3 Influence of current density on electrodeposition rate of Np and Pu
2.2.3 电沉积时间对电沉积的影响 取8个电沉积管,根据1.2.4节步骤操作,其他条件不变,改变电沉积时间,观察电沉积时间对电沉积率的影响,结果示于图4。由图4可知,当电沉积时间t≥40 min时,Np和Pu可完全沉积在不锈钢阴极片上。因此,选择电沉积时间60 min。

图4 电沉积时间对Np和Pu电沉积率的影响Fig.4 Effect of electrodeposition time on electrodeposition rate of Np and Pu
2.3 分析方法的优势
α谱仪测量237Np过程中,需去除其他α放射性核素和尿样中的干扰物质,特别要去除与237Np的α射线能量接近的核素,主要是234U。其中,TEVA树脂在3 mol/L HNO3介质下,对U具有较高的分配系数,为确定该实验方法可去除U,通过以下验证实验确定对U的去污能力。
取5个150 mL烧杯,依次加入30 mL 3 mol/L HNO3溶液、100μL铀标准溶液(1 000μg/L)和100μL236Pu(3 mBq)标准溶液。按照1.2.3节步骤进行分离纯化,得到含Pu和U的解吸液,通过α谱仪测量解吸液中U和236Pu的含量,测量结果列入表2。由表2可知,该实验方法满足对Pu的高解吸效率,对U的去污因子(DF)分别为1.92×103、4.76×103、1.54×103、2.70×103、3.57×103,平均去污因子为2.90×103。

表2 U的测量结果及去污因子Table 2 Results and decontamination coefficient of U
2.4 分析方法的验证
经条件实验,得到测量尿中237Np的具体流程示于图5。

图5 α谱仪测量尿中237 Np的分析流程Fig.5 Analysis process of measuring 237 Np in urine by alpha spectrometer
表3列出了8份加标尿样的测量结果,以确定的实验流程和实验参数对尿样进行分析。加入定量的237Np和100μL236Pu(3 mBq)示踪剂,同时测量237Np和236Pu的活度浓度(C),计算验证该分析方法的化学回收率、精密度和准确度。相对标准偏差(sr)按照式(4)进行计算。

表3 C(237 Np)的测量结果及化学回收率Table 3 Results and chemical recovery of C(237 Np)

根 据式(1)、(3)和(4)进行计算,236Pu的化学回收率为(88.5±5.26)%,精密度为5.94%(n=8)。同时,C(237Np)测量结果相对误差的绝对值小于15%,说明该实验方法准确稳定。
2.5 方法检测限
α谱仪测量尿中237Np的方法检测限(LD),按照式(5)进行计算。

式中:ts,样品测量时间,s;tB,本底测量时间,s;RB,本底计数率,s-1;Ef,仪器探测效率,s-1;Y,化学回收率,%;V,分析尿样的体积,L;当ts=tB时,Z1-α=Z1-β=1.645(Z1-α和Z1-β为置信水平95%的常数,从正态分布函数表中查出)。当样品和本底测量时间为500 000 s、RB=0、化学回收率为88.5%、α谱仪的探测效率为30%时,取24 h的尿样体积1.6 L,其方法检测限为LD=2.55×10-5Bq/L。
3 结 论
建立了大体积尿样中237Np的分析监测流程,其化学回收率可达88.5%,精密度为5.94%(n=8),相对误差绝对值小于15%,检测限为2.55×10-5Bq/L。因此,基于α谱仪对尿中237Np的分析对职业工作人员常规内照射监测具有重要意义,可进一步开展尿样中237Np的内照射分析评价,应用于实践工作。

