花姜酮对多发性骨髓瘤细胞U266增殖和凋亡的影响及机制
刘 敏,雷荟融,成延娟,唐元艳,黄知平(荆州市中心医院血液内科,湖北 荆州 434020)
多发性骨髓瘤是全球范围内的恶性浆细胞病,起源于B淋巴细胞系。据统计资料显示,多发性骨髓瘤发病率在血液系统肿瘤内位居第二,发病人数占血液系统肿瘤10%,严重影响患者生命健康安全[1]。目前多发性骨髓瘤的治疗方式有化疗、放疗及造血干细胞移植等,尽管在治疗上取得了很好治疗效果,但仍会出现复发难治现象[2]。纯天然药物治疗是近几年研究的热点,花姜酮(zerumbone)是从野生姜根茎部位提取的一种蛇麻烷型倍半萜,具有良好抗肿瘤效果[3]。有研究显示,花姜酮呈剂量依赖性抑制口腔鳞癌细胞增殖和转移,并诱导细胞凋亡[4]。花姜酮能抑制胃癌细胞、胰腺癌细胞增殖和诱导细胞凋亡[5-6]。还有研究结果显示,花姜酮能抑制宫颈癌细胞增殖、迁移和侵袭[7]。以上均说明花姜酮具有良好抗肿瘤作用,但是对多发性骨髓瘤的作用尚无明确报道。
高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种高度保守的细胞核蛋白,是一个动态功能多效分子,在多种肿瘤高表达,包括多发性骨髓瘤[8],如miR-410通过靶向抑制HMGB1,进而抑制多发性骨髓瘤细胞的增殖和转移[9]。在多发性骨髓瘤患者血清内,HMGB1高表达,且与肿瘤分期、患者3年生存率负相关,敲低HMGB1可抑制多发性骨髓瘤细胞增殖,并抑制细胞的凋亡和自噬[10-11],表明HMGB1可能是肿瘤治疗靶点。本研究以U266细胞为研究对象,探讨花姜酮对多发性骨髓瘤细胞增殖和凋亡影响,及其是否与HMGB1有关。
1 材料与方法
1.1 药物、试剂和主要仪器
花姜酮购于上海源叶生物公司;胎牛血清、RPMI 1640培养基购于美国HyClone公司;RNA试剂盒均购于美国Invitrogen公司;引物均购于上海吉玛公司;MTT试剂盒购于日本同仁公司;凋亡试剂盒购于江苏凯基生物;一抗:兔抗人周期蛋白D1、Bax、Bcl-2、HMGB1单克隆抗体,小鼠抗人GAPDH单克隆抗体均购于美国Abcam公司;辣根过氧化物酶标记山羊抗兔/小鼠IgG抗体(二抗)购于北京中杉金桥公司;胰酶、化学发光液、DMSO、结晶紫和BCA试剂盒购于北京索莱宝科技有限公司;PrimeScript RT试剂盒和荧光定量试剂盒购于美国Thermo Fisher公司。Biosciences AccuriC6流式细胞仪购于美国BD Bioscience公司;Varios-kan LUX多功能酶标仪和VeritiPro PCR仪购于美国Thermo Fisher公司;凝胶成像系统购于美国Bio-Rad公司。
1.2 细胞、细胞培养和分组处理
多发性骨髓瘤U266购于美国典藏中心;取出在超低温冰箱保存的U266细胞,采用含有10%胎牛血清的RPMI 1640培养基进行培养,置37℃、5%CO2恒温箱内,根据细胞生长密度变化进行传代。取对数生长期的U266细胞培养24 h后,用花姜酮 0(细胞对照组),5,10 和 20 μmol·L-1处理U266细胞48 h。
1.3 MTT实验检测细胞存活率
取1.2分组处理的细胞,根据试剂盒说明书加入20 μL MTT(5 g·L-1),继续培养4 h后加入150 μL DMSO(1%)试剂,结晶紫溶解后,在酶标仪490 nm处检测细胞吸光度(A490nm)值,并计算细胞存活率。细胞存活率(%)=(实验组A490nm-空白组A490nm)/(细胞对照组A490nm-空白组A490nm)×100%。
1.4 克隆形成实验检测克隆形成率
取1.2分组处理的细胞,接种至6孔板内,每孔内接种500个细胞,然后置恒温培养箱内培养14 d,肉眼观察可见克隆形成时终止培养,经过PBS冲洗后加入4%多聚甲醛固定20 min,结晶紫染色15 min后,在显微镜下观察克隆细胞数目,计算克隆形成率。克隆形成率(%)=克隆细胞数目/接种细胞数目×100%。
1.5 流式细胞术检测细胞凋亡
取1.2分组处理的细胞,加入胰酶消化,清洗3次后重悬细胞,根据凋亡试剂盒说明书,将5 μL Annexin V-FITC试剂和PI试剂加入至200 μL结合缓冲液内,待混匀后用流式细胞仪检测细胞凋亡率。
1.6 流式细胞术检测细胞周期
取对数生长期的U266细胞培养24 h后,按1.2分组处理细胞,157×g离心5 min,吸除上清,加入约1 mL预冷的PBS重悬细胞。再次离心沉淀细胞,小心吸除上清,轻轻弹击离心管底以适当分散细胞,避免细胞成团。每管细胞中加入0.5 mL PI染色液,缓慢并充分重悬细胞沉淀,37℃避光温浴30 min。用流式细胞仪在激发波长488 nm波长处检测细胞周期。
1.7 RT-qPCR检测U266细胞HMGB1 mRNA表达
收集1.2分组处理的细胞,按照RNA试剂盒说明书,加入RNAiso Plus试剂分离各组细胞用于提取RNA,用紫外分光光度计检测RNA浓度和纯度。取1 μg RNA按照PrimeScript RT试剂盒说明进行逆转录合成cDNA,HMGB1正向引物为5′-AGGATCCCAATGCACCCAAG-3′,反向引物为 5′-CGCAACATCACCAATGGACAG-3′;GAPDH 正向引物为 5′-CGAGATCCCTCCAAAATCAA-3′,反向引物为5′-TTCACACCCATGACGAACAT-3′。95℃预变性10 min,95℃变性15 s、60℃退火20 s、72℃延伸10 s、共40个循环。以GAPDH作为内参,用2-△△Ct法定量mRNA表达水平。
1.8 Western印迹法检测U266细胞周期D1、Bax、Bcl-2和HMGB1蛋白表达
收集1.2分组处理的细胞置离心管,加入1 mL蛋白裂解液在冰上裂解30 min,并提取细胞总蛋白质,根据BCA法定量蛋白浓度。取20 μg蛋白质,变性5 min,在80 V电压下进行SDS-PAGE凝胶处理蛋白样品,迅速转膜,封闭培养1 h。然后加入抗周期蛋白 D1(1∶800)、Bax(1∶800)、Bcl-2(1∶800)、HMGB1(1∶800)和GAPDH(1∶1000)抗体,4℃孵育过夜;加入二抗(1∶1000)在室温孵育1 h,加入化学发光液显影、曝光,用凝胶成像仪进行拍照,使用Quantity One分析蛋白条带积分吸光度值,以GAPDH作为内参。以目标蛋白与内参蛋白条带积分吸光度值比值表示蛋白相对表达水平。
1.9 统计学分析
实验数据结果以±s表示,采用SPSS 22.0软件分析处理,多组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 花姜酮对多发性骨髓瘤U266细胞存活率的影响
MTT结果(表1)显示,与细胞对照组相比,花姜酮5,10和20 μmol·L-1能显著降低U266细胞存活率(P<0.05),提示花姜酮可有效抑制U266细胞存活。

Tab.1 Effect of zerumbone on cell viability of multiple myeloma U266 cells
2.2 花姜酮对多发性骨髓瘤U266细胞克隆形成率的影响
克隆形成实验结果(图1)显示,与细胞对照组相比,花姜酮5,10和20 μmol·L-1组克隆形成率显著降低(P<0.05),提示花姜酮能有效抑制U266细胞克隆形成。

Fig.1 Effect of zerumbone on clone formation rate of U266 cells.See Tab.1 for the cell treatment.A:Diagram of cell clone formation;B:Statistical plot of cell clone formation rate.Clonal formation rate(%)=number of clones/number of inoculated cells×100%.±s,n=3.*P<0.05,compared with cell control group.
2.3 花姜酮对多发性骨髓瘤U266细胞凋亡率的影响
流式细胞术实验结果(图2)显示,与细胞对照组相比,花姜酮5,10和20 μmol·L-1组细胞凋亡率显著增加(P<0.05),提示花姜酮可有效促进U266细胞凋亡。

Fig.2 Effect of zerumbone on apoptosis of U266 cells detected by flow cytometry.See Tab.1 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
2.4 花姜酮对多发性骨髓瘤U266细胞周期的影响
流式细胞术实验结果显示,与细胞对照组相比,花姜酮5,10和20 μmol·L-1组S期细胞比例显著增加(P<0.05),G2和M期细胞比例显著降低(P<0.05),提示花姜酮能通过抑制细胞周期S期抑制U266细胞增殖(图3)。

Fig.3 Effect of zerumbone on cell cycle of U266 cells detected by flow cytometry.See Tab.1 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
2.5 花姜酮对多发性骨髓瘤U266细胞HMGB1 mRNA表达的影响
RT-qPCR结果(表2)显示,与细胞对照组相比,花姜酮 5,10 和 20 μmol·L-1组细胞HMGB1mRNA表达水平显著降低(P<0.05),提示花姜酮能下调U266细胞中HMGB1mRNA表达。

Tab.2 Effect of zerumbone on mRNA expression of high mobility group protein B1(HMGB1)in U266 cells
2.6 花姜酮对多发性骨髓瘤U266细胞周期蛋白D1,Bax,Bcl-2和HMGB1蛋白表达水平的影响
Western印迹法结果(图4)显示,与细胞对照组相比,花姜酮5,10和20 μmol·L-1组多周期蛋白D1、Bcl-2和HMGB1蛋白表达显著降低(P<0.05),Bax蛋白表达显著增加(P<0.05),提示花姜酮能下调U266细胞周期蛋白D1,Bcl-2,HMGB1蛋白表达,并上调Bax蛋白表达。
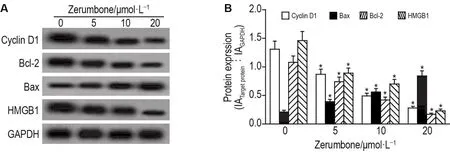
Fig.4 Effect of zerumbone on protein expression levels of cyclin D1,Bax,Bcl-2 and HMGB1 in multiple myeloma cells by Western blotting.See Tab.1 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
3 讨论
本研究发现,花姜酮处理多发性骨髓瘤细胞U266后,可抑制细胞活力,减少克隆形成率,增加细胞凋亡率,提示花姜酮具有良好的抗骨髓瘤活性,与实体瘤中观察到的结果相似[5-7]。
恶性肿瘤细胞生长、分化、转移和凋亡等过程与肿瘤发生发展密切相关。细胞主要以有丝分裂方式进行增殖,推动细胞周期从G1期进入S期,可促进细胞增殖[12]。周期蛋白D1可调控细胞周期,在多种癌症中高表达,如淋巴瘤、乳腺癌和神经母细胞瘤等[12-13]。有研究发现,多发性骨髓瘤患者肿瘤细胞中周期蛋白D1表达上调,且过表达与不良预后显著相关[14-15]。本研究采用不同浓度花姜酮处理多发性骨髓瘤U266细胞后,周期蛋白D1蛋白表达、G2和M期细胞百分比明显降低,说明花姜酮可能通过降低周期蛋白D1抑制多发性骨髓瘤细胞增殖。
Bcl-2家族、胱天蛋白酶家族是比较常见的凋亡相关基因,Bcl-2家族成员有两大类,分别是抗凋亡(包括Bcl-2、Bcl-XL等)和促凋亡(Bax和Bak等),Bcl-2和Bax是常用凋亡相关基因,二者相互拮抗共同促进肿瘤发生凋亡[16]。本研究结果显示,不同浓度花姜酮处理多发性骨髓瘤细胞后Bcl-2蛋白表达明显降低,Bax蛋白表达明显增加,说明花姜酮可能通过降低Bcl-2、增加Bax促进多发性骨髓瘤细胞凋亡。
细胞增殖和凋亡对于维持机体中正常生理功能具有重要作用,若两者失衡易造成机体功能障碍或肿瘤恶性发展。肿瘤细胞增殖、凋亡两者之间相互调控,可能涉及一些调控基因,如DNAJC1,TRIM31和HMGB1等[17-20]。HMGB1在多发性骨髓瘤高表达,抑制HMGB1能抑制多发性骨髓瘤细胞增殖、转移,并促进细胞凋亡[21]。本研究结果显示,不同浓度花姜酮处理多发性骨髓瘤U266细胞后,HMGB1 mRNA和蛋白表达下调,表明花姜酮能抑制HMGB1的表达。
综上所述,花姜酮可抑制多发性骨髓瘤U266细胞的增殖,诱导其凋亡,其作用机制可能与下调周期蛋白D1、Bcl-2、HMGB1和上调Bax有关。然而,骨髓瘤细胞增殖和凋亡的调控机制涉及多因子和多靶点,本研究尚未添加上述靶点的激活剂或抑制剂进行反向验证,仍需后续深入研究。

