荜澄茄素治疗失眠症的药效及相关机制研究
王 玮,杨世林, 2,彭万钱,张 壮,欧阳辉, 3,冯育林, 2,罗颖颖*,何明珍, 2*
• 药理与临床 •
荜澄茄素治疗失眠症的药效及相关机制研究
王 玮1,杨世林1, 2,彭万钱1,张 壮1,欧阳辉1, 3,冯育林1, 2,罗颖颖1*,何明珍1, 2*
1. 江西中医药大学 中药固体制剂制造技术国家工程研究中心,江西 南昌 330006 2. 创新药物与高效节能降耗制药设备国家重点实验室,江西 南昌 330006 3. 南昌市中药与天然药物活性成分研究重点实验室,江西 南昌 330006

荜澄茄素;失眠;睡眠剥夺;神经递质;γ-氨基丁酸A受体α1

荜澄茄素是从木犀科丁香属植物紫丁香Lindl.分离得到的二苄基丁内酯木脂素成分,其茎在藏族地区又称藏沉香,民间常用作镇静安神药。研究表明,荜澄茄素具有灭锥虫、抗炎、镇痛、抗癌等活性[8-11],且对东莨菪碱诱导的小鼠遗忘症具有神经保护作用[12],但关于其治疗失眠症的研究鲜有报道。因此,本研究拟初步探讨荜澄茄素治疗失眠症的药效及潜在作用机制,为开发治疗失眠症的创新药物提供理论基础。
1 材料
1.1 动物
SPF级雄性ICR小鼠,体质量16~18 g,4周龄,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004。动物于12 h光暗周期、室温22~24 ℃、湿度恒定的饲养室,适应性喂养3 d,自由进食饮水。动物实验经江西中医药大学伦理委员会批准(批准号JZLLSC20210067)。
1.2 药品与试剂
荜澄茄素(质量分数为99.7%)由江西中医药大学实验室提供;羧甲基纤维素钠(CMC-Na,批号20210401)购自展云化工有限公司;戊巴比妥钠(批号2015011301)购自美国Merck公司;地西泮片(批号20191004)购自信谊制药有限公司;二甲亚砜(dimethyl sulfoxide,DMSO,批号J20GR142557)购自源叶生物科技有限公司;氟马西尼(批号Ro15-1788)购自MCE公司;浓缩型正常山羊血清(批号12L08A09)购自博士德生物工程有限公司;牛血清白蛋白(批号0703010160)购自Gen-view科技有限公司;柠檬酸钠缓冲液(批号1114A0144)、苏木素(批号20200629)、中性树胶(批号6071021)购自北京索莱宝科技有限公司;DAB试剂盒(批号CW2069S)、TRIzol试剂(批号05421)购自北京康为世纪生物科技有限公司;组织固定液(批号20210826)购自美伦生物技术有限公司;OCT包埋剂(批号1906-00)购自日本Sakura公司;对照品5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA,批号BCCD4271,质量分数≥98%)、5-羟色胺(5-hydroxytryptamine,5-HT,批号BCCF8292,质量分数≥98%)购自美国Sigma公司;对照品γ-氨基丁酸(gamma-aminobutyric acid,GABA,批号B21979,质量分数≥98%)、-谷氨酸(-glutamic acid,Glu,批号B21916,质量分数≥98%)购自源叶生物科技有限公司;第一链cDNA合成试剂盒(批号H2126010)、Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix(批号H6004030)购自上海翌圣生物科技有限公司;3,4-二羟基苄胺(3,4-dihydroxybenzylamine,DHBA,批号C11856507,质量分数99%)购自上海麦克林生化科技有限公司;γ-氨基丁酸受体Aα1(γ-aminobutyric acid A receptor α1,GABAAα1)抗体(批号DF8548)购自Affinity公司。
1.3 仪器
RM2235型切片机、DM2500型光学显微镜、CM1850型冰冻切片机(德国Leica公司);KD-TS3A型组织自动脱水仪(北京佳源兴业科技公司);YB6LF型组织包埋机(湖北孝感亚光医用电子技术公司);QTRAP 4500型质谱仪、7500型qRT-PCR仪(美国AB Sciex公司);5810R型冷冻离心机、AG型普通PCR仪(德国Eppendorf公司);Tissuelyser-48型全自动样品快速研磨仪(上海净信科技有限公司);KQ-4000B型数字超声仪(昆山市超声仪器有限公司)。
2 方法
2.1 荜澄茄素对正常小鼠的作用研究
2.1.1 戊巴比妥钠阈下实验 实验前首先进行戊巴比妥钠阈下剂量摸索,将30只小鼠随机分为戊巴比妥钠高、中、低剂量(35、30、25 mg/kg)组,小鼠ip戊巴比妥钠,记录入睡小鼠只数。阈下剂量选择使90%~100%小鼠翻正反射不消失的最大剂量。另将60只小鼠随机分为对照组及荜澄茄素高、中、低剂量(100、50、25 mg/kg)组和地西泮(2 mg/kg)组,每组12只。药物用0.5% CMC-Na溶液研磨配制成混悬液,各给药组ig相应药物(10 mL/kg),对照组ig等体积的溶剂。给药30 min后,ip戊巴比妥钠阈下剂量,记录30 min内入睡小鼠只数。
2.1.2 戊巴比妥钠阈上实验 实验前首先进行戊巴比妥钠阈上剂量摸索,将30只小鼠随机分为戊巴比妥钠高、中、低剂量(50、45、40 mg/kg)组,小鼠ip戊巴比妥钠,记录入睡小鼠只数。阈上剂量选择使100%小鼠翻正反射消失的最小剂量。另将60只动物按“2.1.1”项下方法进行分组和给药,给药30 min后,ip戊巴比妥钠阈上剂量,记录小鼠的入睡潜伏期(注射后到翻正反射消失的时间)和睡眠持续时间(翻正反射消失到恢复的时间)。
2.1.3 氟马西尼拮抗实验 取40只小鼠随机分为荜澄茄素+氟马西尼+戊巴比妥钠组、地西泮+氟马西尼+戊巴比妥钠组、溶剂(0.5% CMC-Na溶液)+戊巴比妥钠组、地西泮+戊巴比妥钠组以及荜澄茄素+戊巴比妥钠组,每组8只。氟马西尼作为荜澄茄素机制研究的假设拮抗药物,在给药前20 min ip氟马西尼(5 mg/kg)[13],然后ig荜澄茄素(100 mg/kg)、地西泮(2 mg/kg)或溶剂,30 min后ip戊巴比妥钠阈下剂量,记录30 min内入睡小鼠只数。
2.1.4 免疫组化法观察荜澄茄素对正常小鼠脑组织GABAAα1蛋白表达的影响 将小鼠分为对照组、荜澄茄素(100 mg/kg)组和地西泮(2 mg/kg)组,每组10只。各给药组ig相应药物后,小鼠脱颈椎处死,取出脑组织浸泡于组织固定液中,自来水冲洗,梯度乙醇脱水,二甲苯透化,石蜡包埋后切片(厚5 µm),于42 ℃温水中展片。按照DAB试剂盒说明书,分别滴加GABAAα1抗体及生物素标记的羊抗兔/鼠抗体,另设置阴性对照未加一抗。通过Image J软件统计GABAAα1阳性表达面积占比。
2.2 荜澄茄素对睡眠剥夺小鼠的作用研究
将小鼠分为对照组、模型组、地西泮(2 mg/kg)组和荜澄茄素低、中、高剂量(10、20、40 mg/kg)组,每组6只。除对照组外,其余各组参照文献方法[14]制备失眠模型:采用厚度为80 mm玻璃制作110 cm×75 cm×50 cm的睡眠剥夺箱,箱内放置12个高度为8 cm、直径为6.3 cm的金属平台,平台间相距15 cm,箱内水深度为7 cm,水温保持22 ℃,箱上置网盖,网盖上放置食物和水。除对照组小鼠外均放置在睡眠剥夺箱中的金属平台上,期间允许小鼠自由摄水摄食,每当小鼠要进入睡眠状态时,其全身骨骼肌张力明显降低,会垂头触水或落入水中而惊醒,无法进入睡眠,即为睡眠剥夺。1周后,当造模小鼠出现摄食减少、惊恐状、易激惹、脱毛严重、相互撕咬等情况时,表明模型构建成功。造模成功后各给药组ig相应药物,对照组ig等体积的溶剂,1次/d,连续1周,给药结束后进行旷场实验,收集脑组织。
2.2.1 旷场实验 各给药组ig相应药物30 min后进行旷场实验,小鼠在旷场仪中适应2 min,用相应仪器录制各组小鼠10 min内的总路程、平均速度、活动次数及时间、中央路程、中央平均速度等行为学指标。
2.2.2 免疫组化法观察荜澄茄素对睡眠剥夺小鼠脑组织中GABAAα1蛋白表达的影响 按“2.1.4”项下方法检测各组小鼠脑组织GABAAα1蛋白表达。
2.2.3 qRT-PCR检测皮层和海马组织中mRNA表达 按照试剂盒说明书分别提取各组小鼠皮层和海马组织中总RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-ACTGCTGGACGGTTATGACAATCG-3’、下游引物:5’-GAGTGCCATCCTCTGTGATACGC-3’;上游引物:5’-AGGGAAATCGTGCGTGAC-3’、下游引物:5’-AT-ACCCAGGAAGGAAGGCT-3’。
2.2.4 LC-MS/MS检测脑内神经递质含量变化 称定脑组织,加入10倍的水制成脑匀浆后,加入4倍体积的甲醇,混匀后在冰上放置25 min,12 000 r/min离心15min,每100微升样品加10 μL内标(DHBA,0.3 g/L),进行LC-MS/MS分析[15-16]。
(1)色谱条件:Hypersll GOLD HILIC色谱柱(150 mm×2.1 mm,1.9 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~3 min,95% B;3~4 min,95%~8% B;4~9 min,8%~5% B;9~10 min,5%~2% B;10~11 min,2%~95% B;11~12 min,95% B。体积流量0.3 mL/min;进样量1 μL;柱温35 ℃。
(2)质谱条件:以正离子多反应检测(MRM)模式进行扫描。神经递质检测离子对及质谱离子化条件见表1。
(3)方法学考察:①专属性:精密量取GABA、Glu、5-HT、5-HIAA对照品分别配制成500 ng/mL的溶液,按色谱条件进行检测,结果见图1。②线性范围:精密吸取上述对照品溶液,稀释至500、250、125、50、25、10、5、2.5、1 ng/mL的系列溶液后进行LC-MS/MS检测,结果见表2。③精密度:取上述线性范围内的对照品溶液低、中、高的对照品溶液各3份,进行LC-MS/MS分析,在同一天内每个样品重复进样3次,计算精密度,见表3,均符合生物样品的分析要求。
2.3 统计学分析
表1 质谱条件
Table 1 Mass spectrometry conditions
神经递质Q1→Q3(m/z)去簇电压/V入口电压/V碰撞能/eV碰撞室出口电压/V GABA104.1→87.12610154 Glu148.0→84.32610214 5HT177.2→160.01610154 5HIAA192.2→146.02410354 DHBA140.1→123.11010174

图1 各神经递质对照品(A) 与脑样品(B) 的LC-MS/MS分析
表2 标准曲线及线性范围
Table 2 Standard curve and linear range
神经递质线性范围/(ng·mL−1)回归方程R2 GABA5.0~250.0y=7.66×104x+5.24×1050.992 9 GLU2.5~500.0y=0.95×103x+1.48×1040.999 2 5-HT5.0~500.0y=2.9×104x+2.32×1050.995 3 5-HIAA5.0~250.0y=239 x+3.96×1030.990 6
3 结果
3.1 荜澄茄素对正常小鼠的作用
3.1.1 戊巴比妥钠协同实验 阈下实验结果(表4)表明,与对照组比较,地西泮组和荜澄茄素中、高剂量组均能显著增加入睡动物数(<0.01),且荜澄茄素诱导小鼠入睡率呈剂量相关性。阈上实验结果(表5)表明,与对照组比较,地西泮可以明显缩短动物入睡潜伏期时间(<0.01),荜澄茄素各剂量组均能显著延长小鼠睡眠时间(<0.01),且呈剂量相关性。
表3 准确度及精密度
Table 3 Accuracy and precision
神经递质质量浓度/(ng·mL−1)准确度RSD/%精密度RSD/% GABA50.857.81 500.802.31 2501.341.30 GLU2.50.562.86 504.053.38 5002.442.52 5-HT50.075.06 500.324.62 5000.431.84 5-HIAA50.146.60 500.572.48 2500.751.15
表4 荜澄茄素联合戊巴比妥钠阈下剂量 (30 mg·kg) 对小鼠睡眠的影响( = 12)
Table 4 Effects of cubebin combined with pentobarbital sodium subthreshold dose (30 mg·kg) on sleep of mice ( = 12)
组别剂量/(mg·kg−1)入睡率/% 对照—10 地西泮290** 荜澄茄素2550 5080** 10090**
与对照组比较:**<0.01,下表同
**< 0.01control group, same as below tables
3.1.2 免疫组化实验 如图2所示,荜澄茄素和地西泮显著增加小鼠皮层GABAAα1蛋白表达(<0.05、0.01),而对海马组织GABAAα1表达无明显影响,表明荜澄茄素可能是通过作用于皮层GABAAα1发挥作用。

表5 荜澄茄素联合戊巴比妥钠阈上剂量(45 mg·kg−1) 对小鼠睡眠的影响(, n = 12)

与对照组比较:*P<0.05 **P<0.01

3.2 荜澄茄素对失眠小鼠的作用
3.2.1 旷场实验 如图4所示,与对照组比较,模型组小鼠总路程、平均速度和中央路程、中央平均速度均显著增加(<0.05);与模型组比较,荜澄茄素各剂量组均能显著降低小鼠的总路程、平均速度、中央路程、中央平均速度、活动时间(<0.05、0.01),显著增加小鼠的活动次数(<0.05、0.01)。
3.2.2 qRT-PCR检测小鼠海马和皮层组织中mRNA表达 如图5所示,与对照组比较,模型组小鼠海马和皮层组织中mRNA表达水平均显著降低(<0.05、0.01);与模型组比较,荜澄茄素中剂量组海马组织中mRNA表达水平显著升高(<0.05),各给药组小鼠皮层mRNA表达均显著升高(<0.05、0.01)。
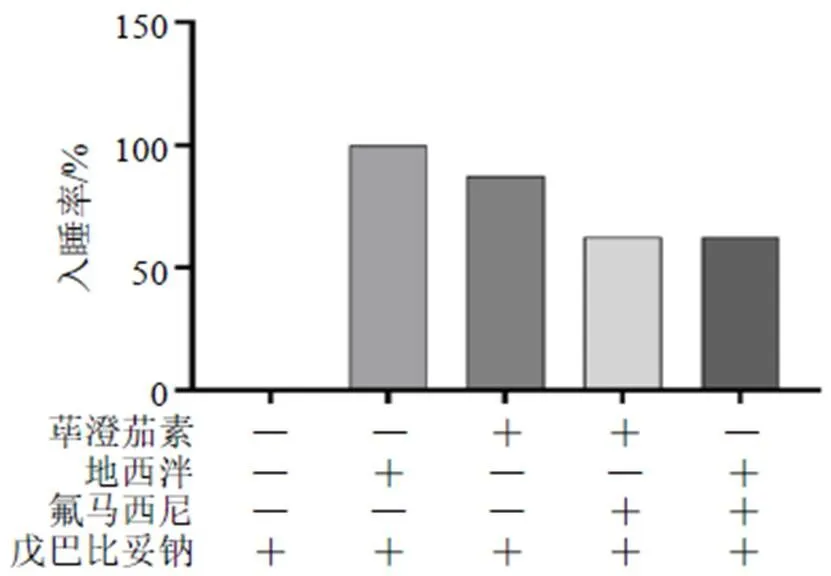
图3 氟马西尼联合戊巴比妥钠阈下剂量诱导各组小鼠的入睡率(n = 8)
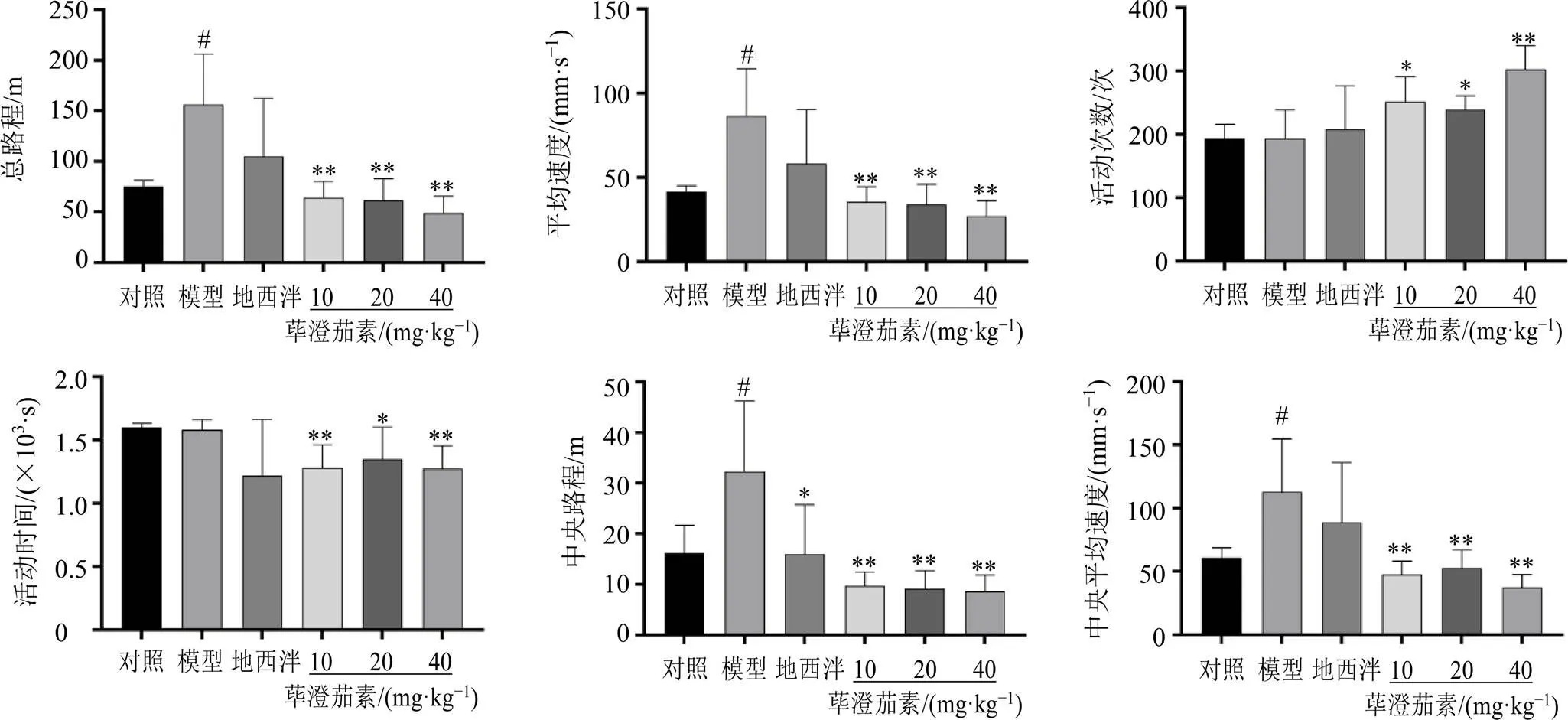
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.05,下图同

图5 荜澄茄素对睡眠剥夺小鼠海马组织和皮层中GABAAα1基因表达的影响(, n = 6)
3.2.3 免疫组化检测小鼠海马和皮层组织中GABAAα1蛋白表达 如图6所示,与对照组比较,模型组小鼠海马和皮层组织中GABAAα1蛋白表达均显著降低(<0.05);与模型组比较,荜澄茄素低、高剂量组小鼠皮层组织中GABAAα1蛋白表达显著升高(<0.05),荜澄茄素高剂量组小鼠海马组织中GABAAα1蛋白表达显著升高(<0.05),地西泮组海马和皮层组织中GABAAα1蛋白表达均显著升高(<0.05)。
3.2.4 LC-MS/MS检测小鼠海马和皮层组织中神经递质含量 如图7所示,与对照组比较,模型组小鼠海马组织中GABA、Glu、5-HT及5-HIAA水平无显著变化;与模型组比较,荜澄茄素高剂量组海马组织中Glu水平显著降低(<0.05),荜澄茄素中、高剂量组海马组织中GABA水平显著升高(<0.05、0.01)。如图8所示,与对照组比较,模型组小鼠皮层组织中GABA、5-HT、Glu水平均显著降低(<0.05);与模型组比较,荜澄茄素低、高剂量可显著升高皮层组织中GABA、Glu水平(<0.05、0.01),荜澄茄素中、高剂量组皮层组织中代谢产物5-HIAA水平显著升高(<0.05),地西泮组皮层组织中Glu水平显著降低(<0.01)。
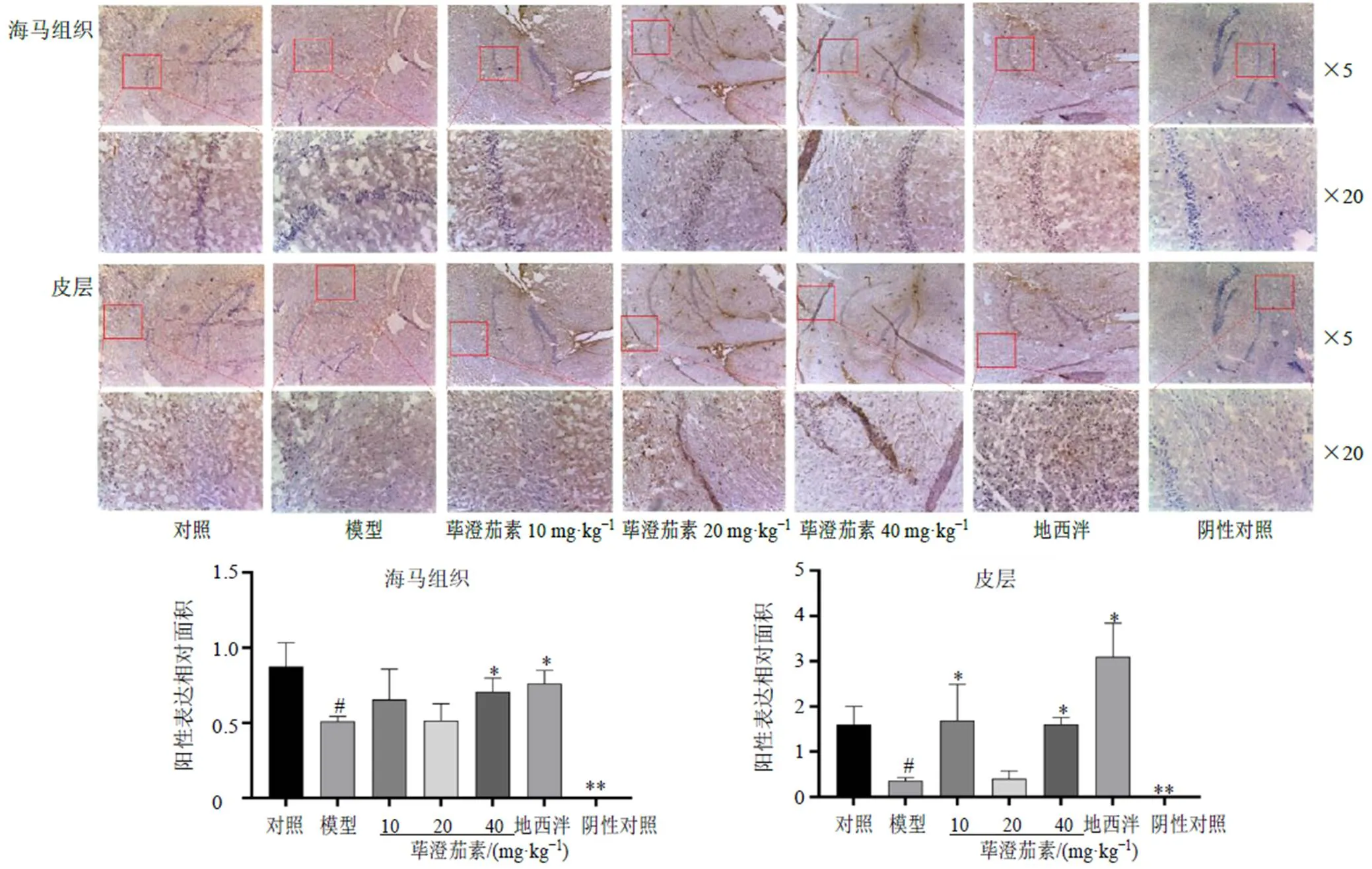
图6 荜澄茄素对睡眠剥夺小鼠海马组织和皮层组织中GABAAα1蛋白表达的影响(, n = 6)
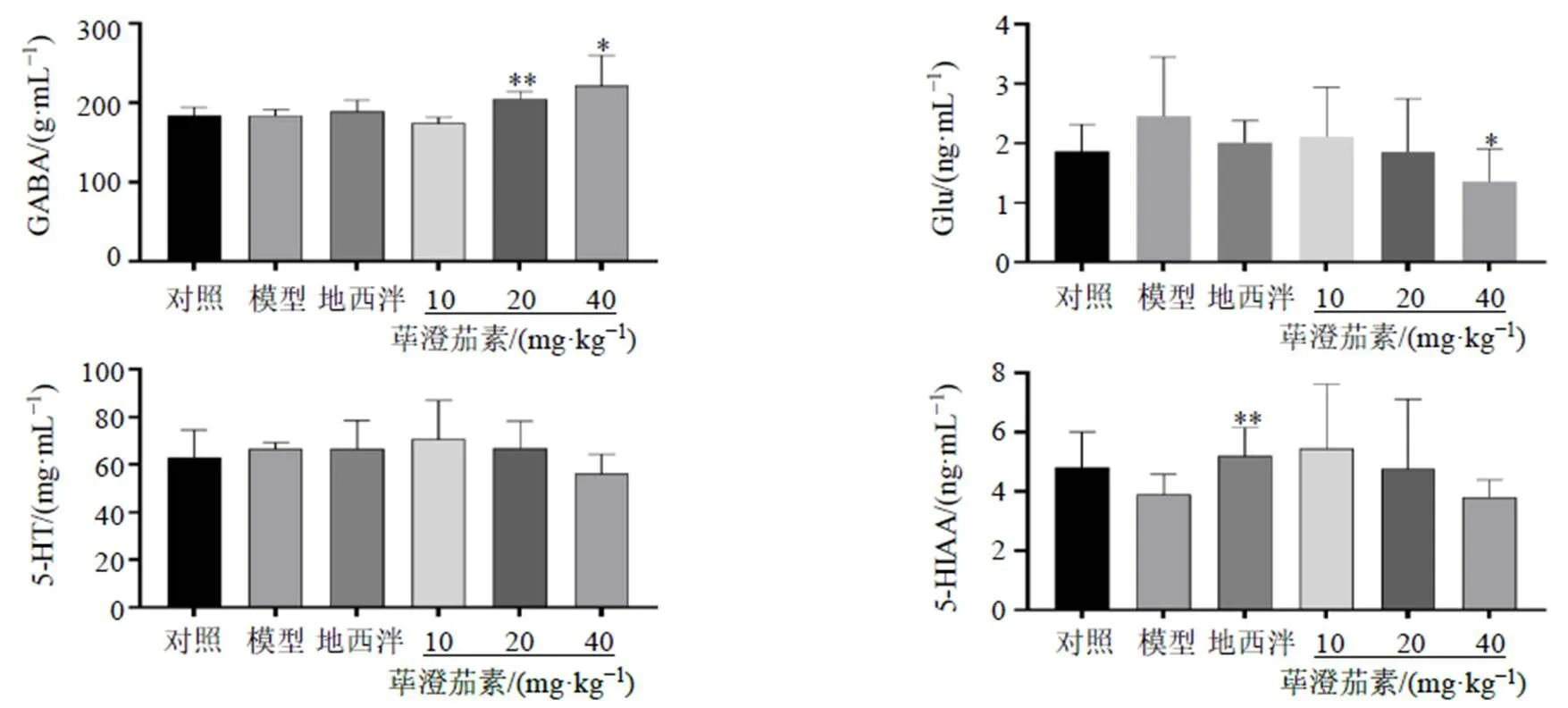
图7 荜澄茄素对睡眠剥夺小鼠海马组织中神经递质含量的影响(, n = 6)

图8 荜澄茄素对睡眠剥夺小鼠皮层中神经递质含量的影响(, n = 6)
4. 讨论



利益冲突 所有作者均声明不存在利益冲突
[1] Capman J L, Comas M, Hoyos C M,. Is metabolic rate increased in insomnia disorder? A systematic review [J]., 2018, 9: 374.
[2] Beaudin A E, Raneri J K, Ahmed S,. Association of insomnia and short sleep duration, alone or with comorbid obstructive sleep apnea, and the risk of chronic kidney disease [J]., 2022, 45(7): zsac088.
[3] 吴恩来, 张雨青, 王健, 等. 失眠伴抑郁与单纯失眠患者失眠认知行为治疗的疗效分析 [J]. 中华精神科杂志, 2020, 53(2): 140-145.
[4] 王振杰, 赵蔓, 陈婷蔚, 等. 中国老年人睡眠障碍患病率的Meta分析 [J]. 中国全科医学, 2022, 25(16): 2036-2043.
[5] 刘帅, 张斌. 《中国失眠障碍诊断和治疗指南》解读 [J]. 中国现代神经疾病杂志, 2017, 17(9): 633-638.
[6] Curado D F, de Barros V V, Noto A R,. Dependence on hypnotics: A comparative study between chronic users of benzodiazepines and Z-drugs [J]., 2022, 44(3): 248-256.
[7] 吴艳, 刘炳林. 失眠症中药新药临床试验设计的考虑 [J]. 中国临床药理学杂志, 2022, 38(3): 285-288.
[8] Neres N B R, Montagnini D, Ferreira D S,.andtrypanocidal activity evaluation of (−)-cubebin encapsulated in PLGA microspheres as potential treatment in acute phase [J]., 2021, 18(6): e2100052.
[9] Lima T C, Lucarini R, Volpe A C,.andanti-inflammatory mechanism of action of the semisynthetic (−)-cubebin derivatives (−)-hinokinin and (−)--benzylcubebin [J]., 2017, 27(2): 176-179.
[10] Coimbra H D O S S, Royo V D E A, de Souza V A,. Analgesic and anti-inflammatory activities of (−)--benzyl cubebin, a (−)-cubebin derivative, obtained by partial synthesis [J]., 2004, 143(2): 65-69.
[11] Rajalekshmi D S, Kabeer F A, Madhusoodhanan A R,. Anticancer activity studies of cubebin isolated fromand its synthetic derivatives [J]., 2016, 26(7): 1767-1771.
[12] Somani G S, Nahire M S, Parikh A D,. Neuroprotective effect of cubebin: A dibenzylbutyrolactone lignan on scopolamine-inducedin mice [J]., 2017, 146(2): 255-259.
[13] 刘正. 建立镇静催眠药临床前药效学评价方法和研究西红花有效成分的催眠作用及机制 [D]. 上海: 复旦大学, 2010.
[14] 厚玉姣, 石晓静, 苗雯蓉, 等. 睡眠剥夺动物模型最新研究进展 [J]. 世界睡眠医学杂志, 2020, 7(4): 740-744.
[15] 漆明, 王宇, 李春, 等. 超高效液相-串联质谱法快速测定癫痫患者血清4种氨基酸类神经递质的应用研究 [J]. 右江民族医学院学报, 2021, 43(2): 210-214.
[16] 高耀, 王鹏, 许腾, 等. 逍遥散抗抑郁代谢特征综合分析及其调节能量代谢和神经递质机制研究[J]. 中草药, 2021, 52(5): 1360-1368.
[17] 岳小芳, 李帅帅, 刘杰, 等. 坤泰胶囊对初老雌性小鼠的戊巴比妥钠睡眠增强作用及其机制研究 [J]. 现代药物与临床, 2020, 35(3): 433-437.
[18] Atkin T, Comai S, Gobbi G. Drugs for insomnia beyond benzodiazepines: Pharmacology, clinical applications, and discovery [J]., 2018, 70(2): 197-245.
[19] Weber F, Chung S, Beier K T,. Control of REM sleep by ventral medulla GABAergic neurons [J]., 2015, 526(7573): 435-438.
[20] 魏彦照, 何凡, 王帅, 等. γ-氨基丁酸系统与常见重性精神疾病的关系探讨 [J]. 临床精神医学杂志, 2018, 28(6): 429-430.
[21] Ernst M, Sieghart W. GABAA receptor subtypes: Structural variety raises hope for new therapy concepts [J]., 2015, 6(4): 97-103.
[22] Xie K Q, Wu C H, Chi Z Y,. Enhancement of γ-aminobutyric acid (GABA) and other health-promoting metabolites in germinated broccoli by mannose treatment [J]., 2021, 276: 109706.
[23] Simeone X, Koniuszewski F, Müllegger M,. A benzodiazepine ligand with improved GABAA receptor5-subunit selectivity driven by interactions with loop C [J]., 2021, 99(1): 39-48.
[24] Dauvilliers Y, Evangelista E, Lopez R,. Absence of γ-aminobutyric acid-a receptor potentiation in central hypersomnolence disorders [J]., 2016, 80(2): 259-268.
[25] 王秀峰, 唐娜娜, 张瑜, 等. 基于阴阳寤寐学说的交泰丸调节失眠大鼠GABA信号通路的药理作用机制研究 [J]. 世界睡眠医学杂志, 2021, 8(11): 1861-1866.
[26] Bertelsen F, Landau A M, Vase K H,. Acuteeffect of valproic acid on the GABAergic system in rat brain: A[11C]Ro15-4513 microPET study [J]., 2018, 1680: 110-114.
[27] Venner A, de Luca R, Sohn L T,. An inhibitory lateral hypothalamic-preoptic circuit mediates rapid arousals from sleep [J]., 2019, 29(24): 4155-4168.
Efficacy and related mechanism of cubebin in treatment of insomnia
WANG Wei1, YANG Shi-lin1, 2, PENG Wan-qian1, ZHANG Zhuang1, OUYANG Hui1, 3, FENG Yu-lin1, 2, LUO Ying-ying1, HE Ming-zhen1, 2
1. National Engineering Center of Solid Preparation of Chinese Materia Medical Manufacturing Technology, Jiangxi University of Traditional Chinese Medicine, Nanchang 330006, China 2. State Key Laboratory of Innovative Drug and Efficient Energy-Saving Pharmaceutical Equipment, Nanchang 330006, China 3. Nanchang Key Laboratory of Active Ingredients of Traditional Chinese Medicine and Natural Medicine, Nanchang 330006, China
To explore the efficacy and potential mechanism of cubebin in sleep deprived mice.Firstly, sleep promoting effect of cubebin on normal mice was investigated: Mice were randomly divided into control group, diazepam (2 mg/kg) group, cubebin low-, medium- and high-dose (25, 50, 100 mg/kg) group, each administration group was ig corresponding drugs, sleep rate and sleep duration of rats in each group were recorded; Immunohistochemical staining was used to detect γ-aminobutyric acid A receptor α1 (GABAAα1) protein expression in brain tissue of mice; Flumazenil antagonism experiment was used to verify whether the effects of cubebin are related to benzodiazepine receptors. Secondly, effect of cubebin on sleep deprived mice was observed: Mice were divided into control group, model group, diazepam (2 mg/kg) group, cubebin low-, medium-and high-dose (10, 20, 40 mg/kg) group, drugs were given for intervention, open field test was used for behavioral testing; LC-MS/MS was used to detect the content of neurotransmitters [GABA,-glutamic acid (Glu), 5-hydroxytryptamine (5-HT) and 5-hydroxyindoleacetic acid (5-HIAA)] in brain tissue; Immunohistochemical staining and qRT-PCR were used to detect GABAAα1 expression in brain tissue.The results of study on sleep promoting effect of cubebin on normal mice showed that, cubebin significantly increased the sleep rate of normal mice (< 0.01), significantly prolonged the sleep duration of mice (< 0.01), and significantly increased GABAAα1 expression in cerebral cortex (< 0.05); Flumazenil could antagonize the sleep-promoting effect of cubebin. The results of study on effect of cubebin on sleep deprived mice showed that, compared with control group, activity of mice in model group was significantly increased (< 0.05), GABAAα1 expression and GABA, Glu, 5-HIAA contents in brain tissue were significantly reduced (< 0.05, 0.01); Compared with model group, activity of mice in cubebin group was significantly reduced (< 0.05, 0.01), GABAAα1 expression and GABA, Glu, 5-HIAA contents in brain tissue were significantly increased (< 0.05, 0.01).Cubebin has a sleep-promoting effect on both normal and sleep deprived mice, and may exert its effect by regulating the content of GABAAα1 and neurotransmitters GABA, Glu and 5-HIAA in brain.
cubebin;insomnia; sleep deprivation; neurotransmitter; γ-aminobutyric acid Areceptor α1
R285.5
A
0253 - 2670(2022)21 - 6750 - 09
10.7501/j.issn.0253-2670.2022.21.012
2022-07-23
国家重点研发计划课题(2019YFC1712302);中央引导地方科技发展专项项目(20192ZDD02002);江西省教育厅科技计划(201222);中央引导地方科技发展资金项目(20221ZDD02007);江西省大学生创新创业训练计划项目(S202210412081)
王 玮(1996—),女,硕士研究生,研究方向为中药学与中药药理学。Tel: 15222817652 E-mail: 15222817652@163.com
罗颖颖(1982—),女,硕士生导师,研究方向为中药药效评价及作用机制。Tel: 13576133107 E-mail: luoying0302@163.com
何明珍(1977—),女,硕士生导师,研究方向为中药活性成分及其体内代谢。Tel: 13755757218 E-mail: hmz07@163.com
[责任编辑 李亚楠]

