miR-99b-5p通过靶向TRIB1基因调控乳腺癌MCF-7细胞增殖和凋亡的研究
谢安心,王思源,张 洁,张惠娟,唐海欧,谭敦勇
乳腺癌是全球女性中最常见的恶性癌症之一,也是导致女性癌症相关死亡的第二大原因[1]。尽管开发了早期诊断,根治性手术和辅助治疗等治疗方法,但乳腺癌病人的预后仍然较差[2]。了解乳腺癌的分子机制有助于寻找乳腺癌治疗的新靶点,因此,迫切需要了解乳腺癌的调控网络,发现新的分子靶点以改善乳腺癌病人的不良预后。微小核糖核酸(micro ribonucleic acid,miRNA)是一类内源性、非蛋白质编码的小RNA分子,可通过直接切割靶信使核糖核酸(messenger RNA ,mRNA)或通过抑制其翻译来负调节转录后基因的表达。研究[3-4]表明,异常表达的miRNA参与多种疾病的发生和进展,包括癌症。有研究[5-6]显示,miR-99b-5p在各种癌症的发病机制中发挥重要作用。近期一项基于miRNA和组织特异性预测乳腺癌的潜在药物的研究[7]指出,miR-99b-5p在乳腺癌中呈低表达,提示miR-99b-5p可能与乳腺癌的发生和进展有关。但miR-99b-5p对下游靶基因的调控作用及机制尚不清楚。Tribbles同源蛋白1(Tribbles pseudokinase 1,TRIB1)属于Tribbles家族成员,参与多种肿瘤的发展进程[8]。前期预实验通过生物信息学软件预测发现,TRIB1可能是miR-99b-5p的直接靶基因。miR-99b-5p是否通过靶向TRIB1调控乳腺癌细胞的增殖和凋亡仍不明确。本研究探讨miR-99b-5p靶向TRIB1对乳腺癌MCF-7细胞增殖和凋亡的影响,以期为乳腺癌的靶向治疗提供新的分子靶点。
1 材料与方法
1.1 主要材料和试剂 人乳腺上皮细胞株HBL-100和乳腺癌细胞株MCF-7由中国科学院上海细胞库提供;PRMI 1640培养基、胎牛血清由美国Hyclone公司提供;miR-99b-5p模拟物(mimics)及对照(mimics control)由南京易普金生物科技有限公司提供;Lipofectamine 2000转染试剂由美国Invitrogen公司提供;RNA提取试剂盒由北京康为试剂生物科技有限公司提供;逆转录试剂盒、SYBR Premix Ex Taq检测试剂盒由武汉科昊佳生物科技有限公司提供;Western blotting检测所需相关试剂由碧云天生物技术研究所提供;TRIB1抗体及二抗由美国CST公司提供;MTT试剂由美国Sigma公司提供;AnnexinV-FITC/PI双染色细胞凋亡检测试剂盒由美国BD公司提供;野生型TRIB1 3′UTR荧光素酶重组载体质粒(TRIB1-Wt)和突变型TRIB1 3′UTR荧光素酶重组载体质粒(TRIB1-Mut)由上海吉玛制药技术有限公司提供;双荧光素酶报告基因检测试剂盒购于美国Promega公司;实验所用引物由上海生工生物工程有限公司提供。
1.2 细胞培养 将乳腺上皮细胞HBL-100和乳腺癌细胞MCF-7从液氮罐中取出,37 ℃恒温水浴锅中快速冻融,1 000 r/min离心3 min,用含10%胎牛血清的DMEM培养液(含100 U/mL青霉素、100 μg/mL链霉素)复苏、培养,放置在37 ℃、体积分数5%CO2、饱和湿度的培养箱中常规培养,在显微镜下观察细胞生长状态,每2~3 d更换1次培养液,细胞贴壁生长密度达90%以上时,用胰蛋白酶消化细胞,按照实验需要进行传代培养。
1.3 细胞转染和分组 对数增殖期的MCF-7细胞以胰酶消化,接种到6孔板中,每孔接种105个细胞,于37 ℃培养箱常规过夜培养,待细胞汇合度约为50%时,根据Lipofectamine 2000试剂使用说明书上的步骤进行转染处理,MCF-7细胞分为空白对照(Control)组:仅转染脂质体;阴性对照(miR-NC)组:转染阴性对照序列;实验(miR-99b-5p)组:转染miR-99b-5p mimics。各组MCF-7细胞转染5 h后进行换液,继续培养48 h,用RT-PCR检测转染效率。
1.4 RT-PCR 收集对数增殖期的HBL-100细胞、MCF-7细胞以及转染48 h各组MCF-7细胞,分别采用RNA提取试剂盒抽提细胞中总RNA。采用分光光度计测定总RNA的纯度和浓度,取2 μg合格的RNA以逆转录试剂盒合成cDNA。以cDNA为模板,以U6为内参,按照SYBR Premix Ex Taq检测试剂盒说明书进行RT-PCR检测。反应程序设为:94 ℃预热5 min;随后94 ℃变性30 s,58 ℃复性20 s,72 ℃延伸15 s,共40个循环。所用引物如下:U6,F-5′-GCT TCG GCA GCA CAT ATA CTA AAA T-3′,R-5′-CGC TTC ACG AAT TTG CGT GTC AT-3′;miR-99b-5p,F-5′-CAC CCG TAG AAC CGA CCT T-3′,R-5′-GTC GTA TCC AGT GCG TGT CGT GGA GTC GGC AAT TGC ACT GGA TAC GAC CGC AAG G-3′。采用相对定量2-△△Ct法计算细胞中miR-99b-5p相对表达水平,实验重复3次。
1.5 Western blotting 对数增殖期的HBL-100细胞、MCF-7细胞和转染48 h各组MCF-7细胞经预冷的PBS清洗2次后,利用细胞裂解液(含蛋白酶抑制剂)于冰上分别提取总蛋白,4 ℃、14 000 r/min高速离心15 min后收集上清液至新的EP管中,采用BCA法对蛋白浓度进行测定,以最低浓度为标准将各组蛋白浓度调为一致,在蛋白中加入适量上样缓冲液后沸水加热10 min变性。配制SDS-PAGE凝胶,取40 μg蛋白样品,电泳分离蛋白,随后将蛋白电转至PVDF膜上,加入5%脱脂牛奶室温封阻2 h,加入1∶800稀释的TRIB1一抗,冰上孵育过夜。次日用TBST漂洗3次后,加入1∶3 000稀释的二抗中室温孵育2 h,弃去二抗,TBST漂洗3次后,加入电化学发光试剂进行显色,使用凝胶成像系统采集图像,以GAPDH进行标定,分析各细胞中TRIB1蛋白相对表达水平,实验重复3次。
1.6 MTT试验 对数期的MCF-7细胞以2×103个/孔种植于96孔板,按照1.3方法对细胞进行转染和分组处理,分别在转染24、48、72 h向每孔细胞中加入20 μL MTT溶液(5 mg/mL),37 ℃孵育4 h,除去细胞上清液,向每孔细胞中加入150 μL二甲基亚砜,放置在低速摇床上反应10 min,直至沉淀全部溶解,使用酶标仪测定每孔细胞在450 nm波长处光密度(OD)值,每组细胞每个时间点各设3个复孔,其中用加了相应量的细胞培养液、 MTT溶液和二甲基亚砜,未加细胞的孔作为空白对照,实验重复3次。
1.7 AnnexinV-FITC/PI双染色法 Control组、miR-NC组和miR-99b-5p组MCF-7细胞转染48 h后,用胰蛋白酶消化细胞,收集1×105个细胞,用预冷的PBS清洗细胞2遍,离心弃上清,加入100 μL 1×Binding Buffer重悬细胞,将细胞悬液以300目尼龙网过滤到流式管中,分别向管中加入AnnexinV-FITC和PI染液各5 μL,充分混匀,室温避光反应15 min,采用流式细胞仪检测细胞凋亡情况。
1.8 双荧光素酶报告基因实验 对数生长期的MCF-7细胞以胰酶消化,并以含10%胎牛血清的DMEM培养液调整细胞密度为2×105个/毫升,将TRIB1-Wt重组载体质粒、TRIB1-Mut重组载体质粒分别与miR-99b-5p mimics或mimics control共转染到MCF-7细胞,每组设置3个平行复孔,于37 ℃培养箱常规培养48 h。使用双荧光素酶报告基因检测试剂盒测定各组细胞相对荧光素酶活性,实验重复3次。
1.9 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 miR-99b-5p和TRIB1在乳腺癌MCF-7细胞中的表达 与人乳腺上皮细胞HBL-100比较,乳腺癌MCF-7细胞中miR-99b-5p的表达量明显降低(P<0.01),而TRIB1蛋白的表达明显升高(P<0.01)(见图1、表1)。
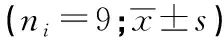
表1 HBL-100细胞和MCF-7细胞中miR-99b-5p表达量及TRIB1蛋白表达水平比较
2.2 转染miR-99b-5p mimics对MCF-7细胞中miR-99b-5p和TRIB1表达的影响 转染48 h后,miR-99b-5p组MCF-7细胞中miR-99b-5p的表达量高于Control组和miR-NC组(P<0.05),TRIB1蛋白表达水平低于Control组和miR-NC组(P<0.05);miR-NC组与和Control组中miR-99b-5p和TRIB1蛋白表达差异均无统计学意义(P>0.05)(见图2、表2)。
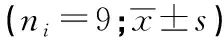
表2 各组MCF-7细胞中miR-99b-5p表达量及TRIB1蛋白表达水平比较
2.3 过表达miR-99b-5p对MCF-7细胞增殖能力的影响 MTT实验结果显示,miR-99b-5p组MCF-7细胞在转染48 h和72 h时OD值均低于miR-NC组和Control组(P<0.05); Control组和miR-NC组MCF-7细胞在转染24、48、72 h时OD值差异均无统计学意义(P>0.05)(见表3)。
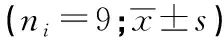
表3 各组MCF-7细胞在转染24、48、72 h时OD值比较
2.4 过表达miR-99b-5p对MCF-7细胞凋亡的影响 AnnexinV-FITC/PI双染色法结果显示,miR-99b-5p组MCF-7细胞凋亡率高于miR-NC组和Control组(P<0.05);Control组和miR-NC组MCF-7细胞凋亡率差异无统计学意义(P>0.05)(见图3、表4)。
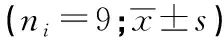
表4 各组MCF-7细胞凋亡率比较
2.5 miR-99b-5p靶向TRIB1关系验证 TargetScan等生物信息学在线软件预测发现,miR-99b-5p与TRIB1 3′UTR存在互补配对碱基(见图4)。双荧光素酶报告基因实验结果显示,共转染miR-99b-5p mimics和TRIB1-Wt后,与miR-NC组比,miR-99b-5p组MCF-7细胞相对荧光素酶活性明显降低(P<0.01);共转染miR-99b-5p mimics和TRIB1-Mut后,miR-NC组和miR-99b-5p组MCF-7细胞相对荧光素酶活性差异无统计学意义(P>0.05)(见表5)。
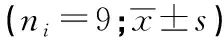
表5 各组MCF-7细胞相对荧光素酶活性比较
3 讨论
乳腺癌是一种异质性疾病,即使组织形态学相同的肿瘤,对治疗的反应及预后可能不同[9]。目前用于治疗乳腺癌的主要策略仍主要依赖于放疗和化疗,这些治疗方式通常会引起严重的不良反应,并且在许多情况下治疗效果有限[10]。因此,探究乳腺癌的发病机制,开发乳腺癌的靶向治疗显得尤为重要。自从20世纪90年代初首次发现miRNA以来,它们已经被确定在癌症的发生和进展中发挥着越来越重要的作用[11-12]。在乳腺癌的生理病理进展中,有许多分子涉及各种生物学进展,如蛋白质、生长因子、细胞因子、非编码RNA等[13-14]。一些miRNA充当肿瘤抑制因子或抑癌基因,在乳腺癌致癌的许多方面发挥关键作用,包括细胞增殖、分化、凋亡、转移和血管生成[15-16]。miR-99b-5p的作用已在人类多种实体瘤中得到广泛研究,许多研究[17-18]表明miR-99b-5p在多种肿瘤中呈低表达,包括结肠癌、膀胱癌、视网膜母细胞瘤和结直肠癌,发挥抑癌基因的作用。有研究[19]显示,miR-99b-5p在胃癌组织和细胞系中的表达均下调,恢复其表达能够通过靶向调控IGF-1R抑制胃癌细胞增殖和细胞周期进程。ZHANG等[20]研究显示,与非肿瘤性脑组织相比,胶质瘤组织中miR-99a、miR-99b和miR-100表达水平均显著降低,miR-99a、miR-99b和miR-100的过表达导致胶质瘤细胞迁移和侵袭的抑制。本研究结果显示,miR-99b-5p在乳腺癌MCF-7细胞中的表达明显低于人乳腺上皮HBL-100细胞;同时,过表达miR-99b-5p能够明显抑制MCF-7细胞增殖,促进其凋亡。本研究发现miR-99b-5p发挥肿瘤抑制功能,与以往研究一致,因此推测在乳腺癌的发生、发展过程中,miR-99b-5p充当肿瘤抑制因子。
TRIB1是位于8q24区域的基因,目前被鉴定为胃癌、前列腺癌、食管癌和卵巢癌的致癌基因[21]。GENDELMAN等[7]通过贝叶斯网络推理建模将TRIB1识别为癌细胞中细胞周期进程和存活的新型调节因子,进一步乳腺癌临床标本验证了TRIB1的高表达水平。WANG等[22]对三阴性乳腺癌基因组谱的综合探索确定潜在的药物靶点的研究中发现,TRIB1可能是三阴性乳腺癌治疗的新靶点。本研究发现,相较于乳腺上皮HBL-100细胞,TRIB1在乳腺癌MCF-7细胞中的表达明显升高,该结果提示TRIB1可能是乳腺癌的致癌基因;双荧光素酶报告基因实验验证了miR-99b-5p和TRIB1的靶向关系,与前期生物信息学软件预测结果一致,且过表达miR-99b-5p明显抑制了TRIB1蛋白的表达。因此,miR-99b-5p可靶向负调控TRIB1蛋白表达,进而抑制MCF-7细胞的增殖,并诱导其凋亡。
综上,在乳腺癌MCF-7细胞中,miR-99b-5p呈低表达,而TRIB1呈高表达;过表达miR-99b-5p可降低MCF-7细胞增殖,并促进其凋亡,其机制可能是通过靶向抑制TRIB1蛋白的表达发挥作用。

