COVID-19病毒N基因在昆虫细胞内的表达
宿 放,韩佃刚 ,叶玲玲 ,张 冲 ,尹尚莲 ,罗倩敏 ,董仙兰 ,李瑶瑶 ,李凌枫 ,艾 军,信吉阁
(1.云南农业大学 动物医学院,云南 昆明 650201;2.昆明海关,云南 昆明 650200)
突发和再次暴发的传染性疾病是公共卫生系统面临的全球性挑战[1-2]。2019年12月底暴发的由新型冠状病毒导致的新型冠状病毒肺炎(Coronavirus disease 2019,COVID-19)是当前全球关注的公共健康问题,严重威胁全球人类健康。新型冠状病毒属于冠状病毒科冠状病毒属,因其外包膜突起颗粒形似冠状而得名[3]。2020年2月12日,国际病毒分类委员会正式将新型冠状病毒命名为严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)[4]。SARS-CoV-2具有极强的传染性,主要通过呼吸道飞沫和接触传播,也可经消化道传播,感染者可出现发热、干咳、乏力、胸闷等症状,但也有无症状感染者[5]。
SARS-CoV-2是β属单股正链RNA病毒,基因组序列约有29 kb,拥有10个基因,可有效编码10个蛋白[6]。作为SARS-CoV-2基因同一条编码链上5个典型的开放阅读框(ORF)之一的核衣壳蛋白(Nucleocapsid gene,N gene,419 aa),分子量接近46 ku[7-8]。N蛋白是一种高免疫原性蛋白,在感染过程中大量表达,与病毒基因组RNA相互缠绕形成病毒核衣壳,具有较高的保守性和RNA分子伴侣活性,在病毒复制过程中相比其他基因而言不易突变,同时在病毒RNA的合成过程中发挥着重要的作用[9-10]。作为真核表达系统的一员,昆虫细胞表达系统有许多独特的优点,在众多研究中被广泛利用[11-14]。
新型冠状病毒检测方法的研究,对于此病的防控非常重要。本研究利用昆虫表达系统表达外源蛋白更接近天然蛋白的特点,根据SARS-CoV-2病毒N蛋白在病毒感染过程中大量表达,可作为抗原和抗体检测靶标的特性,开展了SARS-CoV-2病毒N蛋白在昆虫细胞上的表达研究。
1 材料和方法
1.1 试验材料
1.1.1 试验材料 包含目的片段的人工合成重组质粒pUC57-COV19-N来自生工生物工程(上海)股份有限公司,E.coliDH5α感受态细胞来自TaKaRa公司,E.coliDH10Bac、pFastBacTMHTB载体来自Thermo Fisher Scientific公司,Sf9昆虫细胞为昆明海关技术中心动物检疫实验室保存。
1.1.2 试剂 高保真酶Primer STAR HS、PremixTaq酶、dATP、质粒提取试剂盒、琼脂糖凝胶回收试剂盒、DNA Ligation Kit Ver.2.1、限制性内切酶BamH Ⅰ和XbaⅠ、T-Vector pMD19(simple)、牛血清白蛋白(BSA)来自TaKaRa公司;SOC培养基、10×TBST洗液、Cellfectin ReagentⅡ脂质剂来自Thermo Fisher Scientific公司;Grace细胞培养基、卡那霉素(Kan)、四环素(Tet)、庆大霉素(Gen)、氨苄青霉素(Amp)来自Solarbio公司。
1.1.3 仪器 PCR仪来自美国Bio-Rad公司,高速台式离心机来自德国Eppendorf公司,高速液体冷冻离心机来自日本HITACHI公司,超净工作台来自美国Termo Forma公司,凝胶成像系统来自美国基因公司,恒温空气摇床来自美国Life Sciences公司,电泳仪来自德国Pharmacia公司,细胞培养箱来自日本SAKURA公司,倒置显微镜来自德国莱卡公司,超低温冰箱来自日本SANYO公司。
1.2 试验方法
1.2.1 引物合成 以pUC57-COV19-N为模板设计出一对PCR扩增引物,并根据pFastBacTMHTB载体序列和结构特点选择BamH Ⅰ和XbaⅠ作为酶切位点分别加至上、下游引物5′端(下划线表示酶切位点):COV19-N-F:5′-TGGGATCCATGTCTGATAATGGACC-3′(BamH Ⅰ);COV19-N-R:5′-CGTCTAGATTAGGCCTGAGTTGAGTC-3′(XbaⅠ)。
1.2.2 PCR扩增目的片段 使用高保真酶Primer STAR HS进行扩增,PCR反应体系为:5×PrimeSTAR Buffer,10 μL;dNTP Mixture(2.5 mmol/L),4 μL;COV19-N-F(10 μmol/L),1 μL;COV19-N-R(10 μmol/L),1 μL;COV19-N人工合成质粒,2 μL;高保真酶Primer STAR HS(2.5 U/μL),0.5 μL;ddH2O补足至50 μL。PCR扩增程序为:94 ℃预变性3 min;98 ℃变性10 s,50.7 ℃退火15 s,72 ℃延伸76 s,30个循环;72 ℃延伸3 min。
1.2.3 PCR产物加A尾 以PCR回收产物为模板,50 μL PCR回收产物中加入3 μL dATP和0.5 μLTaq酶,72 ℃延伸30 min;电泳,凝胶回收加A尾的PCR产物。
1.2.4 目的片段与T-Vector pMD19(simple)载体的连接转化 按照TaKaRa DNA连接试剂盒使用说明,取加A尾的PCR产物4 μL与1 μL T-Vector pMD19(simple)载体连接,转化E.coliDH5α感受态细胞,PCR鉴定,获得重组质粒pMD19-T(simple)-COV19-N。
1.2.5 重组质粒pMD19-T(simple)-COV19-N的双酶切鉴定 往25 μL体系中加入1 μLBamH Ⅰ(15 U/μL),1 μLXbaⅠ(15 U/μL),1 μL 10×K Buffer,17 μL pMD19-T(simple)-COV19-N重组质粒,37 ℃水浴酶切2 h;电泳,确定目的条带符合大小后凝胶回收双酶切产物。
1.2.6 重组质粒pMD19-T(simple)-COV19-N的测序 将初步鉴定的pMD19-T(simple)-COV19-N重组质粒送至昆明擎科技术有限公司进行测序。
1.2.7 重组杆粒DH10Bac-pFastBacTMHTB-COV19-N的构建 用限制性内切酶BamH Ⅰ和XbaⅠ双酶切pFastBacTMHTB载体(4 857 bp)和重组质粒pMD19-T(simple)-COV19-N,然后将COV19-N基因连接入pFastBacTMHTB载体,转化E.coliDH10Bac感受态细胞,经Gen、Kan和Tet 3种抗生素筛选,获得重组杆粒DH10Bac-pFastBacTMHTB-COV19-N。
1.2.8 重组杆粒DH10Bac-pFastBacTMHTB-COV19-N鉴定 PCR体系为:5×PrimeSTAR Buffer,10 μL;dNTP Mixture(2.5 mmol/L),4 μL;M13-F(10 μmol/L),1.25 μL;M13-R(10 μmol/L),1.25 μL;重组杆粒,2 μL;高保真酶Primer STAR HS(2.5 U/μL),0.5 μL;ddH2O补足至50 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸5 min,30个循环;72 ℃延伸7 min。电泳,观察目的条带位置确定重组杆粒成功构建。
1.2.9 重组杆粒DH10Bac-pFastBacTMHTB-COV19-N的真核表达 复苏Sf9昆虫细胞,将生长良好的细胞转移至六孔板上,放入28 ℃无CO2的细胞培养箱过夜培养,待细胞生长至约9×105个Sf9细胞/孔时取出六孔板进行试验。利用脂质体转染的方法,在Cellfectin ReagentⅡ脂质剂的介导下将重组杆粒DH10Bac-pFastBacTMHTB-COV19-N转入Sf9昆虫细胞中,同时设立GFP荧光蛋白对照组与空白对照组,在六孔板上培养约3 d后转入长满昆虫细胞的25 cm2小瓶内,继续培养96~120 h后冻融3次收集蛋白,加入适量含PMSF的细胞裂解液煮沸制样并保存于-20 ℃。
1.2.10 重组杆粒DH10Bac-pFastBacTMHTB-COV19-N的蛋白鉴定 配制10%的分离胶与5%的浓缩胶,用制好的重组N蛋白、GFP蛋白进行SDS-PAGE试验,分离胶设定电压50 V,直至PageRuler 预染蛋白Marker刚开始分离时将电压调至120 V,电泳1 h后取出凝胶并在150 V、350 mA的条件下于预冷泡沫箱中转膜1 h。转膜过程中使用的材料均提前用转膜缓冲液浸泡,PVDF膜提前激活,转膜完成后用含3% BSA的1×TBST溶液37 ℃封闭1 h。HRP-His标记抗体用TBST稀释1 000倍,4 ℃过夜孵育,次日取出并加入1×TBST于摇床上清洗3次,每次10 min。称取50 mg DAB溶于100 mL 1×TBST中,加入50 μL 30% H2O2溶液立即染色并拍照观察结果。
2 结果与分析
2.1 重组质粒pMD19-T(simple)-COV19-N的PCR鉴定
查阅资料已知N基因片段大小为1 260 bp,将重组质粒pMD19-T(simple)-COV19-N进行PCR扩增获得图1结果,可以看出,1—4这4个泳道条带大小约为1 260 bp,符合预期大小,表明目的片段被成功扩增,可以用于下一步试验。
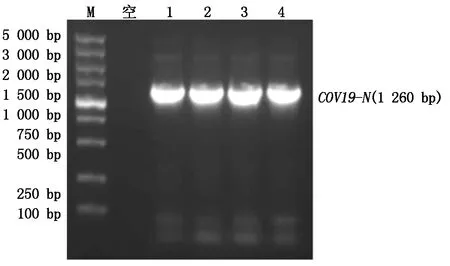
M.DL5000 DNA Marker;1—4. pMD19-T(simple)-COV19-N的PCR产物。M.DL5000 DNA Marker;1—4. PCR products of pMD19-T(simple)-COV19-N.
2.2 重组质粒pMD19-T(simple)-COV19-N双酶切鉴定
利用BamH Ⅰ和XbaⅠ对pMD19-T(simple)-COV19-N重组质粒进行双酶切,1%琼脂糖凝胶电泳检测,从图2中的1—4泳道可以观察到每个泳道上均有2个条带,6泳道条带为T-Vector pMD19(simple)载体带,大小约为2 692 bp,5泳道条带为COV19-N条带,大小约为1 260 bp;第5泳道为2.1中重组质粒pMD19-T(simple)-COV19-N的PCR产物,由于其浓度较高,因此,电泳后与前4个泳道COV19-N条带相比更亮,第6泳道为T-Vector pMD19(simple)空载体带,由于同种质粒会因为空间结构不同而导致电泳速率发生变化,T-Vector pMD19(simple)空载体条带电泳速率会高于双酶切得到的T-Vector pMD19(simple)载体条带的电泳速率,因此,该空载体目的条带离点样孔更远。通过前4个泳道与5,6这2个泳道的对比结果可知双酶切试验成功,表明N基因与T-Vector pMD19(simple)载体成功连接,因此,可将样品测序来做进一步鉴定。

M.DL5000 DNA Marker;1—4.pMD19-T(simple)-COV19-N双酶切结果;5.pMD19-T(simple)-COV19-N的PCR产物对照;6.T-Vector pMD19(simple)空载体对照。
2.3 重组质粒pMD19-T(simple)-COV19-N测序
得到测序结果与原人工合成序列进行比对,可知送出测样的序列与原序列相同,表明在扩增过程中碱基未发生突变和错漏等情况,可继续进行重组杆粒的构建。
2.4 重组杆粒DH10Bac-pFastBacTMHTB-COV19-N的PCR鉴定
从图3可以看到,pFastBacTMHTB空载体经过电泳后出现了3个条带,离加样孔最远的条带最亮、浓度最高,是因为环形载体空间中会出现扭转弯曲等情况,导致出现不同的结构,最亮的条带为pFastBacTMHTB空载体的超螺旋结构,超螺旋结构的载体含量越高则做后续的连接试验效率更高。利用M13引物对构建的重组杆粒进行PCR鉴定会出现2个条带,远离加样孔的条带是使用pFastBacTMHT系列的pFastBacTMHTB载体时会出现的固有条带(2 430 bp),离加样孔近的条带大小是由固有条带大小加上N基因大小(3 690 bp),从图4中可观察到2条带,与预期结果相同,表明重组质粒pFastBacTMHTB-COV19-N转入DH10Bac细胞后得到了重组杆粒,该重组杆粒能直接用于细胞转染试验。
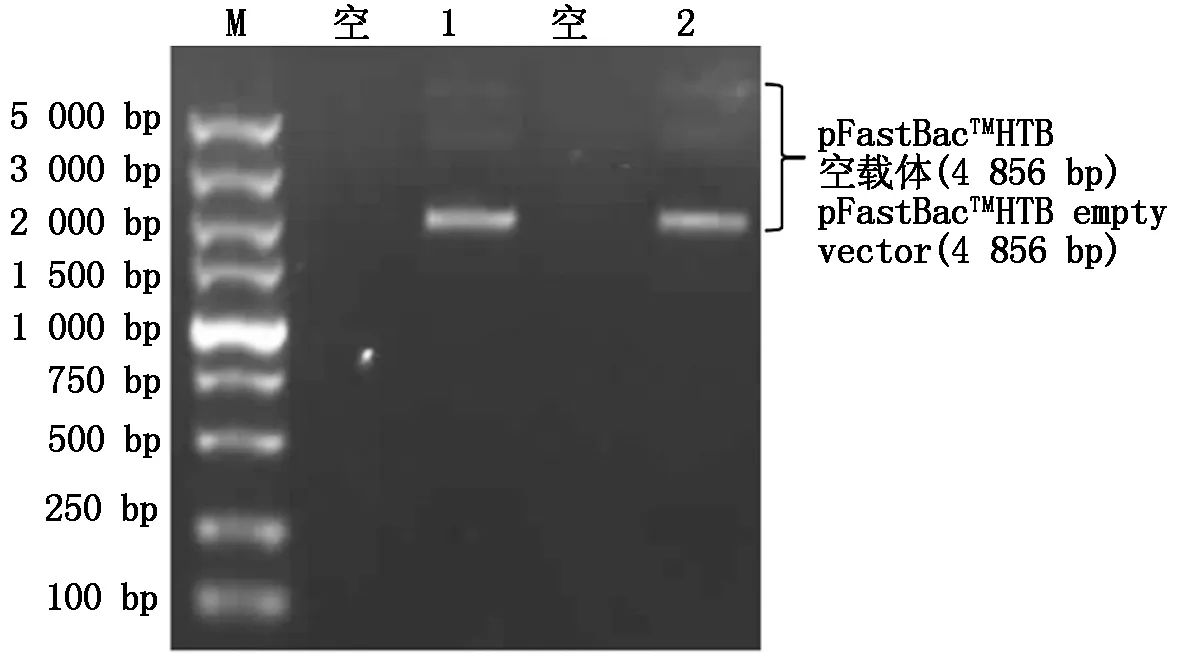
M.DL5000 DNA Marker;1—2.pFastBacTMHTB空载体。M.DL5000 DNA Marker;1—2.pFastBacTMHTB empty vector.
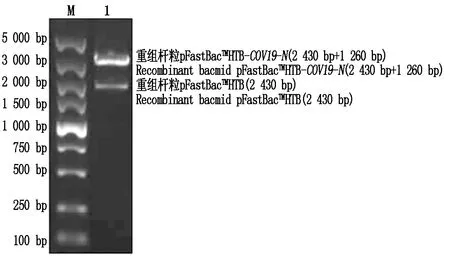
M.DL5000 DNA Marker;1.M13引物PCR扩增重组杆粒。M.DL5000 DNA Marker;1.Amplification of recombinant bacmid by M13 primer PCR.
2.5 细胞转染试验结果
由于重组杆粒DH10Bac-pFastBacTMHTB-COV19-N在转染过程中并不能通过直接观察转染结果判定转染成功,因此,在转染时设立空白组和DH10Bac-pFastBacTMHTB-GFP荧光蛋白组作为对照组。重组GFP转染对照试验,发现重组GFP杆粒转染六孔板内的Sf9细胞确定重组杆粒的最佳转染量为1.5 μg/孔;在试验过程中发现转染6~12 h后即可观察到对照组的荧光出现,说明转染效率很高,再经过3~5 d培养,可观察到对照组出现大量荧光,且细胞生长较好,表明重组杆粒转染成功。对于重组杆粒DH10Bac-pFastBacTMHTB-COV19-N也采取了以上同步的转染策略。杆粒转染六孔板120 h后,细胞转移至长满细胞的瓶内继续培养,约5 d后将细胞冻融3次后收集,加入含PMSF的细胞裂解液并分装保存,准备用于蛋白鉴定试验(图5)。
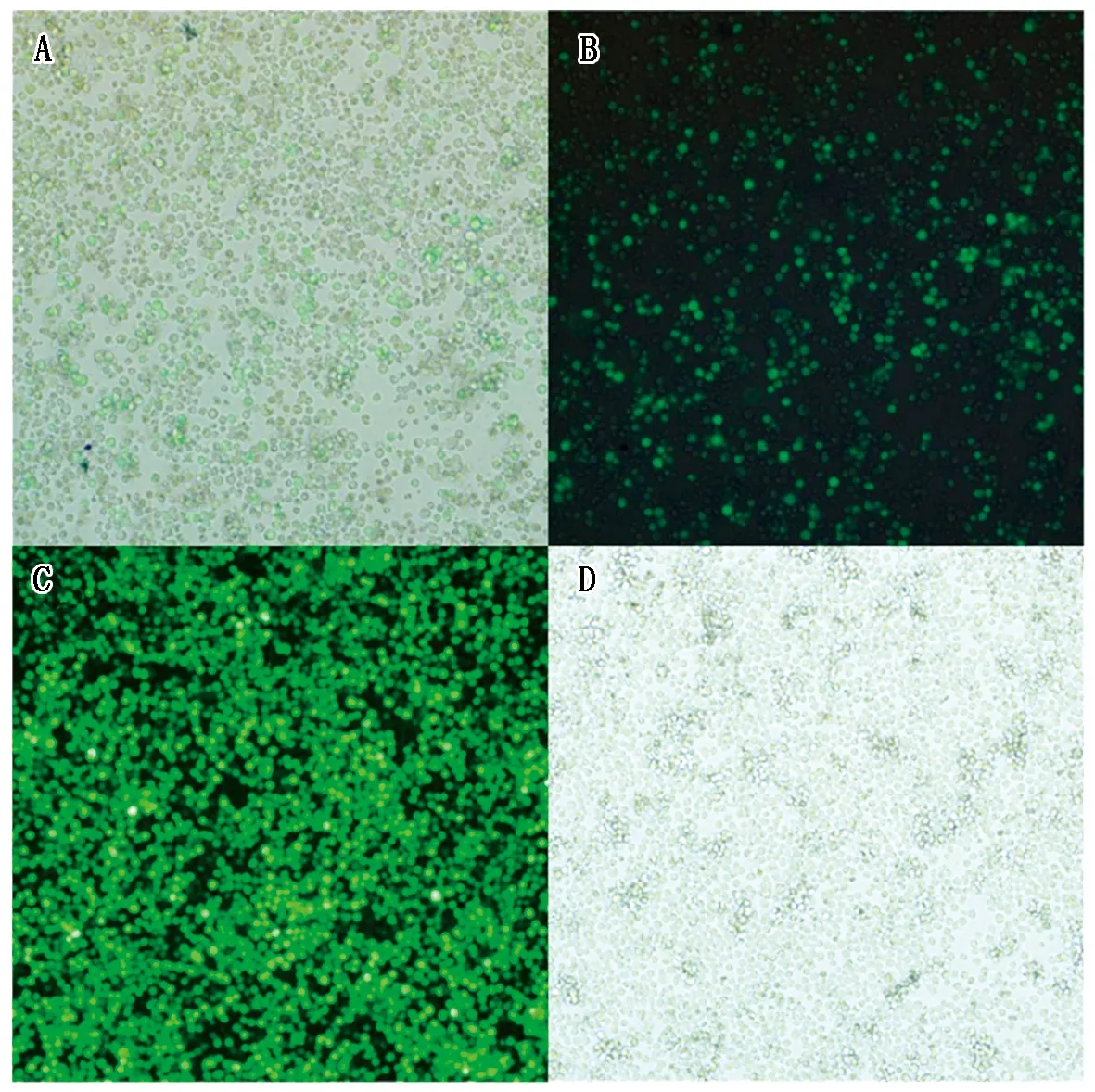
A.DH10Bac-pFastBacTMHTB-GFP对照组(明视野),约12 h,40×10;B. DH10Bac-pFastBacTMHTB-GFP对照组(暗视野),约12 h,40×10;C.DH10Bac-pFastBacTMHTB-GFP对照组,120 h,40×10;D.DH10Bac-pFastBacTMHTB-COV19-N组,120 h,40×10。
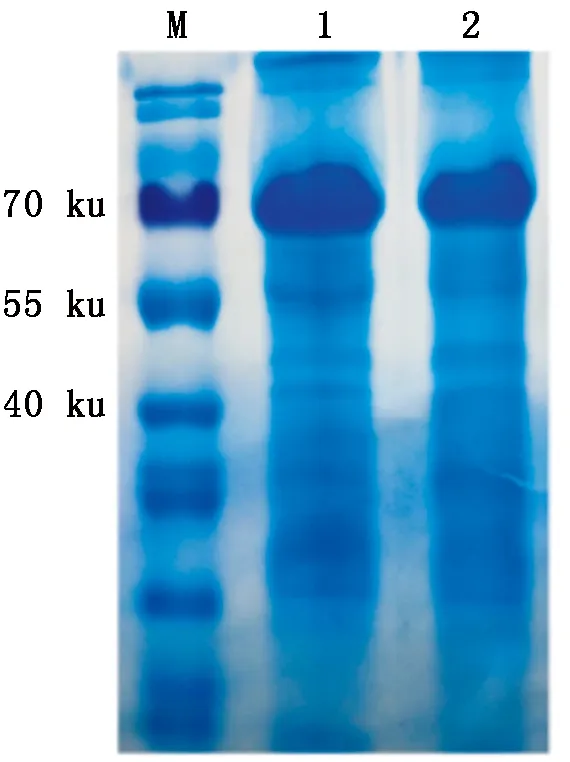
2.6 SDS-PAGE和WB鉴定
用收集的DH10Bac-pFastBacTMHTB-COV19-N重组蛋白(约46 ku)与DH10Bac-pFastBacTMHTB-GFP荧光蛋白制样并进行SDS-PAGE与WB试验。从SDS-PAGE试验结果中无法清楚地区分目的条带(图6),分析原因可能是由于收集和制样时未处理好蛋白样品导致蛋白浓度低。由于pFastBacTMHTB载体末端存在6×His标签,因此,在转膜后使用HRP-His标记抗体来验证重组杆粒是否顺利表达,通过DAB法染色验证蛋白成功在昆虫细胞内表达,重组N蛋白条带颜色与GFP蛋白条带相比较浅(图7),反映出GFP荧光蛋白表达量高于重组N蛋白,同时也说明重组杆粒可以在昆虫细胞内高效表达,因此,后续试验中可以继续优化试验条件使DH10Bac-pFastBacTMHTB-COV19-N重组蛋白表达量提高。
N.PageRuler预染蛋白Marker;1.DH10Bac-pFastBacTMHTB-GFP荧光蛋白对照;2.DH10Bac-pFastBacTMHTB-COV19-N重组蛋白。图7同。

图7 转膜后使用DAB染色法染色Fig.7 DAB staining after membrane transfer
3 结论与讨论
面对严峻的疫情,在当前疫防控工作中,对所有人员进行普筛检查尤其是对无症状感染者的检查是疫病筛查的重点,SARS-CoV-2 lgM/lgG快速检测试剂卡是一种快速判断是否是无症状感染者的一种重要血清学检测方法,其中N蛋白便是SARS-CoV-2 lgM/lgG快速检测试剂卡的核心原材料,这表明N蛋白的重要性。本试验利用昆虫细胞表达系统中杆状病毒穿梭载体的稳定性,使病毒迅速在昆虫细胞内进行稳定传播来最大限度保证外源蛋白的稳定表达,同时,属于真核表达系统的昆虫细胞表达系统也有许多原核表达系统(大肠杆菌表达系统)不具备的优点:可对表达的蛋白质进行翻译加工,且能正确进行空间折叠和形成二硫键,从而使表达的重组蛋白更接近于天然的蛋白质;可对重组蛋白进行定位,如将核蛋白转移到细胞核上、膜蛋白转移到细胞膜上、分泌蛋白分泌到细胞外;昆虫细胞较易培养,能表达自然界大部分蛋白质,通常用于大规模表达重组蛋白,与哺乳动物细胞表达系统相比缩短了从基因克隆至蛋白表达的时间;具有高度特异的宿主范围,对脊椎动物和植物无致病性,是安全的载体[15-16]。在本研究之初希望获得具有天然蛋白质活性的蛋白以便应用于日常检测当中,使检测结果更加精确,因此,选择了被广泛应用的安全高效的昆虫细胞表达系统来表达重组N蛋白,由试验结果可知符合预期目标,成功对重组N蛋白进行表达,为进一步验证重组蛋白的免疫原性及ELISA检测方法的建立等相关研究提供试验基础。
近年来,越来越多的研究人员开始使用昆虫表达系统Bac-to-bac来表达蛋白,并进行相关的研究。徐兴莉等[17]首次采用昆虫表达系统对微小牛蜱Enolase基因得到高效表达后进行了免疫反应原性及抗凝指标测定;曾博宇等[18]为获得具有良好免疫原性的流感病毒蛋白,针对流感病毒HA球状头部结构域,利用昆虫表达系统并成功表达,为新型流感疫苗的开发奠定了基础;张愉等[19]针对广西IBV优势血清型代表株,利用昆虫表达系统成功表达出具有很好免疫原性的GX-YL5株的S蛋白。王睿男等[20]为了制备出特异性强、亲和性高,针对牛γ干扰素的单克隆抗体,同样选择了昆虫表达系统来代替原核表达系统进行试验,原因是昆虫表达系统表达的蛋白质其空间结构与天然牛IFN-γ蛋白更为相近。大量的文献表明,昆虫表达系统在不同病毒的蛋白表达中已被广泛应用,且起到了非常重要的作用,表达出的蛋白更接近天然蛋白质,具有更好的免疫原性。经中国知网检索,查阅的文献中发现,关于COV19-N蛋白的表达通常使用的为原核表达系统,利用真核表达系统表达该蛋白几乎没有相关文献,而真核表达系统表达出的蛋白质更接近于天然的蛋白质,因此,在后续相关的试验及实际检测中利用真核表达系统表达的重组N蛋白应会使试验结果和检测结果更加精确,进一步降低假阳性结果出现的可能性,提高检测效率。本研究利用Bac-to-bac昆虫细胞表达系统成功构建了重组杆粒DH10Bac-pFastBacTMHTB-COV19-N。在试验过程中为了保证每个步骤的精确无误,在设计引物时于引物两端增加酶切位点以便构建过程中每一个步骤除了PCR验证外再进行双酶切验证并测序,测序结果表明,构建的重组N基因与原人工合成序列100%相同,证明重组N蛋白载体构建成功。用重组N蛋白和GFP蛋白分别转染Sf9昆虫细胞,并设置了转染细胞的质粒与试剂的浓度梯度来尽量保证转染效果更佳,冻融裂解收集蛋白后通过SDS-PAGE与WB试验、利用HRP-His标记抗体证明重组蛋白在昆虫细胞内成功表达,虽然条带颜色较浅,但期望后期通过不断优化转染和蛋白制样等步骤来增加样品中的蛋白含量、提高目的条带颜色深度。
本研究利用昆虫表达系统成功构建了重组杆粒DH10Bac-pFastBacTMHTB-COV19-N并验证其在昆虫细胞内成功表达,为建立更精确的ELISA检测方法提供了试验基础。

