谷子SibHLH19基因的克隆及表达分析
邹晓悦,刘 佳,李志勇,马继芳,王永芳,全建章,刘 磊,白 辉,董志平
(1.河北省农林科学院 谷子研究所,国家谷子改良中心,河北省杂粮重点实验室,河北 石家庄 050035;2.河北师范大学 生命科学学院,河北 石家庄 050024)
bHLH(Basic helix-loop-helix)家族是真核生物中最广泛的一类转录因子,也是植物中仅次于MYB转录因子的第二大类转录因子,它可以通过与靶基因中的特定基序相互作用来调节基因表达,在植物生长发育以及应对逆境胁迫中发挥重要作用[1]。
已有研究表明,bHLH转录因子对于调控植物器官的生长发育、根毛和表皮毛的发育都起到重要作用[2]。研究发现,bHLH转录因子SPEECHLESS(SPCH)、MUTE和FAMA在气孔发育过程中起不同作用,该基因的任何突变都会导致气孔发育不当[3]。水稻中的bHLH转录因子LAX在茎尖分生组织和新分生组织形成区域之间的边界表达,是腋芽原基形成的主要调节因子[4]。拟南芥中,GL3编码的bHLH蛋白参与根毛的发育过程,过表达玉米的转录因子ZmbHLH4有利于促进种子萌发[5-6]。可见,bHLH转录因子参与了植物的多种生长发育过程。
bHLH转录因子在应对植物干旱、盐、寒冷、缺铁等逆境胁迫方面均有重要作用[7]。目前,对bHLH转录因子参与植物逆境胁迫的研究较多,如在水稻、小麦和玉米等主要作物中都鉴定到许多 bHLH转录因子参与了对非生物胁迫的响应[8]。此外,bHLH转录因子还参与了植物对生物胁迫的响应。拟南芥中,bHLH转录因子基因FAMA功能缺失导致灰霉菌(B.cinerea)的易感性增加,而过表达则对病原菌的抗性增加,证明FAMA基因有利于提高拟南芥对病原菌灰霉菌的抗病性[9]。水稻中,OsbHLH6在稻瘟病菌侵染过程中上调表达,并通过动态调节水杨酸(Salicylic acid,SA)和 茉莉酸(Jasmonic acid,JA)之间的拮抗来调控水稻的抗病性[10]。此外,有研究在甘蔗、大豆、黄瓜、棉花等作物中也分别鉴定到SsbHLH03/04/27/36/37、GmPIB1、CsIVP、GhbHLH171等bHLH转录因子,它们在植物与病原物互作过程中起正调控作用[11-14]。
谷子(Setariaitalica)是我国重要的杂粮作物,抗旱耐瘠、营养丰富、适应性强。由粟单胞锈菌(Uromycessetariae-italicae)引起的谷子锈病是世界范围内谷子最重要的病害之一,该病害可在短期内流行,造成大量减产[15]。生产上选育抗病品种是防治谷锈病经济有效的方法,但是抗锈品种因谷锈病原菌生理小种的变异会丧失抗病性。所以,解析抗锈病相关基因,对于抗锈机理的深入了解、抗锈品种的培育与抗病品种使用年限的延长具有重要意义。Wang等[16]对谷子中bHLH转录因子家族与谷子干旱胁迫的潜在相关性进行了研究,Bai等[17]发现,bHLH转录因子PPLS1调控谷子叶枕叶鞘的颜色,但是关于bHLH转录因子参与谷子抗病过程的研究,目前尚未见报道。
河北省农林科学院谷子研究所植保室前期对谷子锈菌侵染抗病、感病谷子材料的叶片组织进行了比较转录组分析,筛选出差异表达上调基因SibHLH19,本研究以SibHLH19基因作为研究对象,克隆获得了SibHLH19CDS全长序列和启动子序列,对其生物学特征通过生物信息学软件进行了分析,采用Real-time PCR技术检测了SibHLH19基因在谷子不同组织以及谷锈菌侵染过程中的表达模式,并检测了该基因的原核表达水平,旨在为深入研究SibHLH19基因在谷子抗锈病过程中的功能提供科学参考。
1 材料和方法
1.1 试验材料及试剂
试验所用材料为谷子抗锈病材料十里香和感锈病材料豫谷1号,供试菌株为粟单胞锈菌强毒性小种A57的单孢菌系93-5,均由河北省农林科学院谷子研究所植保室保存。经多年鉴定,十里香(SLX)和豫谷1号(YG1)对谷锈菌单孢菌系93-5的侵染分别表现抗病和感病。
2×Phanta Flash Master Mix(Dye Plus)购自南京诺唯赞生物科技股份有限公司、RNA Easy Fast植物组织RNA快速提取试剂盒(RNA Easy Fast Plant Tissue Kit)购自天根生化科技(北京)有限公司、FastKing cDNA第一链合成试剂盒(FastKing RT Kit With gDNase)购自天根生化科技(北京)有限公司;pMD19-T载体、TB GreenTMPremix EX TaqTMⅡ(Tli RNaseH Plus)购自TaKaRa;引物由北京擎科生物科技有限公司合成。
1.2 试验方法
1.2.1 试验材料处理 采集豫谷1号苗期地上部分、地下部分以及孕穗期的根、茎、叶、穗6个部位样品,液氮速冻样品后-80 ℃冰箱保存。选取生长21 d长势一致的十里香和豫谷1号幼苗,采用新鲜谷锈菌单孢菌系93-5制备的孢子悬浮液(浓度为1.0×105个/mL)对叶片进行喷雾接种,分别于接种后0,8,12,16,24 h共5个时间点剪取叶样,液氮速冻样品后-80 ℃冰箱保存。
1.2.2SibHLH19全长CDS序列克隆 通过谷子豫谷1号参考基因组(https://phytozome-next.jgi.doe.gov/info/Sitalica_v2_2)获得SibHLH19(Seita.2G277700)的全长编码序列(Coding sequence,CDS),利用Primer Premier 5.0设计特异性引物,见表1。以谷子锈菌处理后的十里香叶片cDNA为模板,用2×Phanta Flash Master Mix(Dye Plus)进行PCR扩增。50 μL PCR反应体系:2×Phanta Flash Master Mix(Dye Plus)25 μL、100 ng/μL模板DNA 2 μL、10 μmol/L上、下游引物各2 μL、灭菌ddH2O 19 μL。PCR扩增程序:98 ℃预变性30 s;98 ℃变性10 s,56 ℃退火5 s,72 ℃延伸5 s,35个循环反应;最后72 ℃再延伸1 min。
电泳检测切胶回收的产物与pMD19-T载体连接,连接产物转化大肠杆菌(E.coli)DH5α感受态细胞,挑取阳性克隆进行测序。
1.2.3SibHLH19启动子序列克隆与启动子顺式作用元件分析 根据谷子豫谷1号参考基因组序列,选择SibHLH19起始密码子上游2 000 bp序列作为候选启动子,设计特异性引物,见表1。以十里香基因组DNA为模板,利用2×Phanta Flash Master Mix(Dye Plus)进行PCR扩增,PCR反应体系见1.2.2。PCR扩增程序:98 ℃预变性30 s;98 ℃变性10 s,56 ℃退火5 s,72 ℃延伸15 s,35个循环反应;最后72 ℃再延伸1 min。
利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库对SibHLH19启动子序列进行顺式作用元件分析。
1.2.4 谷子SibHLH19蛋白生物信息学分析 通过谷子豫谷1号参考基因组获得SibHLH19的蛋白质序列,参考宋振君等[18]的方法对其进行蛋白质结构域预测、理化性质分析、蛋白质二级结构预测、蛋白质三级结构预测、蛋白质序列比对生物信息学分析,选择相似性程度最高的来自9个物种的bHLH19同源基因的蛋白质序列,利用ClustalX 2.0进行多重序列比对,利用MEGA 7以邻近法(Bootstrap设为1 000)构建系统进化树,分析其亲缘关系的远近。
1.2.5 谷子中SibHLH19的实时荧光定量PCR检测与分析 采用RNA Easy Fast植物组织RNA快速提取试剂盒提取不同处理谷子样品的总RNA,反转录获得cDNA作为Real-time PCR的模板。选用谷子肌动蛋白基因Act2作为内参基因。Real-time PCR反应参考白辉等[19]的方法(表达倍数的阈值设定为>1.5,<0.67),使用SPSS 26.0进行显著性分析。用于Real-time PCR的引物信息见表1。
1.2.6 原核表达载体的构建与诱导表达 将带有KpnⅠ和Hind Ⅲ酶切位点的SibHLH19PCR扩增产物与KpnⅠ和Hind Ⅲ双酶切的pET30a载体进行琼脂糖凝胶回收、连接、转化大肠杆菌DH5α,挑取阳性克隆进行测序验证。将测序正确的重组质粒pET30a-SibHLH19转化大肠杆菌BL21(DE3)。之后参考白辉等[19]的方法加入0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)诱导蛋白表达并获得样品,随后用SDS-PAGE分离检测。
2 结果与分析
2.1 SibHLH19基因CDS全长序列和启动子序列的克隆及分析
克隆所得SibHLH19基因CDS序列全长为843 bp,编码氨基酸为280个(图1-A、B),与谷子豫谷1号参考基因组注释基因Seita.2G277700序列完全一致。氨基酸序列分析表明,SibHLH19编码蛋白具有bHLH转录因子的保守DNA结合结构域,位于116—165氨基酸,包括2个高度保守且功能不同的区域:氨基末端可以将 DNA 与具有保守六核苷酸序列的E 盒 (CANNTG)结合,羧基末端是 HLH 区域,能够与其他蛋白质相互作用形成同源和异源二聚体。

表1 引物信息Tab.1 Primer information
克隆得到SibHLH19基因启动子序列,测序比对发现,其与谷子豫谷1号参考基因组序列一致(图1-C)。对启动子序列进行顺式作用元件分析表明,该启动子区域除了具有CAAT-box、TATA-box保守元件外,还具有9种37个与激素、胁迫等相关的重要顺式作用元件(表2),其包括脱落酸应答元件(ABRE),茉莉酸甲酯应答元件(CGTCA-motif、 TGACG-motif),脱水、低温、盐胁迫应答元件(DRE),干旱胁迫应答元件(MBS),厌氧胁迫响应元件(ARE),光响应元件(Box4、BoxⅡ、GATA-motif、G-box)以及与分生组织表达相关的应答元件(CAT-box)。

A.SibHLH19 CDS的PCR扩增;B.SibHLH19的氨基酸序列(下划线代表SibHLH19蛋白的保守结构域);C.SibHLH19启动子的PCR扩增;M.DNA分子量标准DL2000。A.PCR amplification of SibHLH19 CDS;B.The amino acid sequences of SibHLH19(The underline represents the conservative domain of SibHLH19 protein);C.PCR amplification of SibHLH19 promoter;M.DNA molecular weight standard DL2000.
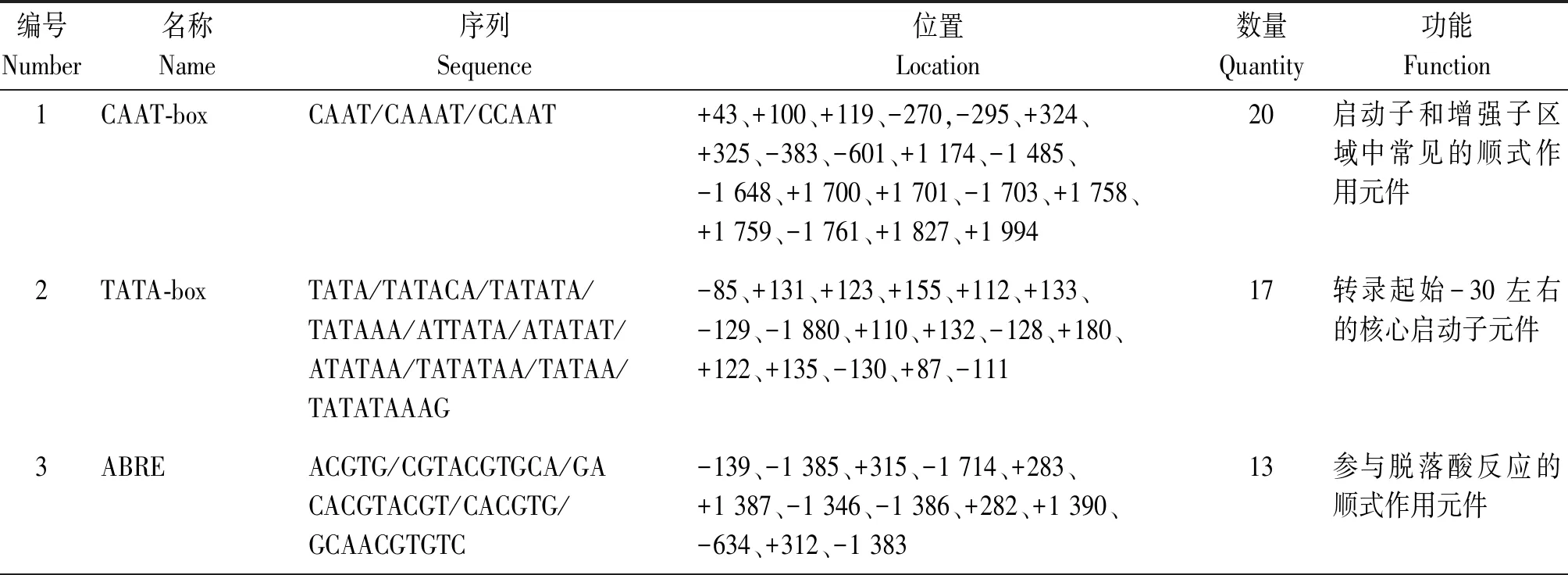
表2 SibHLH19启动子部分顺式作用元件Tab.2 Partial cis-acting elements of SibHLH19 promoter
2.2SibHLH19基因的生物信息学分析
2.2.1SibHLH19编码蛋白质的理化性质 为分析SibHLH19编码蛋白质的理化性质,利用ExPASy-ProtParam tool对其进行预测,发现蛋白质分子质量为29.97 ku,理论等电点pI为5.85,编码蛋白质化学式为C1296H2071N397O400S11,属于不稳定亲水性蛋白质:脂肪指数为79.39,不稳定指数为67.10,平均亲水性系数为-0.392。SibHLH19基因编码的280个氨基酸中,带负电荷氨基酸(天冬氨酸Asp+谷氨酸Glu)有36个,带正电荷氨基酸(精氨酸Arg+赖氨酸Lys)30个,丙氨酸Ala含量最高(14.3%),色氨酸Trp含量最低(0.7%)。
2.2.2SibHLH19编码蛋白质的二级、三级结构预测 为分析SibHLH19编码蛋白质的结构,分别利用SOPMA和SWISS-MODEL软件对其进行二级、三级结构预测(图2-A、B),发现该蛋白的二级结构中最大结构元件是无规则卷曲(Random coil)占48.93%,最小的元件为β-转角(Beta turn)占1.79%,另外α-螺旋(Alpha helix)占41.79%、延伸链(Extended strand)占7.50%。对其二级和三级结构预测结果进行比对表明结果较为一致。

A.二级结构;B.三级结构。A.Secondary structure;B.Tertiary structure.
2.2.3SibHLH19编码蛋白质的同源性分析 通过在NCBI上进行Protein Blast比对,结果显示,SibHLH19编码的氨基酸序列属于bHLH家族中的MYC2转录因子。按照序列相似性程度选择了来自糜子(Panicummiliaceum)、哈氏黍(Panicumhallii)、柳枝稷(Panicumvirgatum)、玉米(Zeamays)、高粱(Sorghumbicolor)、小麦(Triticumaestivum)、节节麦(Aegilopstauschiisubsp.strangulata)、南荻(Miscanthuslutarioriparius)和硬粒小麦(Triticumturgidumsubsp.durum)中的SibHLH19同源基因的蛋白质序列构建系统进化树,结果表明(图3),SibHLH19与禾本科植物糜子(RLM85279.1)、哈氏黍(PUZ71581.1)和柳枝稷(XP_039835205.1)氨基酸序列的同源性较高,与小麦(KAF7059972.1)、节节麦(XP_040244423.1)同源性最低。
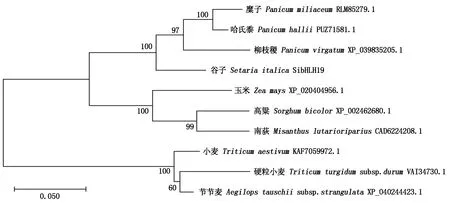
图3 SibHLH19的系统进化树分析Fig.3 The phylogenetic tree analysis of SibHLH19
2.3SibHLH19基因的组织表达分析
为了解谷子不同组织部位中SibHLH19基因的表达情况,对该基因在谷子豫谷1号苗期地上部分(SD-shoot)、地下部分(SD-root)以及孕穗期根(BT-root)、茎(BT-stem)、叶(BT-leaf)和穗(BT-panicle)6个部位的表达量利用Real-time PCR技术进行了检测,结果如图4所示,SibHLH19主要在谷子苗期表达,孕穗期几乎无表达。其中,SibHLH19在苗期地上部分的表达量是地下部分的2.29倍。

不同小写字母表示差异显著(P<0.05)。图5同。Different lowercase indicate significant difference at 0.05 level.The same asFig.5.
2.4 生物胁迫下SibHLH19基因的表达分析
对SibHLH19基因在谷子抗病材料十里香和感病材料豫谷1号叶片接种谷锈菌以及十里香叶片接种水作对照的0,8,12,16,24 h共5个时间点的表达情况利用Real-time PCR技术进行检测分析。结果如图5所示,SibHLH19在抗病和感病材料中的表达模式不同。谷锈菌侵染处理后,SibHLH19基因在抗病材料十里香中从8 h开始上调表达并达到峰值,16 h继续上调表达,分别是0 h表达量的14.8,11.0 倍;而在感病材料豫谷1号中,16 h表达量是0 h表达量的2.15倍,略微上调表达,其余时间点都表现下调表达。在谷锈菌侵染处理的8,16 h,SibHLH19基因在十里香中的表达量显著高于在对照及豫谷1号中的表达量(P<0.05),分别为对照表达量的17.0,3.6倍、为感病材料表达量的89.3,5.1倍。在谷锈菌侵染处理的12 h,SibHLH19基因在十里香中的表达量显著高于在对照及在豫谷1号中的表达量(P<0.05),分别为对照和感病材料表达量的10.4,2.7倍。相比感病材料可见,SibHLH19基因在抗病材料中表现出更早、更剧烈、更持久的诱导表达,推测SibHLH19基因可能正调控谷子早期抗病反应。
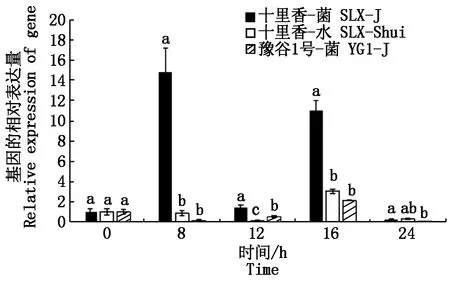
图5 SibHLH19在抗、感反应中不同时间点的表达模式分析Fig.5 Relative expression of SibHLH19 after inoculation with Uromyces setariae-italicae in resistance material SLX and susceptible material YG1
2.5 SibHLH19基因的原核表达分析
SibHLH19原核表达的SDS-PAGE结果表明(图6),较未被IPTG诱导的对照相比,由0.1 mmol/L的IPTG诱导1 h出现明显的特异表达条带,表观分子质量约为44 ku,该条带的强度随诱导时间延长而明显增强。结果表明,SibHLH19能够在大肠杆菌BL21中本底表达,而且能被较低浓度的IPTG成功诱导表达。

M.蛋白分子量标准;1—6.IPTG诱导0,1,2,4,6,8 h。M.Protein molecular weight Marker;1—6.IPTG induced 0,1,2,4,6,8 h,respectively.
3 结论与讨论
真核基因表达是一个复杂的过程,既受内源信号调控也受外源信号调控,如表观调控、转录调控、RNA加工调控、翻译调控等[20]。通过对抗病谷子十里香的CDS与启动子序列进行克隆,进而将其与感病谷子豫谷1号序列进行对比,结果发现,抗、感病谷子的CDS序列与启动子序列完全一致。SibHLH19基因在抗、感锈病谷子中基因表达的不同可能不是由启动子以及编码序列引起,增强子等其他顺式作用元件以及环境因素和上下游基因的相互作用均可以引起基因表达的变化,需要进一步深入研究。
已有大量研究表明,bHLH家族的MYC2基因可以参与调节植物的种子、根、叶片等的生长发育,在植物发育过程中对光的质量以及波长等具有很高的敏感性,光在植物发育的早期阶段具有重要作用,而植物对光信号的接收与调节需要一系列的转录因子参与[21]。香鳞毛蕨中DfMYC2基因在叶片中表达量最高,在根中表达量最低,在北柴胡中组织特异性分析发现,MYC2在茎、叶中表达量较高,在根中表达量最低[22-23]。本研究通过Real-time PCR技术,分析了SibHLH19基因在谷子豫谷1号不同发育时期的6个部位的表达情况,结果表明,该基因主要在苗期表达,苗期地上部分表达量最高,在孕穗期几乎不表达,可见在不同的植物中,MYC2表达的部位及时期有所不同。研究报道,一组Z-box结合转录因子MYC2、GBF1和CAM7在拟南芥幼苗期光形态发生中起着至关重要的作用[24],对基因的启动子顺式作用元件进行分析同样得到启动子中存在多个光响应元件以及与分生组织表达相关的应答元件,所以推测SibHLH19基因可能在豫谷1号幼苗时期通过调节整合光信号进而调节谷子幼苗发育。
已有报道,MYC2转录因子介导植物抗生物胁迫过程,并且在多种植物中对其进行了研究[25]。使用烟草抗性品种 Beinhart 1000-1 和易感品种 K326 研究了与抗褐斑病相关的生理和转录特征,结果发现,当褐斑病菌侵染的时候,抗病与感病品种相比,抗病品种中的MYC2基因的表达水平远高于感病品种[26]。在杨树中同样发现,当溃疡病菌入侵时,抗病品种中MYC2基因表达量远高于感病品种[27]。本研究利用Real-time PCR技术检测了SibHLH19基因在谷子响应谷锈菌生物胁迫下不同时间点的表达水平,结果显示,抗病材料十里香和感病材料豫谷1号在谷锈菌侵染后SibHLH19呈现出不同的表达模式。较感病反应,抗病反应中SibHLH19基因的表达表现出上调表达时间早、上调幅度强、持续时间长的特点,而感病反应和十里香对照中,SibHLH19基因仅在16 h表现出低水平的上调表达,其他时间点均表现出不同程度的下调表达,说明SibHLH19基因是谷子抗病材料十里香在抗谷锈菌侵染的生物胁迫过程中被特异诱导表达的。本研究结果与前人试验结果一致。在水稻中研究发现,过表达OsMYC2基因会提高对白叶枯病的抗性,大规模微阵列分析还发现,OsMYC2上调OsJAZ10以及许多其他防御相关基因的表达,认为OsMYC2作为正调控因子防御水稻白叶枯病[28]。据本研究结果推测,SibHLH19基因也是抗锈病反应相关的正调控因子。
在拟南芥以及水稻等植物中,关于MYC2对植物防御的作用机制主要与茉莉酸(JA)信号通路有关。在禾本科单子叶作物水稻中,Ogawa等[29]利用OsMYC2基因敲除植物(osmyc2RNAi)进行RNA测序,对JA合成及信号传导相关基因的研究发现,许多由JA诱导的防御相关基因,例如几丁质酶、β-1,3-葡聚糖酶、泛素连接酶以及蛋白酶抑制剂相关基因的表达受到抑制[29]。JA合成途径以及信号传导关键基因如编码丙二烯氧化合酶的OsAOS1和编码丙二烯氧化环化酶的OsAOC等同样受到OsMYC2的调控,除此之外,许多依赖JA诱导产生的防御相关代谢物也明显减少,说明OsMYC2介导JA诱导的防御反应,通过JA途径参与对水稻防御反应的调节控制[30]。谷子同样为禾本科单子叶作物,防御谷锈病过程中SibHLH19转录因子基因的作用机理,需要进一步研究,而JA信号途径则可能作为分析研究的切入点。并且通过基因启动子顺式作用元件分析得到启动子区存在多个MeJA应答元件,所以进一步说明SibHLH19转录因子与JA相互联系。通过启动子分析发现,在启动子区还存在脱水、低温、盐胁迫,干旱以及厌氧胁迫相关应答元件,推测SibHLH19基因在谷子应对逆境胁迫方面可能也发挥着一定作用。
原核表达结果表明,SibHLH19融合蛋白虽然有本底水平的表达,但是在0.1 mmol/L IPTG处理1 h即可显著地被诱导表达,SDS-PAGE分离检测的表观分子质量为44 ku,比预测分子质量30 ku略大,可能与表达载体pET30a上SibHLH19插入位点上游表达的38个氨基酸残基(4.2 ku)以及蛋白修饰造成不同折叠构象有关,所以推测表达的此蛋白条带是SibHLH19表达的融合蛋白,为SibHLH19抗体制备以及基因功能研究提供抗原基础。本次试验结果为进一步研究SibHLH19基因功能与抗病机制奠定了理论基础。

