家庭支持个体化运动计划对老年多发性骨髓瘤患者疲劳、睡眠和日常行为的影响
朱丽,赵引丽,田丹丹,鲁英娟,郭丝锦
中国人民解放军空军军医大学第一附属医院血液内科,陕西西安 710032
多发性骨髓瘤患者通常需要接受长期的治疗。目前的研究往往集中在患者的治疗效果和预后。但是,多发性骨髓瘤患者还需要面对疲劳、失眠、情绪管理障碍、行为机能障碍等症状[1-2]。这些症状可能与疾病本身、治疗不良反应有关,也可能与冗杂的治疗程序、复杂的治疗方案以及长期的随访需求有关[3-4]。这些是癌症患者中最常见,但也是最容易被忽视的症状。这些症状在很大程度上影响了患者治疗的积极性和依从性。国外文献报道,部分患者因为这些症状甚至更加愿意面对死亡[1]。
癌症相关的疲劳是多维度的,主观的,被认为是令人痛苦并且无法摆脱的。这种疲劳症状是通过休息不能充分缓解[3]。失眠通常与癌症患者的疲劳有关。疲劳程度加重会导致患者白天睡眠时间增加以及体力活动减少,最终导致患者夜间失眠,生理功能紊乱和活动耐受性降低。这些症状会构成一种恶性循环,逐渐导致患者行为失常,逃避治疗,影响患者预后。
老年患者需要面对更加复杂的基础疾病,更加容易产生疲劳感、失眠以及行为异常。临床上缺乏有效的针对策略。有研究指出,运动治疗,可以使多发性骨髓瘤患者在非肿瘤特异性症状上获益[5]。但常规的运动指导方法存在监督性差、患者坚持时间短,运动方案无个体针对性等缺点。家庭支持个体化运动是以个体化运动计划、家庭鼓励与监督以及运动情况反馈为支撑的新康复锻炼模式。这种模式一方面由医务工作人员根据患者条件和运动专业知识制定了合理的运动方案,另一方面由患者家庭成员对患者进行鼓励、监督和运动示范。这种模式可能会增加和长期维持患者从康复运动中获得的益处。本研究旨在探索家庭支持个体化运动模式对年龄大于65 岁的老年多发性骨髓瘤患者疲劳、睡眠以及日常行为的影响。
1 资料与方法
1.1 一般资料选取2020年3月1日—2021年12月31日在中国人民解放军空军军医大学第一附属医院治疗的多发性骨髓瘤患者进行研究。纳入标准:(1)符合国际骨髓瘤工作组多发性骨髓瘤诊断标准[6];(2)患者年龄>65 岁;(3)接受诱导治疗-巩固治疗-维持治疗;(4)患者依从性较好,可以完成本研究中涉及的量表测试;(5)患者完成治疗后,随访时间超过3 个月;(6)患者具有自主行为能力;(7)自愿参与本研究,并签署知情同意书。符合上述所有标准的病例纳入本研究。排除标准: (1)患者合并其他部位恶性肿瘤;(2)患者存在严重脏器功能衰竭;(3)患者接受自体造血干细胞移植;(4)患者伴有凝血功能障碍;(5)患者患有自身免疫性疾病;(6)患者发生骨折或其他运动受限的疾病。具有以上任意1 项标准的病例即排除于本研究。样本量计算公式为,N1=N2=2[(tα/2+tβ/2)s/δ]2。本研究一共招募110 例患者,采用数字表法随机分为观察组和对照组。在随访过程中,观察组和对照组各失访2 例。最终106 例患者被纳入研究,其中观察组患者53 例,对照组患者53 例。本研究经本医院伦理委员会批准。
1.2 干预措施所有患者接受诱导治疗-巩固治疗-维持治疗。在接受治疗的同时对患者进行运动治疗干预。对照组患者接受常规运动指导:要求患者每周至少进行3 次步行锻炼,步行时间为20 min。每周对患者进行随访1 次,了解患者病情变化。观察组患者的干预措施包括:个体化运动计划制定、家庭支持和监督以及运动情况反馈。(1)个体化运动计划制定:运动包括有氧运动和耐力运动。在完成治疗出院后,本研究对患者制定家庭个体化运动计划。有氧训练强度为有氧步行的水平允许患者达到最大心率的65%~80%。叮嘱患者,如果在锻炼时感到头晕、呼吸急促或疼痛,立即停止运动。力量耐力训练的强度为1 次最大重复重量的60%~80%,即单次重复所能举起的最大重量。运动计划的制定需要基于对患者健康和运动史的评估,以及在初始测试中确定的力量水平和有氧能力。每次运动时间不少于20 min,运动频率不少于每周3 次。频率和时间可以根据患者情况调整。(2)运动情况反馈:由研究人员对患者进行锻炼演示。在确认患者可以进行锻炼后,研究人员强调了完成运动计划的重要性。要求患者记录自己的运动情况。研究人员每周跟踪锻炼的频率、强度和持续时间,并对计划进行修改,以适应个人的身体功能。(3)家庭支持:鼓励患者遵守锻炼计划,鼓励家属或重要的其他人参加测试、锻炼演示以及监督工作。
1.3 指标观察与方法所有观察指标在随访3 个月时对患者进行评估。
1.3.1 疲劳程度评估 采用慢性病治疗功能评估疲劳量表(The Functional Assessment of Chronic Illness Therapy-Fatigue,FACIT-F)评估患者在随访3 个月时疲劳程度[7]。评分越高,患者疲劳程度越大。
1.3.2 睡眠质量评估 统计患者白天睡眠时间和夜晚睡眠时间,采用睡眠状况自评量表(Self-Rating Scale of Sleep)评估患者睡眠质量[8]。评分越高,患者睡眠质量越差。
1.3.3 情绪状态评估 采用情绪状态量表(Profile of Mood States,POMS)对患者进行情绪状态进行评估[9]。分值越高,患者情绪状态越好。
1.3.4 心理韧性评估 采用Connor-Davidson 韧性量表(Connor- Davidson resilience scale,CD-RISC)对患者心理韧性进行评估[10]。量表分为韧性、力量和乐观共3 个维度。分值越高,表明患者心理状态越好。
1.3.5 健康行为评估 采用健康促进生活方式量表-Ⅱ(health promoting lifestyle profile-Ⅱ,HPLP-Ⅱ)对患者行为进行评价。分值与患者行为模式良好程度正相关[11]。
1.4 统计学分析本研究所有数据通过SPSS 24.0进行统计学分析。计数资料以例(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,比较采用t 检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 2 组患者基线资料比较2 组患者在年龄、性别、身高、体质量、疾病治疗阶段以及病理分期上的差异均无统计学意义(P>0.05)。见表1。
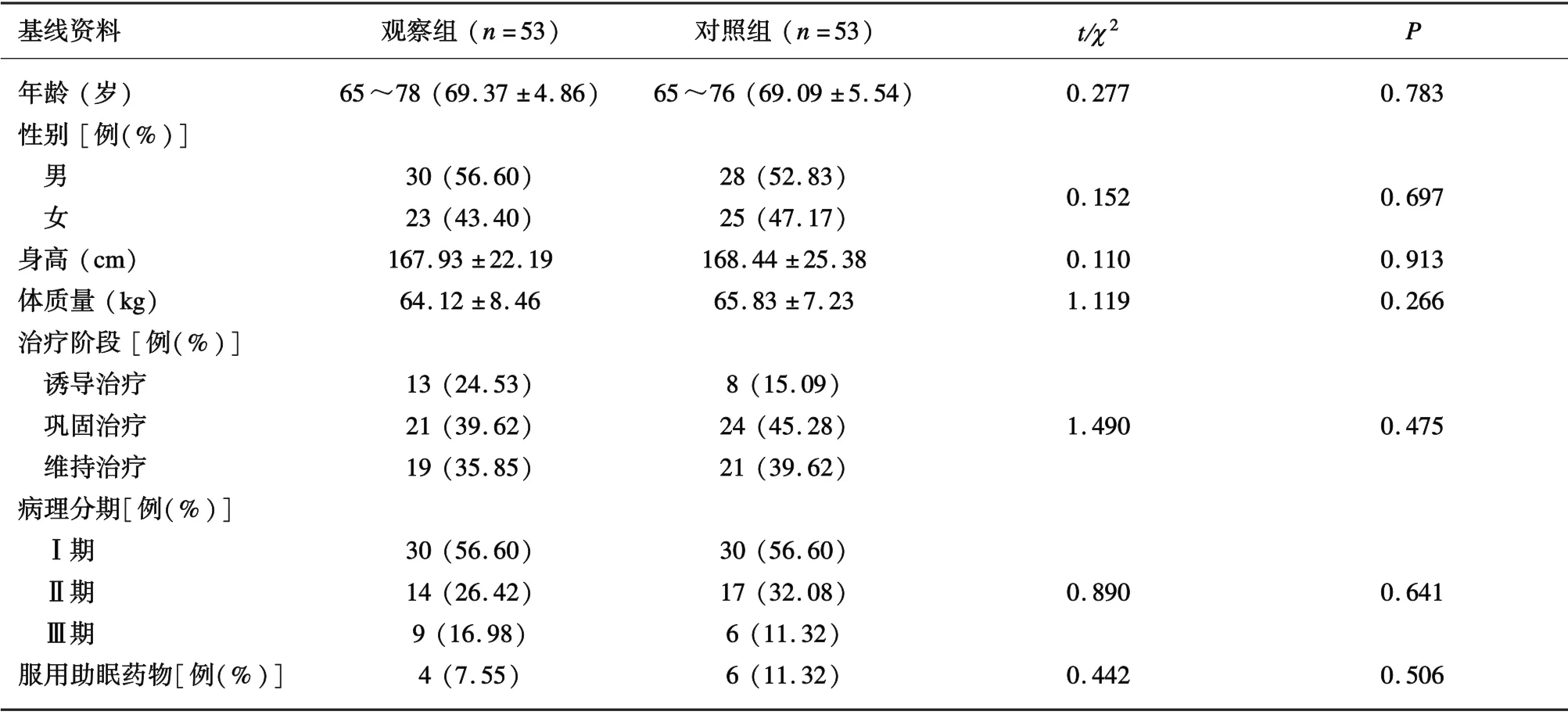
表1 2 组患者基线资料比较
2.2 2 组患者FACIT-F 疲劳评分比较2 组患者干预前后FACT 疲劳评分差异无统计学意义(P>0.05),见表2。
表2 2 组患者FACIT-F 疲劳评分比较(±s,分)

表2 2 组患者FACIT-F 疲劳评分比较(±s,分)
_时间 观察组 对照组 t P干预前 32.78 ±4.93 33.48 ±8.82 0.504 0.615干预后 35.01 ±5.16 34.73 ±7.56 0.223 0.824
2.3 2 组患者POMS 评分比较干预前,2 组患者在POMS 评分上差异无统计学意义(P=0.528);干预后,观察组POMS 评分低于对照组(P=0.027)。见表3。
表3 2 组患者POMS 评分比较(±s,分)

表3 2 组患者POMS 评分比较(±s,分)
_时间 观察组 对照组 t P干预前 70.31 ±13.46 72.14 ±16.18 0.633 0.528干预后 68.29 ±9.24 71.58 ±18.14 2.249 0.027
2.4 2 组患者睡眠质量评分比较干预前,2 组患者夜晚睡眠时间差异无统计学意义(P=0.316);干预后,观察组患者夜晚睡眠时间长于对照组(P=0.003)。干预前,2 组患者白天睡眠时间差异无统计学意义(P=0.446);干预后,2 组患者白天睡眠时间差异无统计学意义(P=0.473)。干预前,2 组患者SRSS 评分差异无统计学意义(P=0.448);干预后,观察组患者SRSS 评分低于对照组(P<0.001)。见表4。
表4 2 组患者睡眠质量评分比较(±s,分)
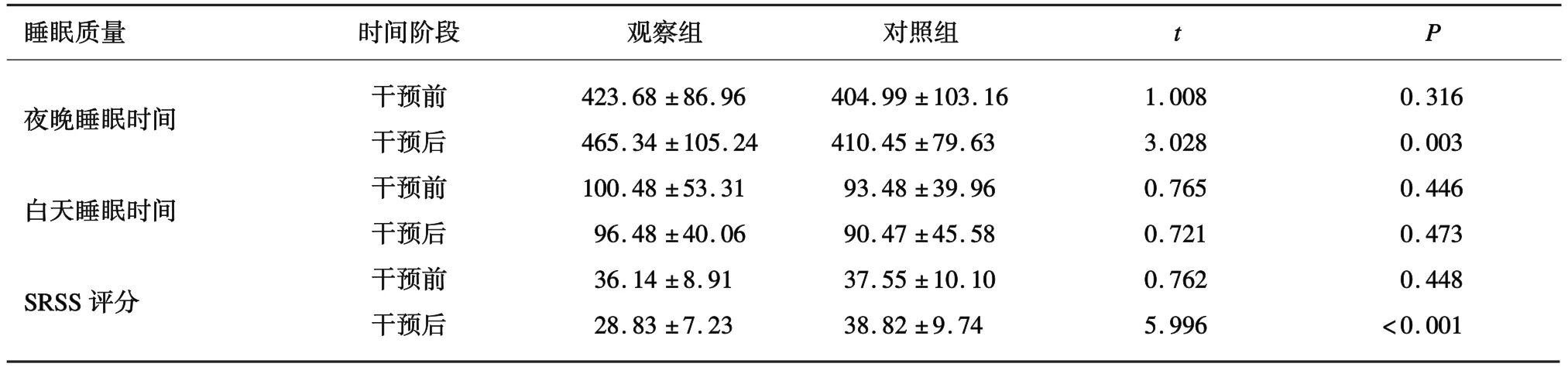
表4 2 组患者睡眠质量评分比较(±s,分)
_睡眠质量 时间阶段 观察组 对照组 t P夜晚睡眠时间 干预前 423.68 ±86.96 404.99 ±103.16 1.008 0.316干预后 465.34 ±105.24 410.45 ±79.63 3.028 0.003白天睡眠时间 干预前 100.48 ±53.31 93.48 ±39.96 0.765 0.446干预后 96.48 ±40.06 90.47 ±45.58 0.721 0.473 SRSS 评分 干预前 36.14 ±8.91 37.55 ±10.10 0.762 0.448干预后 28.83 ±7.23 38.82 ±9.74 5.996<0.001
2.5 2 组患者CD-RISC 评分比较干预前,2 组患者坚韧维度评分差异无统计学意义(P=0.132);干预后,观察组患者坚韧维度评分高于对照组(P<0.001)。干预前,2 组患者力量维度评分差异无统计学意义(P=0.446);干预后,观察组力量维度评分高于对照组(P<0.001)。干预前,2 组患者在乐观维度评分差异无统计学意义(P=0.272);干预后,观察组患者乐观维度评分高于对照组(P<0.001)。见表5。
表5 2 组患者CD-RISC 评分比较(±s,分)
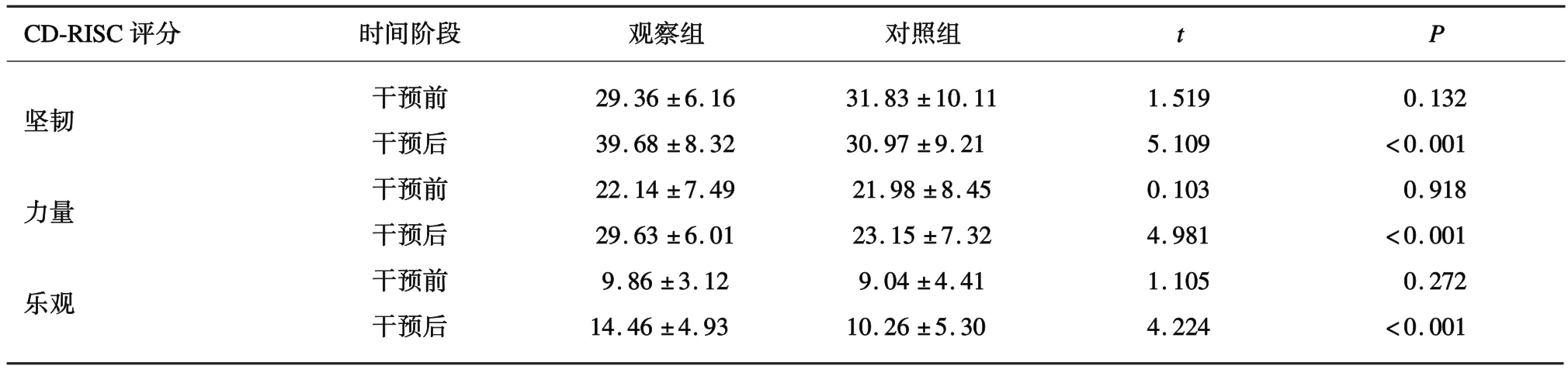
表5 2 组患者CD-RISC 评分比较(±s,分)
_CD-RISC 评分 时间阶段 观察组 对照组 t P坚韧 干预前 29.36 ±6.16 31.83 ±10.11 1.519 0.132干预后 39.68 ±8.32 30.97 ±9.21 5.109<0.001力量 干预前 22.14 ±7.49 21.98 ±8.45 0.103 0.918干预后 29.63 ±6.01 23.15 ±7.32 4.981<0.001乐观 干预前 9.86 ±3.12 9.04 ±4.41 1.105 0.272干预后 14.46 ±4.93 10.26 ±5.30 4.224<0.001
2.6 2 组患者HPLP-II 评分比较干预前,2 组患者HPLP-II 评分差异无统计学意义(P=0.773);干预后,观察组患者HPLP-II 评分高于对照组(P<0.001)。见表6。
表6 2 组患者HPLP-II 评分比较(±s,分)

表6 2 组患者HPLP-II 评分比较(±s,分)
_HPLP-II 评分 观察组 对照组 t P干预前 126.45 ±31.81 124.73 ±29.50 0.289 0.773干预后 186.93 ±25.57 132.21 ±26.41 10.061<0.001
2.7 2 组患者并发症发生率比较观察组中营养不良患者比例低于对照组(P=0.012)。2 组患者在便秘、血小板减少、恶心及呕吐、骨折等并发症发生率上差异均无统计学意义(P>0.05)。见表7。

表7 2 组患者并发症发生情况比较[例(%)]
3 讨论
本研究将有氧运动和力量抵抗训练结合在1 个基于家庭的个性化运动计划中,研究结果发现,家庭支持个体化运动可以改善老年骨髓瘤患者睡眠质量,延长患者夜间睡眠时间,改善患者情绪状态,提高患者韧性,以及促进患者健康行为。家庭支持个体化运动还可以减少患者营养不良以及恶心、呕吐等并发症的发生率。但是,家庭支持个体化运动并未改善患者的疲劳症状,但也未加重患者的疲劳症状。
既往的一些研究与本实验结果相符,建议将锻炼作为对肿瘤患者疲劳症状的干预。1 项系统综述与荟萃分析[12]表明,治疗后锻炼可以使肿瘤患者受益。但这些以锻炼为中心的干预措施因持续时间、类型、强度和频率不同导致效果各异,没有特定的干预措施显示出更加优越的效果。锻炼的地点和监督也各不相同,但与非监督计划相比,基于家庭的锻炼产生更显著的结果。也有研究[13]以患者自我感觉和12 min 步行时间作为评价指标,癌症治疗期间的锻炼可以使患者获益。有研究[14]指出,在年龄<65 岁的骨髓瘤患者中,运动可以显著提高干细胞收集效率,减少干细胞收集时间,提高自体造血干细胞移植成功率。有研究指出,参加运动的患者可以将血红蛋白和血小板计数维持在良好的水平。运动可以减少患者输注红细胞的需求,减少患者输注血小板的需求。Coleman 等[15]研究指出,运动结合促红细胞生成剂治疗贫血,有助于控制贫血,可能会减少输血需求,甚至改善干细胞收集,从而减轻患者的治疗负担。有研究指出,运动治疗可以改善肿瘤患者的免疫微环境,延缓肿瘤进展,延长患者生存期。
需要特别指出的是,锻炼计划的制定必须因人而异,充分考虑患者的个体差异,特别在患者的疾病阶段、是否有骨损伤以及基础疾病等方面。本研究给对照组患者给予常规运动指导,要求患者每周至少进行3 次步行锻炼,步行时间为20 min。对于观察组而言,运动分为有氧运动和耐力运动。有氧训练强度为有氧步行的水平允许患者达到最大心率的65%~80%。力量耐力训练的强度为一次最大重复重量的60%~80%。每次运动时间不少于20 min,运动频率不少于每周3 次。运动干预的全部过程,从制定计划到运动完成后评估以及反馈,都需要专业意见的指导和监督。患者的运动强度、运动频率和时间可以根据患者情况调整。运动计划制定和运动情况反馈可以形成闭合循环,从而实现运动方案的不断调整,提高患者的适应性和运动积极性。除此之外,家庭支持和鼓励是患者坚持运动的重要有利因素。有研究指出,在正式或有组织的运动干预结束后,可能会阻止患者继续锻炼的因素包括疲劳、非条件性疾病、副作用或治疗预防措施(手术、放疗、化疗)、缺乏自信和缺乏动力[3]。患者需要被鼓励以及获得正向反馈。提倡积极的运动态度,提供减少运动障碍的教育,并让患者参与选择适当的运动类型和运动量,可能会使患者更愿意坚持和获得更好的结果[16]。
本研究针对年龄超过65 岁的老年患者,全面评估了家庭支持的个体化运动对疾病影响。本研究证实,患者可以通过运动干预,获得心理和生理方面的益处。运动干预未对患者的疲劳感产生显著的影响。本研究存在一些不足之处。第一,观察指标存在局限性,需要纳入更多的观察指标;第二,由于样本量较小,本研究没有结合病理分期和临床治疗阶段进行分析。运动干预可能会对不同病理分期或接受不同方式治疗的老年患者产生不同影响。在后续的研究中,应该进行更加细致的分组,获得更加具有临床指导意义的结论。第三,本研究的观察指标,包括睡眠时间和心理状态的影响因素可能较多。在干预前,本研究比较了2 组患者的观察指标差异,虽然差异没有统计学意义,但是没有能够直接排除混杂因素,可能对结果造成一定影响。
综上所述,本研究认为,家庭支持的个体化运动可以改善老年多发性骨髓瘤患者睡眠质量,延长患者夜间睡眠时间,改善患者情绪状态,提高患者韧性,减少并发症发生率,具有一定的临床应用价值。

