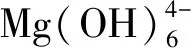柠檬酸酸浸轻烧镁粉制备超细氢氧化镁
朱益斌,王余莲,王 营,王琪浩,张 俊,刘珈伊,时天骄,邓 凤,李纪勋,苏德生,池 云
(1.沈阳理工大学 材料科学与工程学院,沈阳 110159; 2.福州大学 紫金地质与矿业学院,福州 350108;3.辽宁省超高功率石墨电极材料专业技术创新中心,辽宁 丹东 118123; 4.中共辽宁省委党校,沈阳110004)
氢氧化镁是一种重要的无机化合物,因其具有无毒无害、良好的热稳定性、阻燃性和化学吸附性等优良特性,常被用作阻燃剂[1]、除硫剂[2]、抗菌剂以及水处理剂[3-5]等。
氢氧化镁的制备一直是无机材料领域研究的热点,目前已报道的氢氧化镁主要有球状[6]、片状[7]、棒状[8]等形貌。李玉才[9]将MgCl2·6H2O与NaOH和NaCl的混合物进行研磨,制备出粒径在15~18nm的六方片状氢氧化镁。韩海波等[10]以天然卤水为原料,以石灰乳作为沉淀剂,制得粒径在80nm左右的纳米片状氢氧化镁,且放大实验结果与实验室结果基本一致。Pilarska A等[11]以MgSO4和NaOH为原料、聚乙二醇为改性剂,采用直接沉淀法制备出直径为28nm的片状氢氧化镁。Wang P P等[12]以MgCl2和5%氨水为原料,以聚乙二醇为分散剂,在不同反应条件下制备出直径为30nm、长度为700nm的针状氢氧化镁和直径为100nm、厚度为26nm的不规则片状氢氧化镁。黄建翠等[13]以菱镁矿为原料,通过煅烧-水化-煅烧-水热的合成路线,制备了直径为300~400nm、高度为40~60nm,粒径均匀、晶体形貌完整且分散性良好的六角形纳米氢氧化镁,并探究了不同改性剂对氢氧化镁结晶度以及分散性的影响。路绍琰等[14]以MgCl2·6H2O为镁源、氨水为沉淀剂,采用水热法制备了六方片状以及玫瑰花球状纳米氢氧化镁。Jarosinski A等[15]将NaOH溶液以恒定流速加至MgSO4溶液中,制备了纯度高达99.9%、比表面积为115m2/g的纳米级氢氧化镁。Ghanbari D等[16]在Mg(NO3)2中加入乙烯二胺和水合肼,经沉淀、分离和洗涤后制得厚度约为30nm的花状氢氧化镁。Kumari L等[17]以Mg(NO3)2·6H2O和NaOH为原料,制得厚度为40nm的片状氢氧化镁。Hahn R等[18]将金属镁在含氯离子的水溶液中进行高压阳极氧化,并利用NaOH调节溶液pH值至13,在电极表面形成长度达20μm的氢氧化镁晶须沉淀。
目前国内外制备纳米氢氧化镁大多以分析纯化学试剂为原料,成本较高,难以实现大批量连续生产,且多采用硫酸或盐酸等强酸酸浸含镁矿物获得镁源[19],存在副产物难以有效处理、污染环境等问题。柠檬酸无毒、溶解性好、衍生性能优异,是一种较强的三元有机酸[20],易于和Mg2+、Cu2+、Fe3+结合形成可溶性盐[21]。我国镁矿资源丰富,可为氢氧化镁等镁系化合物生产提供充足的原材料[22]。
本文以轻烧镁粉为原料,采用柠檬酸酸浸,并以浸出液为镁源,利用液相沉淀法制备超细氢氧化镁,探讨柠檬酸浓度、固液比、酸浸温度以及酸浸时间对氧化镁浸出率的影响,以及碱性溶液种类、反应时间、反应温度、添加剂种类和分散剂种类对氢氧化镁粒径的影响,并初步分析氢氧化镁生长机理。本文采用的工艺具有环境友好、成本低廉等优势,对于促进我国菱镁矿资源高效高值利用具有重要意义。
1 实验部分
1.1 实验原料与试剂
轻烧镁粉(MgO),质量分数81.95%,邢台市众垚化工有限公司;柠檬酸,分析纯,天津市北辰方正试剂厂;无水氯化镁、氨水、氢氧化钠(NaOH),均为分析纯,天津市大茂化学试剂厂;硬脂酸钠,分析纯,天津市福晨化学试剂厂;十二烷基苯磺酸钠(SDBS),分析纯,天津市鼎盛化工有限公司;聚乙二醇(PEG)2000、六偏磷酸钠,分析纯,国药集团化学试剂有限公司;蒸馏水,自制。
1.2 柠檬酸镁溶液的制备
称取适量轻烧镁粉与柠檬酸溶液(质量分数3%~10%)按不同固液比(MgO质量与柠檬酸体积之比)均匀混合;将所得混合溶液于40~80℃水浴中搅拌30~120min进行反应;反应结束后,抽滤,制得柠檬酸镁溶液。
1.3 超细氢氧化镁的制备
量取一定体积的柠檬酸镁溶液置于烧杯中,向溶液中滴加沉淀剂氨水(浓度1mol/L)或NaOH 溶液(浓度1mol/L),并加入一定量的添加剂以及分散剂,搅拌使其充分混合;将上述混合溶液置于40~90℃水浴中搅拌反应10~90min,待反应结束后,陈化12h;经抽滤、洗涤,将所得滤饼置于60℃恒温干燥箱中烘干,得到白色粉末,即为超细氢氧化镁。
1.4 样品表征
利用马尔文JS90激光粒度仪对所得氢氧化镁粉体进行粒度分析;采用日本理学Ultima Ⅳ型X射线衍射仪(XRD)对样品的物相结构进行检测;采用日立公司SN-3400型扫描电子显微镜(SEM)观察产物形貌;利用德国耐驰公司STA449F3Jupiter®同步TG-DSC热分析仪分析产物的热分解过程。
氧化镁浸出率计算公式为
(1)
式中:α为浸出率,%;M为轻烧镁粉质量,g;M1为反应后固体残渣质量,g。
2 结果与讨论
2.1 柠檬酸酸浸轻烧镁粉制备柠檬酸镁溶液的研究
2.1.1 柠檬酸浓度对浸出率的影响
固定固液比为1∶40(MgO质量单位为g;柠檬酸体积单位为mL)、酸浸时间为60min、酸浸温度为60℃,研究不同柠檬酸浓度(质量分数)对浸出率的影响,结果如图1所示。
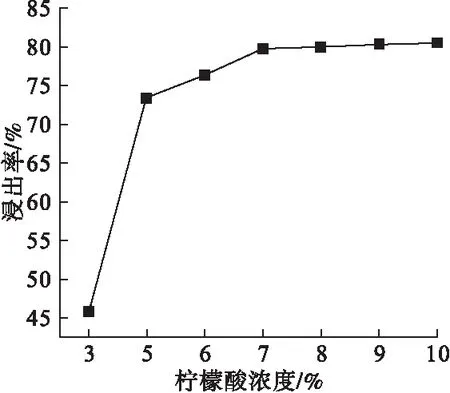
图1 柠檬酸浓度对浸出率的影响
由图1可见,浸出率随柠檬酸浓度升高而增大,柠檬酸浓度超过7%后,浸出率增长速度显著减缓。这是由于柠檬酸浓度越高,有更多的酸和氧化镁反应生成柠檬酸镁,剩余固体减少,所以浸出率持续升高;柠檬酸浓度大于7%,氧化镁基本反应完全,几乎不再生成柠檬酸镁,故浸出率增加很少。因此,最适宜的柠檬酸浓度为7%,此时浸出率达到79.8%。
2.1.2 固液比对浸出率的影响
固定酸浸时间为60min、酸浸温度为50℃、柠檬酸浓度为7%,考察不同固液比对浸出率的影响,结果见图2所示。
由图2可见,浸出率随固液比减小而升高。固液比为1∶40时,浸出率达80.4%,此后固液比继续减小,浸出率增长变缓。这是由于固液比减小,有足够的酸与氧化镁反应生成柠檬酸镁,剩余固体减少,浸出率升高。固液比过小时,会使轻烧镁粉中其余杂质被溶解。因此,适宜固液比为1∶40。
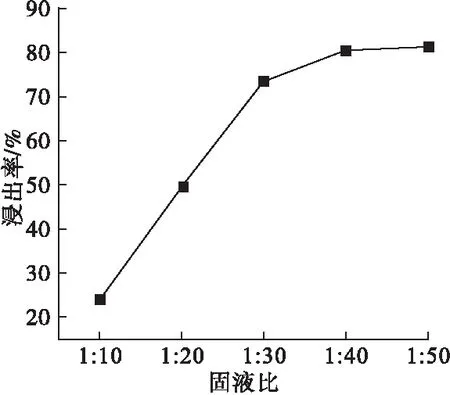
图2 固液比对浸出率的影响
2.1.3 酸浸温度对浸出率的影响
取柠檬酸镁浓度为7%、固液比为1∶40,其他条件不变,探究不同酸浸温度对浸出率的影响,结果如图3所示。
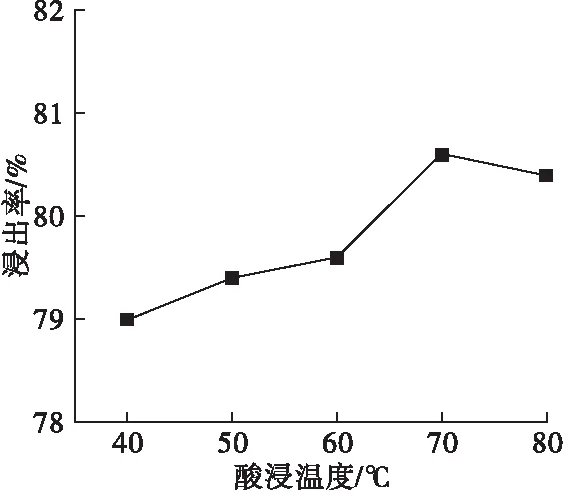
图3 酸浸温度对浸出率的影响
由图3可见,浸出率随着温度升高出现先升高后降低的趋势,70℃时达到最大值80.6%。由于温度低时,柠檬酸活性低,整体反应不完全;随着温度升高,柠檬酸和氧化镁活性均得到提高,且柠檬酸根离子与Mg2+有着较强的络合能力,可以更快生成柠檬酸镁。70℃之后,浸出率有微弱下降,可能是由于柠檬酸镁水解吸热,导致溶解度下降,浸出率减小。因此,选择酸浸温度为70℃。
2.1.4 酸浸时间对浸出率的影响
取酸浸温度为70℃、柠檬酸浓度为7%、固液比为1∶40,探究反应时间对浸出率的影响,结果如图4所示。
由图4可见,浸出率随酸浸时间的延长而增加,在60min时达到80.6%,此后随着时间继续延长,浸出率变化不大。这是由于柠檬酸酸性相对较弱,需要一定时间才能反应完全,之后继续延长反应时间,浸出率变化不大。考虑能耗等因素,选择60min为适宜反应时间。
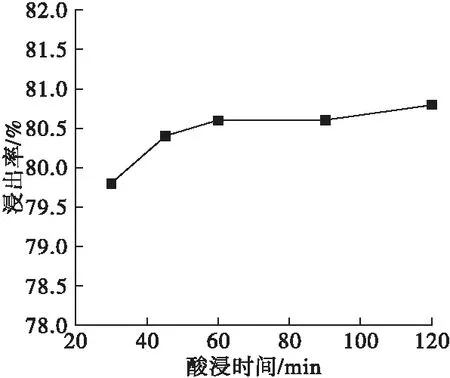
图4 酸浸时间对浸出率的影响
综合上述结果,柠檬酸酸浸轻烧氧化镁粉制备柠檬酸镁溶液的适宜条件为:柠檬酸浓度7%、固液比1∶40、反应温度70℃、酸浸时间60min,此时浸出率最大,为80.60%,浸出液为柠檬酸镁溶液,以此为镁源制备氢氧化镁。
2.2 柠檬酸镁制备超细氢氧化镁的研究
2.2.1 碱性溶液对氢氧化镁粒径的影响
固定反应时间为50min、反应温度为60℃、添加剂为氯化镁、分散剂为PEG,分别以氨水和NaOH溶液为沉淀剂,制备得到超细氢氧化镁,测其粒径,结果如表1所示。

表1 不同沉淀剂对氢氧化镁粒径的影响
由表1可知,采用氨水为沉淀剂时产物粒径为1.874μm,粒径相对较大,但过滤容易。采用NaOH 溶液作为沉淀剂,所得产物粒径相对较小,为0.985μm,但过滤较困难。这是由于氨水易分解为水和氨气,加剧了反应体系的对流强度,提高反应体系的分散性,利于晶体生长,故粒径较大;NaOH为强碱,与Mg2+反应速度较快,生成产物粒径较小,且产物的形貌、粒径分布和晶体结构都易于控制,适合制备超微氢氧化镁。因此,沉淀剂选择NaOH溶液。
2.2.2 添加剂种类对氢氧化镁粒径的影响
以NaOH溶液为沉淀剂,其他条件不变,采用不同添加剂制备氢氧化镁,测其粒径,结果如表2所示。
由表2可见,添加剂为氯化镁时,产物粒径最小,为1.265μm,采用其他添加剂所得产物粒径较大。这是由于氯化镁的加入使Mg2+浓度增大,氢氧化镁成核速率加快,生长基元来不及在晶格内排列,故产物粒径相对较小。添加剂为乙醇时,乙醇可能吸附在氢氧化镁表面,颗粒通过氢键形成连续的团聚体,使得粒径增大,且自制柠檬酸镁溶液加入乙醇溶液后,会析出大量柠檬酸镁胶体,抑制氢氧化镁沉淀,降低产率。添加氯化钠时,增大了氢氧化镁溶解度,离子积大于该温度下的溶度积,成核速率快,晶核易于团聚,造成颗粒过大[23]。因此,选择氯化镁为适宜的添加剂。

表2 不同添加剂对氢氧化镁粒径的影响
2.2.3 反应温度对氢氧化镁粒径的影响
采用氯化镁为添加剂,NaOH溶液为沉淀剂,其他条件不变,采用不同反应温度制备氢氧化镁,测其粒径,结果如图5所示。
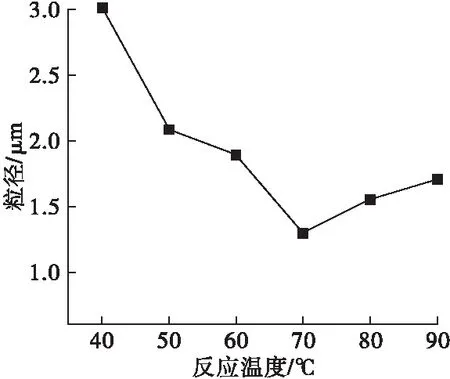
图5 反应温度对氢氧化镁粒径的影响
由图5可见,氢氧化镁粒径随温度升高先减小后增大,当温度达到70℃时,粒径达到最小值1.297μm。这是由于温度较低时,过饱和度大且溶液黏度较大,成核速率快,易于团聚,故粒度较大。随着温度升高,黏度降低且分子动能增加,改善团聚,粒径减小。继续升温,晶体生长速率提高,粒径再次增大。因此,选择沉淀反应温度为70℃。
2.2.4 反应时间对氢氧化镁粒径的影响
采用反应温度为70℃,氯化镁为添加剂,NaOH溶液为沉淀剂,其他条件不变,采用不同的沉淀时间制备氢氧化镁,测其粒径,结果如图6所示。
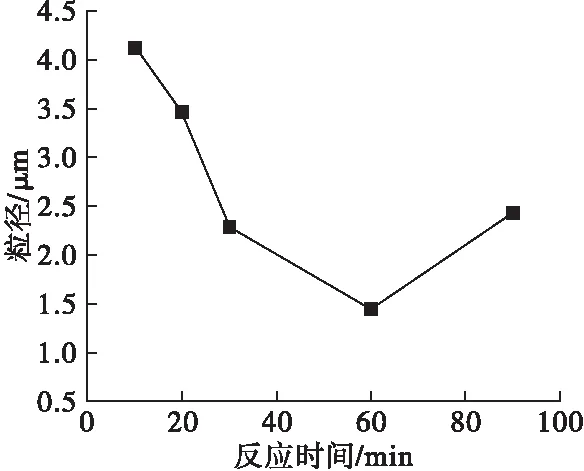
图6 反应时间对氢氧化镁粒径的影响
由图6可见,氢氧化镁粒径随反应时间的延长先减小后增大,反应时间为60min时粒径达到最小值1.449μm。这是由于反应初期,成核速率很快,瞬间产生大量晶核,氢氧化镁粉体极易团聚,导致粒度较高。随着时间延长,氢氧化镁晶粒获得更多能量,活性增大,小颗粒粉体从大颗粒粉体上脱离,抑制了团聚现象,因此产物粒径较小[24]。反应时间继续增加,晶体生长时间较长,导致晶粒过度生长,粒径变大。因此,适宜的反应时间为60min。
2.2.5 分散剂种类对氢氧化镁粒径的影响
采用反应时间为60min,反应温度为70℃,氯化镁为添加剂,NaOH溶液为沉淀剂,采用不同的分散剂制备氢氧化镁,测其粒径,结果如表3所示。
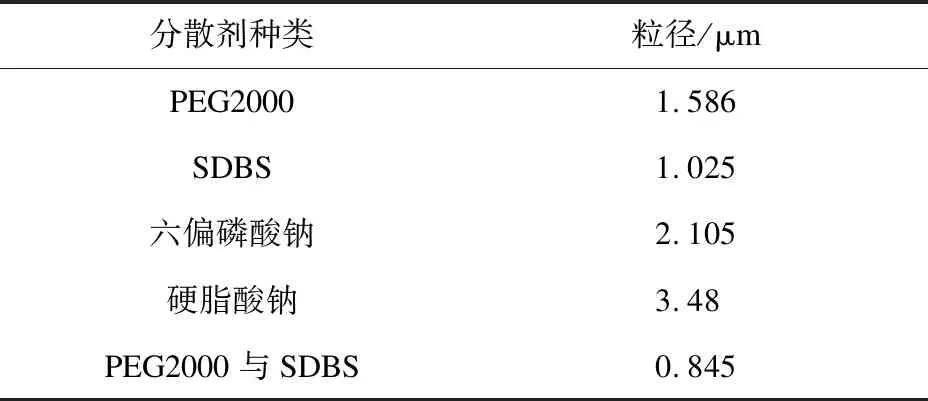
表3 不同分散剂对氢氧化镁粒径的影响
由表3可知,PEG和SDBS作为复合分散剂时效果较好,粒径最小,为0.845μm。这可能是由于PEG在溶液中稳定性高,与其他分散剂相容性好,且PEG和SDBS具有醚键和磺酸基两种亲水基,在氢氧化镁晶体表面形成保护膜,产生空间位阻效应,提高分散性,改善团聚[25]。六偏磷酸钠和硬脂酸钠分散效果差可能是由于水解的阴离子较少,吸附于颗粒表面的电荷少,斥力较小。因此,选择PEG和SDBS作为复合分散剂。
综上,以柠檬酸镁为镁源制备氢氧化镁的适宜条件为:NaOH溶液作为沉淀剂、氯化镁溶液作为添加剂、PEG和SDBS为复合分散剂、反应温度70℃、反应时间60min,此时制备得到的非晶态氢氧化镁粉体粒径最小,为845nm。
2.3 氢氧化镁显微结构
2.3.1 物相和形貌分析
以柠檬酸镁为镁源,在最佳实验条件下制备氢氧化镁,测试得到其XRD图谱和SEM图像如图7和图8所示。
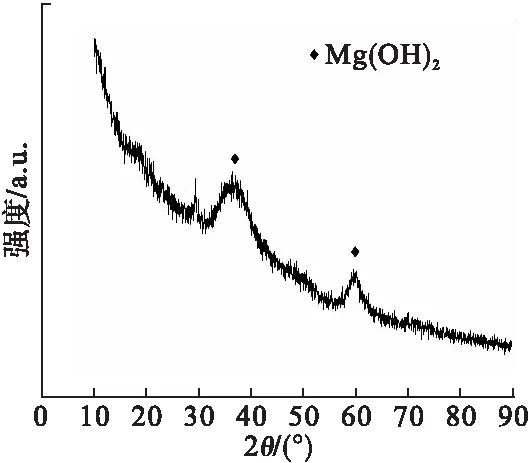
图7 氢氧化镁的XRD图谱
由图7可见,产物无明显特征峰,在衍射角为35°和60°左右出现弥散衍射峰,与标准卡片JCPDS44-1428一致,表明产物为非晶态氢氧化镁。

图8 氢氧化镁的SEM图像
由图8可见,所得产物为不规则块状氢氧化镁。造成该形貌的原因可能是Mg2+具有高度的水化能力,使得晶核表面存在大量结合水,生长单元无法突破该水膜,抑制了晶体生长。
2.3.2 TG-DSC分析
最佳实验条件下制备氢氧化镁的TG-DSC曲线测试结果如图9所示。
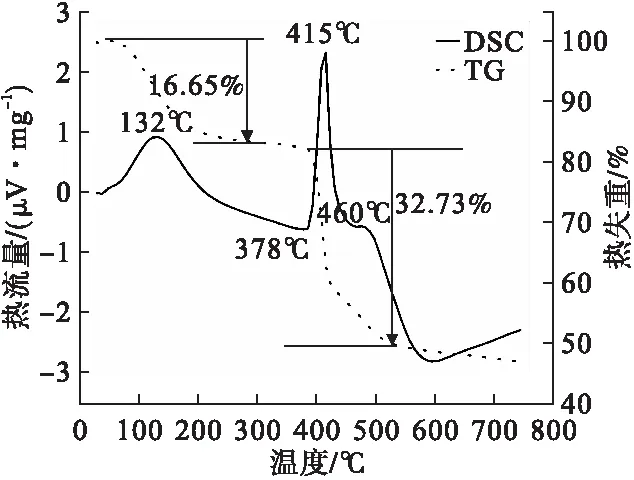
图9 氢氧化镁TG-DSC曲线图
由图9中TG曲线可见,氢氧化镁在42.2~279.7℃出现第一次失重,在385.9~542.7℃间出现第二次失重,产物总失重约为49%。其理论失重率为31.034%,实际失重率大于理论失重率,可能由于温度升高导致柠檬酸根分解,故失重率增加。由图9中DSC曲线可见,132℃处的吸热峰因氢氧化镁受热失去结晶水所致,415℃处吸热峰由于氢氧化镁受热分解为氧化镁和水所引起。样品开始分解温度较氢氧化镁理论分解温度(350℃)高,说明氢氧化镁热稳定性较好。
2.4 氢氧化镁的生长机理分析
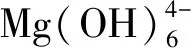
利用Diamond软件绘制氢氧化镁的晶体结构图,其形成过程如图10所示。
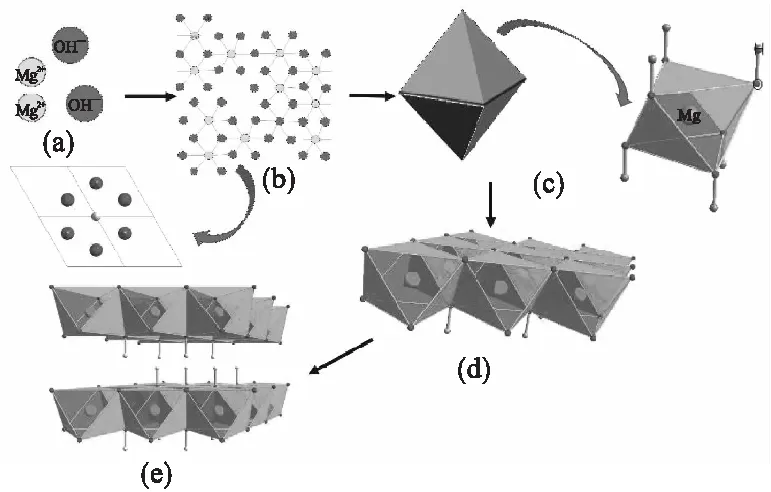
图10 氢氧化镁形成过程示意图

3 结论
(1)常压下柠檬酸酸浸氧化镁的适宜条件为:柠檬酸浓度7%、固液比1∶40、反应温度70℃、酸浸时间60min,此时浸出率为80.60%,浸出液为柠檬酸镁溶液。
(2)以自制柠檬酸镁作为镁源,采用液相沉淀法制备氢氧化镁的适宜条件为:以NaOH作为沉淀剂、反应温度70℃、反应时间60min、氯化镁溶液作为添加剂、PEG和SDBS为复合分散剂,制得非晶态氢氧化镁粉体粒径为845nm。