耐多药结核分枝杆菌对氨基糖苷类及多肽类药物交叉耐药相关基因突变特征分析
夏强,刘海灿,赵秀芹,万康林,赵丽丽
1.迪安医学检验中心,浙江 杭州 310012;2.中国疾病预防控制中心 传染病预防控制所/传染病预防控制国家重点实验室,北京 102206
WHO结核病治疗指南显示[1],耐多药结核(mutidrug resistant tuberculosis, MDR-TB)治疗需要18~20个月的药物疗程,一旦出现患者依从性较差、发生严重的药物不良反应等情况,疾病不能被彻底根治而再次复发或演变成广泛耐药性结核(extensive drug resistant tuberculosis, XDRTB),给社会和患者带来沉重的生理和心理负担。近年来,贝达喹啉、氯法齐明等口服新药在国外已经进入MDR-TB临床治疗指南用于耐药结核病的治疗,并取得良好的效果[2],但治疗费用普遍很高,在我国二线抗结核药物氨基糖苷类卡那霉素(kanamycin,KAN)及多肽类药物卷曲霉素(capreomycin, CAP)等注射剂由于价格便宜,临床医生拥有良好的使用经验,仍是治疗MDR-TB的重要药物[3]。研究显示[4],氨基糖苷类药物链霉素(streptomycin, SM)、KAN和多肽类药物CAP的抗菌机制相似,导致了这些药物存在交叉耐药性,但是交叉耐药的程度在不同地区的差异很大,是否与相关耐药基因协同发挥作用,需要进一步的研究来证实。本研究使用125株MDRTB临床分离株对SM、KAN、CAP相关耐药基因进行研究,探索三个药物耐药及交叉耐药之间的关系,有助于临床更合理地应用药物,为耐多药结核病的临床治疗提供理论依据。
1 材料和方法
1.1 菌株来源 本研究共使用125株MDR-TB菌株,均由中国疾病预防控制中心(Center for Disease Control and Prevention, CDC)传染病预防控制所结核病室传代培养、保藏,菌株来源详细信息见表1。结核分枝杆菌H37Rv标准株(ATCC27294)购自中国食品药品检定研究院,由CDC传染病预防控制所结核病室保藏。
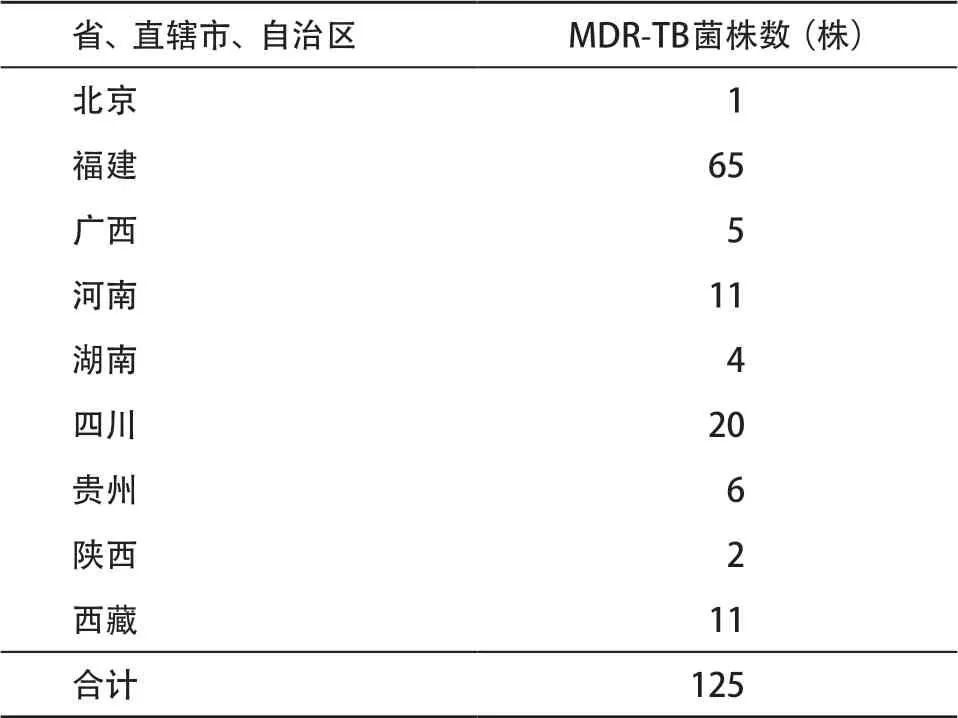
表1 125株结核分枝杆菌临床分离株的地区来源
1.2 药物敏感性检测 本研究菌株的药物敏感性检测,使用比例法在改良罗氏培养基上按照标准操作规程进行[5],以H37Rv标准株作为质控菌株,药物购于美国Sigma公司。耐药临界浓度参照文献[6]设置,SM为4 μg/mL,CAP为40 μg/mL,KAN为30 μg/mL。
1.3 分枝杆菌标准株和临床分离株DNA的制备 结核分枝杆菌的DNA提取采用CTAB法[7],用溶菌酶、10% SDS/蛋白酶K混合液及CTAB破除细胞壁,用氯仿萃取,冰乙醇洗涤DNA沉淀,最后用TE溶解DNA沉淀,-20 ℃保存。
1.4 基因扩增与测序 使用NCBI网站公布的结核分枝杆菌株的H37Rv全基因组序列(NC_000962)作为模板,对rrs、tlyA、eis启动子、rpsL设计引物,进行PCR扩增和测序引物,见表2。采用20 μL扩增体系,包括1×easytaq PCR Buffer,1.25 U easytaq DNA聚合酶,0.125 mmol/L dNTP,F、R各0.15 μmol/L,模板DNA 40~100 ng。反应条件,95 ℃预变性5 min,再用94 ℃变性30 s、58 ℃复性30 s和72 ℃延伸45 s,扩增35个循环。扩增产物送北京擎科兴业公司纯化后进行核酸序列测定,核酸序列比对使用Clustal W和Bio Edit等软件完成。

表2 基因PCR扩增和测序的引物
1.5 统计学处理方法 采用SPSS20.0软件进行数据分析。计数资料采用例(%)表示,组间差异用χ2检验比较。P<0.05为差异有统计学意义。
2 结果
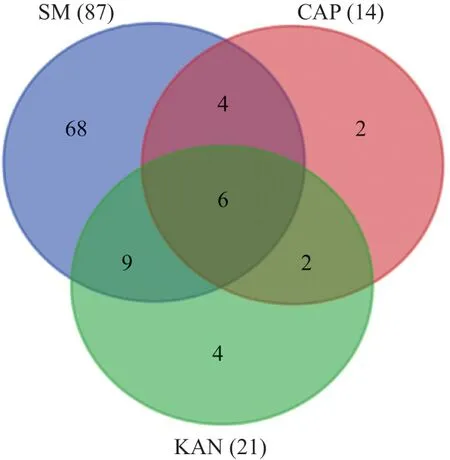
图1 MDR-TB临床分离株对3种药物交叉耐药性(株)
2.1 药物敏感性检测结果 125株MDR-TB菌株中,SM耐药株87例(占69.60%),CAP耐药株14例(占11.20%),KAN耐药株21例(占16.80%),SM耐药率显著高于CAP、KAN(χ2=88.53、65.54,均P<0.01),而CAP与KAN间耐药率差异无统计学意义(χ2=1.63,P=0.20)。有68例(占54.40%)菌株对SM单耐受,有2例(占2.00%)菌株对CAP单耐受,有4例(占3.20%)菌株对KAN单耐受,有9例(占7.20%)菌株对SM+KAN耐受,有4例(占3.2%)菌株对SM+CAP耐受,有2例(占2.00%)菌株对KAN+CAP耐受,有6例(占4.80%)菌株对本研究中的3种抗结核药物全部耐受,有30例(占24.00%)菌株对3种药全部敏感。KAN在SM耐药株中的耐药率为17.20%(15/87),KAN在CAP耐药株中的耐药率为57.14%(8/14);CAP在SM耐药株中的耐药率为11.49%(10/87),CAP在KAN耐药株中的耐药率为38.10%(8/21);SM在KAN耐药株中的耐药率为71.43%(15/21),SM在CAP耐药株中的耐药率为71.43%(10/14)。
2.3 耐药基因突变结果 通过测序后发现,68株单耐SM菌株中,有19例(占27.94%)菌株出现rpsL基因突变,128A-G(Lys43Arg)型突变为最主要的突变,共有14株;有6例(占8.82%)菌株出现rrs基因突变,类型分别为1401A-G、517C-T、48T-C、1141CT、635G-A、1449A-G。4株单耐KAN菌株中,有3例(占75.00%)菌株出现eis启动子突变,突变类型为2株G(-10)A突变和1株G(-14)A突变;有1例(占25.00%)菌株出现rrs基因1401A-G突变。2株CAP单耐菌株中,未发现基因突变。9株SM+KAN耐药菌株中,有6例(占66.66%)菌株出现rpsL突变,其中4株为128A-G突变,2株为263A-G突变;有2例(占22.22%)菌株出现rrs突变,分别为1株514A-C突变以及1株517C-T突变;有1例(占11.11%)菌株出现eis启动子突变,突变类型为(-10)A。4株SM+CAP耐药菌株中,有3例(75.00%)菌株出现rpsL突变,分别为2株128A-G突变、1株263A-G;rrs和eis启动子未出现突变。2株KAN+CAP耐药株中,有1例(占50.00%)菌株出现rrs突变,突变类型为1401AG;rpsL和eis启动子未出现突变。6株SM+KAN+CAP耐药菌株中,有3例(占50.00%)菌株出现rrs突变,其中2株为1401A-G基因突变,1株为rrs1401AG+rpsL128A-G突变;eis启动子未出现突变。30株SM+KAN+CAP敏感菌株中,1例(占3.33%)菌株出现rrs突变,突变类型为1057C-A;rpsL和eis启动子未出现突变。125株MDR-TB菌株中tlyA均发现33A-G突变,突变类型为同义突变,其中两株为33A-G+463CT、33A-G+54A-G类型双位点突变。见表3。

表3 SM、KAN及CAP相关耐药基因突变结果分析
2.4 3种注射类药物耐药与耐药基因突变间的关系 以表型耐药为金标准,rpsL检测SM+KAN联合耐药的灵敏度为46.67%,特异度为90.63%,rrs检测SM+KAN联合耐药的灵敏度为33.33%,特异度为96.88%;而rpsL检测KAN+CAP联合耐药的灵敏性仅有12.5%,特异度为80.61%,阳性预测值为5%;rrs检测KAN+CAP联合耐药的灵敏度为50%,特异度为92.86%。rrs检测SM+KAN+CAP联合耐药的灵敏度50%,特异度高达96.67%。SM+KAN耐药菌株和SM+KAN敏感菌株的rrs突变率比较,差异有统计学意义(χ2=8.369,P=0.002);SM+CAP耐药菌株和SM+CAP敏感菌株的rrs突变率比较,差异有统计学意义(χ2=4.462,P=0.010);KAN+CAP耐药菌株和KAN+CAP敏感菌株的rrs突变率比较,差异有统计学意义(χ2=14.61,P<0.001);SM+KAN+CAP耐药菌株和SM+KAN+CAP敏感菌株的rrs突变率比较,差异有统计学意义(χ2=11.03,P<0.001)。见表4。

表4 3种药物耐药与基因突变的关系
3 讨论
SM是治疗结核最重要的一线药物,而同为氨基糖苷类药物的KAN和CAP是临床治疗二线注射类药物,在MDR-TB标准短程化疗方案中作为主要的核心药物[3]。有研究显示[8],氨基糖苷类药物之间以及与多肽类药物之间耐药机制互有交叉,导致交叉耐药,分析两类药物的耐药、交叉耐药,及与分子耐药机制关系,有助于临床为结核病患者特别是MDRTB患者制定合理有效的化疗方案提供理论依据。
本研究中125株MDR-TB菌株中,三种药物耐药率依次为60.00%(SM),16.80%(KAN),11.20%(CAP),耐药率排位顺序与2010年我国结核病流行病学调查结果一致[9]。KAN在SM耐药株中的耐药率为17.20%,CAP在SM耐药株中耐药率为11.49%,SM在KAN耐药株中耐药率为71.43%,SM在CAP耐药株中耐药率为71.43%,据此可推断,SM与KAN、CAP二药之间存在着单向交叉耐药,这与我国学者常珊等[10]研究成果一致。本研究结果分析,CAP对MDR-TB菌株的耐药率与KAN的耐药率之间差异无统计学意义,KAN在CAP耐药株中的耐药率为57.1%,CAP在KAN耐药株中的耐药率为38.09%,说明KAN和CAP之间存在低水平交叉耐药,提示二者间一种药物发生耐药,应慎重选择另外一种药物。
目前研究认为,三种药物交叉耐药产生的原因是由于存在共同的基因突变位置。rpsL基因是结核分枝杆菌对SM耐药的分子机制[11]。本研究显示,87株SM耐药菌株中,共有33.33%(29/87)的菌株出现rpsL基因突变,其中Lys43Arg突变为21株,Lys88Arg型突变为7株,另外发现1株Arg381Cys突变,未见报道;在38株SM敏感株中,包括4株KAN单耐,2株CAP单耐,2株KAN+CAP耐药,30株SM+KAN+CAP敏感,未发现rpsL基因的突变。利用rpsL基因检测检测SM、KAN、CAP单耐药的灵敏度分别为33.33%、33.33%、28.57%,特异度分别为100%、78.85%、77.48%,阳性预测值分别为100%、24.14%、13.79%,而rpsL基因KAN+CAP联合耐药的灵敏度仅为12.5%,特异度为80.61%,阳性预测值仅为5%,说明在本研究中rpsL基因突变主要对SM耐药起到贡献,检测与KAN及CAP耐药能力较弱。
rrs基因编码16S rRNA,该基因530环状区域与rpsL第43位的赖氨酸在空间上非常接近,因此该区域基因位点突变与SM抗性有关,同时也是导致SM和KAN交叉耐药关键区域。本研究发现,87株SM耐药株中,共有12.64%的菌株出现rrs基因突变,单耐SM菌株中rrs突变呈多态性,530环状区域基因仅有1株516A-G突变,而在SM+KAN联合耐药的菌种,发现530环状区域标志性突变位点514A-C和517C-T突变各1株,在CAP耐药株中并未出现。有研究证实[12-13],rrs基因A1401G的突变位点与KAN、CAP耐药相关,而且也是它们交叉耐药的位点,A1401G位点检测KAN单耐药的敏感度和特异度分别为100%和98.1%;检测CAP单耐药的敏感度和特异度分别为93.3%、100%。本研究中,共发现6株rrs基因发生A1401G的突变,单耐SM和单耐KAN各1株,KAN+CAP联合耐药1株,SM+KAN+CPA联合耐药3株,而在单耐CAP菌株中并没有发现该位点突变。rrs基因A1401G连同514A-C和517C-T突变共同检测SM+KAN+CAP交叉耐药,灵敏度可以达到50%,提示该基因突变与三种药物交叉耐药具有关联,但存在部分表型耐药不能用现有突变位点解释的现象。
结核分枝杆菌中tlyA(Rv1694)的转座子突变导致CAP耐药[14]。tlyA基因编码一个2-O-甲基转移酶,在16S rRNA的44号螺旋和23S rRNA的69号螺旋中产生甲基化。当核糖体亚基形成复合物时,形成CAP的结合位点,抑制核糖体的转移,从而导致耐药。对于该基因突变报道不一,有研究显示tlyA基因的突变率过低,并不是敏感的CAP耐药检测指标[15],而我国学者报道[16],50株CAP临床耐药菌株中,有7株菌株发生了该基因突变,30株敏感菌株中未发现突变。本研究125株MDR-TB菌株中,均发现tlyA基因33A-G同义突变,另外在单耐SM菌株中各发现1株33A-G+463C-T和33A-G+54A-G突变株,对CAP耐药无任何贡献,因此该基因并不是CM耐药良好的检测指标,其基因突变与SM、KAN、CAP单耐及交叉耐药并无关联。
eis基因编码氨基糖苷类乙酰转移酶,该基因启动子发生突变可引起转录物水平增加,有研究证实[17],结核分枝杆菌中eis启动子G(-14)A突变被认为是检测KAN中低水平耐药的较好的靶点,G(-10)A突变与CAP对结核分枝杆菌耐药相关。本研究共发现4例eis启动子突变,全部出现在KAN耐药相关菌株中,其中单耐KAN3例,分别为1例G(-14)A和2例G(-10)A突变,SM+KAN联合耐药发现1例G(-10)A突变,并没有发现与eis启动子CAP耐药性相关证据。
本研究利用全国多个省(直辖市、自治区)来源的MDR-TB菌株,具有良好的代表性。通过对耐药相关基因区域测序分析,仅发现rrs基因的530环区域和1401位点突变对于与SM、KAN、CAP交叉耐药具有关联性,相关突变位点今后可能成为交叉耐药潜在分子筛查标志,后续本研究还需要通过扩大检测的样本量来进一步验证,用来发展结核分枝杆菌交叉耐药的快速检测方法。

