狼疮性肾炎患者24 h动态血压昼夜节律与肾脏损害的关系
俱博苗,王 沛,王 静,吕晓虹,胡 楠,罗 静,何 岚
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种累及多个器官的自身免疫性疾病[1]。研究显示SLE患者与健康人相比,高血压和心血管疾病风险增加[2-4]。遗传、环境、内分泌和代谢因素都会导致自身免疫性疾病的易感性,促进慢性炎症,导致血压改变[5]。自身抗体与自身免疫性疾病高血压的发生有关[6]。SLE患者高血压的发生在狼疮性肾炎(lupus nephritis, LN)患者中更为常见,SLE患者心血管疾病发生不仅与血压水平有关,还与血压昼夜节律相关[7]。在原发性高血压患者和健康人中,非杓型血压节律患者心肌梗死、中风和肾脏功能损害与杓型血压患者相比风险更高[8]。但目前缺乏LN患者血压昼夜节律和肾脏损伤的研究。该研究对103例LN患者行动态血压监测,旨在探讨血压昼夜节律与肾脏损伤的关系。
1 材料与方法
1.1 研究对象回顾性分析2016年2月至2019年6月在西安交通大学第一附属医院住院103例LN患者的临床资料。入选标准:① 符合1997年美国风湿病协会(American College of Rheumatology,ACR)修订的SLE分类标准[9];② 诊断为LN符合中国狼疮性肾炎诊断和治疗指南[10];③ 年龄18~65周岁,性别不限;④ 配合完成动态血压监测(ambulatory blood pressure monitoring,AMBP)检查。排除标准:① 恶性肿瘤或严重感染者;② 不愿配合获取临床资料者。中国狼疮性肾炎诊断和治疗指南为:SLE患者出现以下一项临床和实验室检查异常时,即可诊断为LN,包括: ① 蛋白尿持续>0.5 g/24 h,或随机尿检查尿蛋白+++,或尿蛋白/肌酐比>500 mg/g(50 mg/mmol);② 细胞管型包括红细胞管型、血红蛋白管型、颗粒管型、管状管型或混合管型;③ 活动性尿沉渣 (排除尿路感染,尿白细胞>5个/高倍视野(high power field, HPF),尿红细胞>5个/HPF,或红细胞管型,或白细胞管型。肾活检病理显示为免疫复合物介导的肾小球肾炎则进一步确定LN的诊断,并排除其他免疫性疾病及终末期肾病。根据患者夜间血压均值较白昼血压均值下降分为两组:杓型组(>10%)和非杓型组(<10%)。
1.2 方法
1.2.1一般资料 从患者病历中获得年龄、性别、病程、体质量指数(body mass index, BMI)等资料。
1.2.2动态血压测量 采用美国Spacelabs Medical Model NO190217A型无创伤性便携式动态血压监测仪行24 h动态血压监测。调定昼间每30 min、夜间(22:00至次日6:00)每60 min自测1次,患者于监测期间可进行正常的日常活动,并嘱在测试期间测试上臂保持相对静止状态。24 h后取下记录盒,记录全部有效数据。动态血压监测有效数据达80%以上。
1.2.3标本采集及实验室检查 患者入院后均禁食禁水8~10 h,于次日清晨采集空腹上肢静脉血,于西安交通大学第一附属医院检验科检测血清学指标,包括空腹总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、C反应蛋白(C-reactive protein, CRP)、红细胞沉降率(erythrocyte sedimentation rate, ESR)、血清尿酸、尿素、血清肌酐(serum creatinine, Scr),并计算肾小球滤过率水平。肾小球滤过率计算方式如下:肾小球滤过率eGFR[ml/(min·1.73 m2)]=186×Scr(mg/dl)-1.154×年龄(岁)-0.203×[0.742(女)]×[1.233(中国人)],1 mg/dl=88.41 μmol/L。
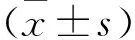
2 结果
2.1 LN患者一般资料本研究纳入103例LN患者,其中未合并高血压患者37例,合并高血压患者66例,见表1。
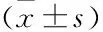
表1 103例LN患者的一般资料
2.2 LN患者高血压与肾脏损害指标的关系按患者是否合并高血压分为两组:高血压组66例,非高血压组37例。比较两组患者肾脏损伤指标表明,LN合并高血压组的血清肌酐(Z=-2.911,P=0.004)、尿素(Z=-3.348,P=0.001)和尿酸(t=2.017,P=0.047)水平均高于LN未合并高血压组患者;eGFR均低于LN未合并高血压组患者(Z=4.846,P<0.001);而24 h尿蛋白差异无统计学意义(Z=-5.757,P=0.566),见表2。
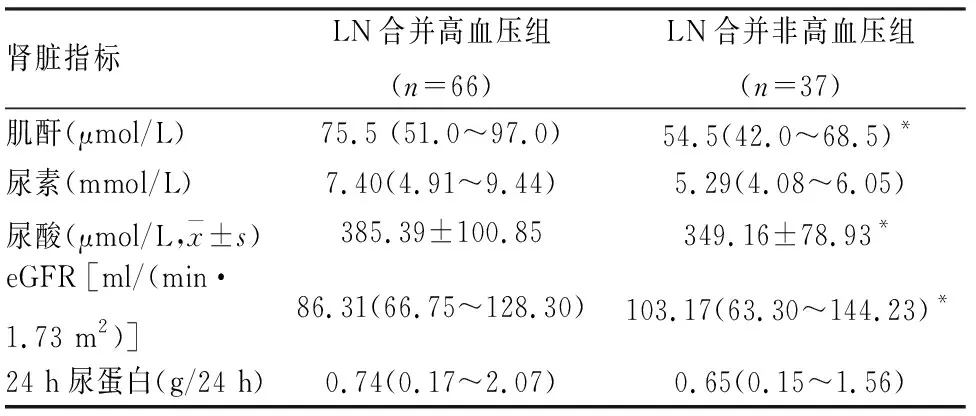
表2 LN患者肾脏损害指标的情况
2.3 LN患者血压节律情况LN合并高血压组中杓型血压组7例(10.6%),非杓型血压患者59例(89.4%);LN未合并高血压组中杓型血压组7例(18.9%),非杓型血压患者30例(81.1%),两组间血压节律异常比率差异无统计学意义(81.1%vs89.4%,χ2=1.395,P=0.238),见图1。

图1 患者血压节律分布情况
2.4 患者血压节律与肾脏损害指标的关系如表3所示,LN合并高血压杓型组尿酸低于LN合并高血压非杓型组患者(Z= -2.893,P=0.004), eGFR高于非杓型血压组患者(Z=2.017,P=0.044), 而肌酐(Z=-1.611,P=0.107)、尿素(Z=-1.505,P=0.132)和24 h尿蛋白(Z=-0.355,P=0.723)水平差异无统计学意义。
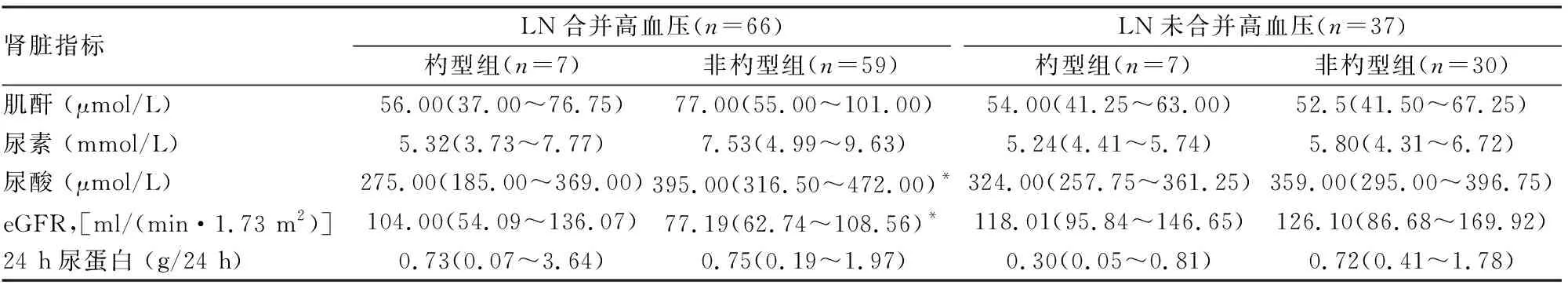
表3 LN患者血压节律与肾脏损害指标的关系
LN未合并高血压杓型组和LN未合并高血压非杓型组肌酐(Z=-0.012,P=0.99)、尿素(Z=-0.149,P=0.880)、尿酸(Z=-1.162,P=0.245)、eGFR(Z=0.037,P=0.971)和24 h尿蛋白(Z=-1.719,P=0.086)水平差异均无统计学意义。
2.5 LN合并高血压患者血压节律的影响因素分析如表4所示,单因素回归分析显示,尿酸、eGFR 与LN合并高血压患者昼夜血压节律异常相关,将上述指标纳入多因素回归分析,结果显示仅有尿酸与LN合并高血压节律异常相关。

表4 单因素和多因素回归分析LN合并高血压患者血压节律异常的危险因素
3 讨论
动态血压监测可以全面、客观、准确地反映24 h血压及其昼夜节律变化。健康人群24 h血压呈生理性昼夜节律变化,白昼血压升高,夜间血压下降,呈“两峰一谷”的“杓型曲线”,这种血压昼夜节律变化对适应机体活动和保护心血管结构和功能十分重要。目前未见有关LN患者血压节律异常与肾损伤的报道。
本研究显示103例LN患者中,非杓型血压节律占85.4%,Sabio et al[11]报道77例SLE患者中非杓型血压节律占62%,表明LN患者非杓型血压节律患者可能高于SLE患者。LN合并高血压组中,非杓型血压患者占89.4%,在LN未合并高血压组,非杓型血压患者占81.1%。推测LN患者无论是否合并高血压都可能存在血压节律的异常增高。本研究显示LN合并高血压组血清肌酐、尿素和尿酸水平均高于LN未合并高血压组患者,eGFR均低于LN未合并高血压组患者,表明LN合并高血压组的肾损伤程度高于未合并高血压患者。已有研究[12]显示SLE患者活动和非活动的LN中,肾小球滤过率和肾血浆流量都存在损伤,提示LN患者,尤其是LN合并高血压患者更需要注意肾损伤情况。
原发性高血压患者中,非杓型血压患者与杓型血压患者比较,早期肾损伤的指标均有异常改变,血压昼夜节律减弱与早期肾损害密切相关[13]。但目前LN患者血压节律与肾损害的关系未见报道。本研究显示LN合并高血压患者非杓型组的尿酸高于LN合并高血压患者杓型组,eGFR低于杓型血压组患者,提示LN合并高血压患者肾功能损害不仅与血压水平密切相关,还与血压的昼夜节律变化密切相关,昼夜节律异常的血压,可进一步加重肾功能损害。其原因可能与非杓型血压组患者夜间血压持续升高,使肾脏长期处于过负荷状态,从而促进肾脏损害的发生和发展有关[14-15]。本研究进一步通过单因素及多因素回归分析显示LN合并高血压患者尿酸水平是血压节律异常的独立危险因素,对于LN合并高血压患者应注意尿酸水平监测。Turak et al[16]研究报道,在原发性高血压患者中,多因素回归分析显示血清尿酸水平与非杓型血压存在独立的正相关。实验动物研究[17]也显示,血清尿酸升高可通过刺激氧化应激反应、损害内皮功能和刺激肾素血管紧张素系统诱发高血压。
本研究存在一定的局限性,包括该研究是横断面的研究,并且仅代表单一中心的研究结果。未跟踪LN合并高血压患者血压节律改变与尿酸水平变化之间关系。尽管已确定血清尿酸升高与非杓型血压之间存在显著关联,但无法确定这种关联的确切机制。应进行一项旨在降低血清尿酸水平的多中心前瞻性研究,以确定降低尿酸水平是否会改善夜间血压水平。

