炭角菌次生代谢产物及药理作用研究进展
胡琳珍,罗梦颖,肖雪洋,童周,胡萍,黄志勇
(1.药物高通量筛选技术国家地方联合工程研究中心,中药生物技术湖北省重点实验室,湖北大学生命科学学院,湖北 武汉 430062;2.中国科学院天津工业生物技术研究所,天津 300308)
0 引言
炭角菌属(Xylariasp.)真菌广泛分布于热带、亚热带和温带[1],多数腐生于烂木和蚁穴等物质中,少数寄生.其菌属物种丰富,有纵条纹炭角菌(Xylariastriata)、黑柄炭角菌(Xylarianigripes(Klotzsch) Sacc.)、球形炭角菌(Xylariasp. 808)和叉炭角菌(Xylariapedunculata)等300多个种,但其中研究得较多的是纵条纹炭角菌和黑柄炭角菌[2].纵条纹炭角菌是一类药用菌物,其活性化学成分主要是脂肪酸及其酯类、甾体类和细胞松弛素类化合物,具有抗肿瘤、抗菌、抗氧化和改善睡眠等生物活性.毒理实验显示其无毒性或毒性较低.纵条纹炭角菌的子实体已实现工厂化培养[3].黑柄炭角菌别名乌灵参,为该菌属开发较成熟的食药用菌,具有补气、安神和养血等功效;现代药理学研究发现黑柄炭角菌具有调节中枢神经系统、改善记忆力、提高血红蛋白含量和增强免疫力等功能.由黑柄炭角菌制成的乌灵胶囊已获批上市,目前已广泛应用于临床治疗[4].
炭角菌的次生代谢产物非常丰富,主要为细胞松弛素类[5]、萜类、酮类、甾醇类及内酯类等化合物.最近文献报道,从炭角菌属真菌中发现了具有多环结构的新型细胞松弛素类化合物、eremophilane型和drimane型的倍半萜以及多种骨架类型的二萜类化合物.研究表明,这些代谢产物大多具有抑菌、抗肿瘤、抗氧化及酶抑制等活性.本文中综述了近年来国内外有关炭角菌次生代谢产物和药理活性方面的研究现状,以期为炭角菌属真菌的资源开发和药物研发提供参考思路和理论依据.
1 次生代谢产物
1.1 细胞松弛素类化合物细胞松弛素(cytochalasans)是一类真菌来源的、聚酮-氨基酸杂合的次生代谢产物.早期研究发现细胞松弛素具有显著的抗菌和抗肿瘤的活性,一些细胞松弛素还具有抑制胆固醇合成、干扰糖转运和激素释放等作用.
近年来,从炭角菌里发现的细胞松弛素类化合物结构见图1,主要包括xylochalasin(1)[6]、xylariasins A~C(2~4)[7]、cytochalasin D(5)[8]、cytochalasin P1(6)[9]、curtachalasins A~Q(7~23)[10-13]、具有罕见的5/6/6/5/6五环骨架的xylastriasan A(24)[14]以及具有6/7/5/6/6多环结构的xylarichalasin A(25)[15].
1.2 萜类化合物萜类化合物多是异戊二烯的聚合体及其衍生物,其骨架一般以5个碳为基本单位,也有少数例外情况.其种类繁多,骨架庞杂,在自然界中分布广泛.萜类化合物大都具有多种生物活性,是挖掘具有药用价值先导化合物的重要资源.
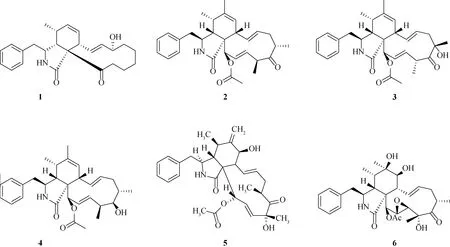
图1 炭角菌中细胞松弛素类化合物结构
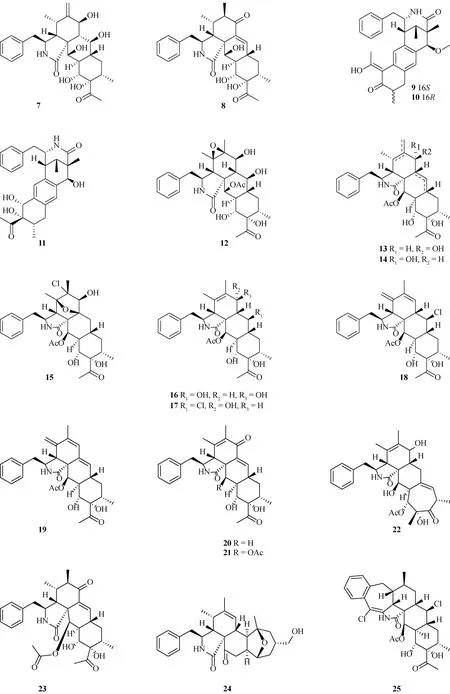
续图1 炭角菌中细胞松弛素类化合物结构
研究表明,炭角菌属真菌的次生代谢产物较多为萜类化合物,包括xylarinoriterpenes A~R(26~43)[16].化合物26~41具有18-或19-nor-isopimarane骨架,化合物42和43具有18,19-dinor-isopimarane骨架.近年来,文献报道从炭角菌中分离鉴定了具有双环[2.2.2]辛烷部分的二萜xylarilongipins A~B(44~45)[17]、eremophilane型倍半萜nigriterpenes A~F(46~51)[18]和相同骨架类型的13,13-dimethoxyintegric acid(52)[19]、drimane型倍半萜xylariaines A~C(53~55)[20]及相同骨架类型的polymorphines A~B(56~57)[21]以及isopimarane型二萜hypoxylonoids A~G(58~64)[22].化合物结构见图2.
1.3 酮类化合物从炭角菌中分离鉴定的酮类化合物主要为吡喃酮类和环己酮类化合物.吡喃酮类化合物包括xylaropyrones B~C(65~66)[23]以及xylaromanones A~C(67~69)[24].化合物结构见图3.环己酮类化合物包括(R)-4-hydroxy-2-ethyl-2-cyclohexen-1-one(70)[24]、4,8-dihydroxy-3,4-dihydronaphthalen-1(2H)(71)[25]以及xylarinaps A~E(72~76)[26].化合物结构见图4.
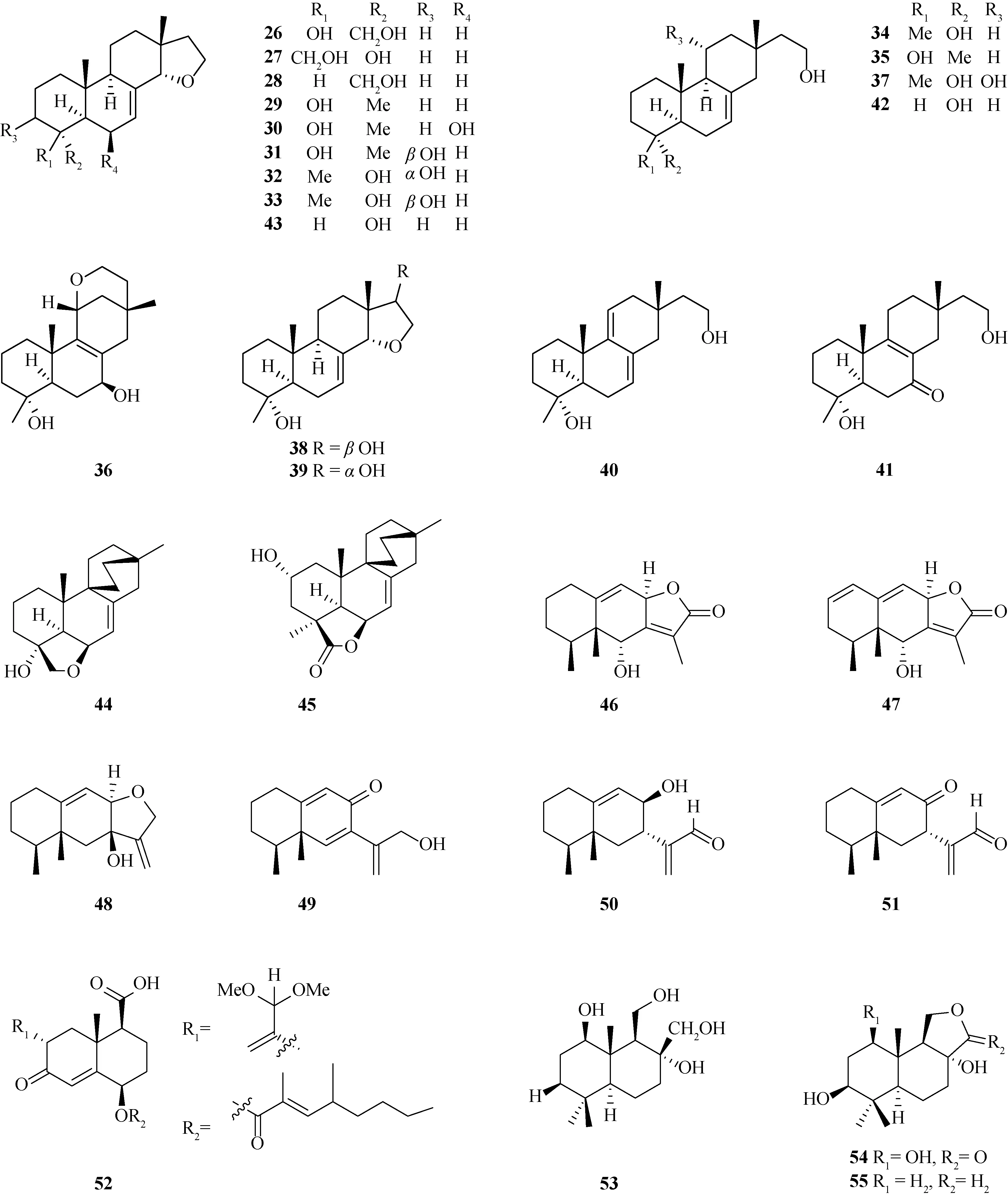
图2 炭角菌中萜类化合物结构
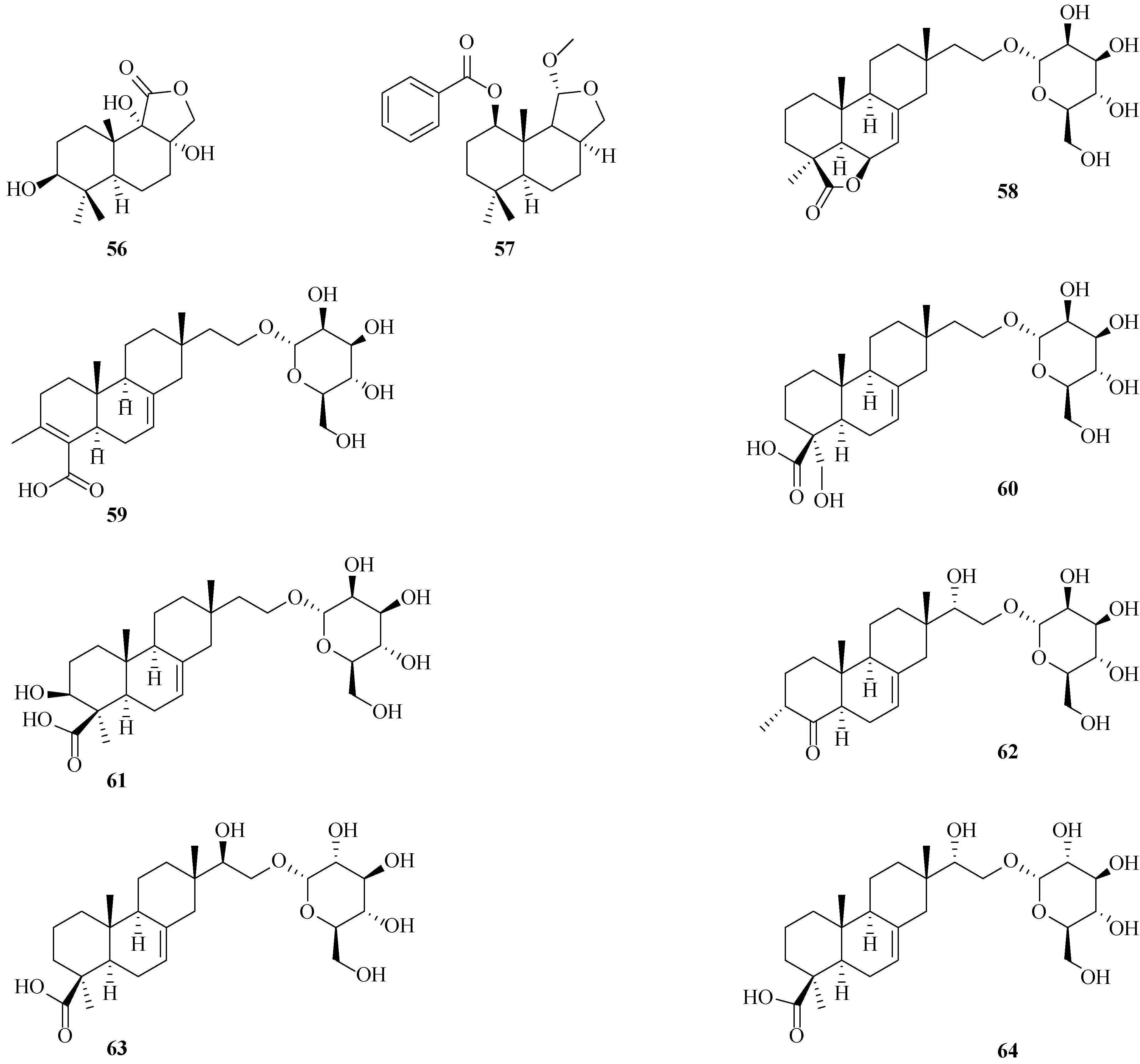
续图2 炭角菌中萜类化合物结构
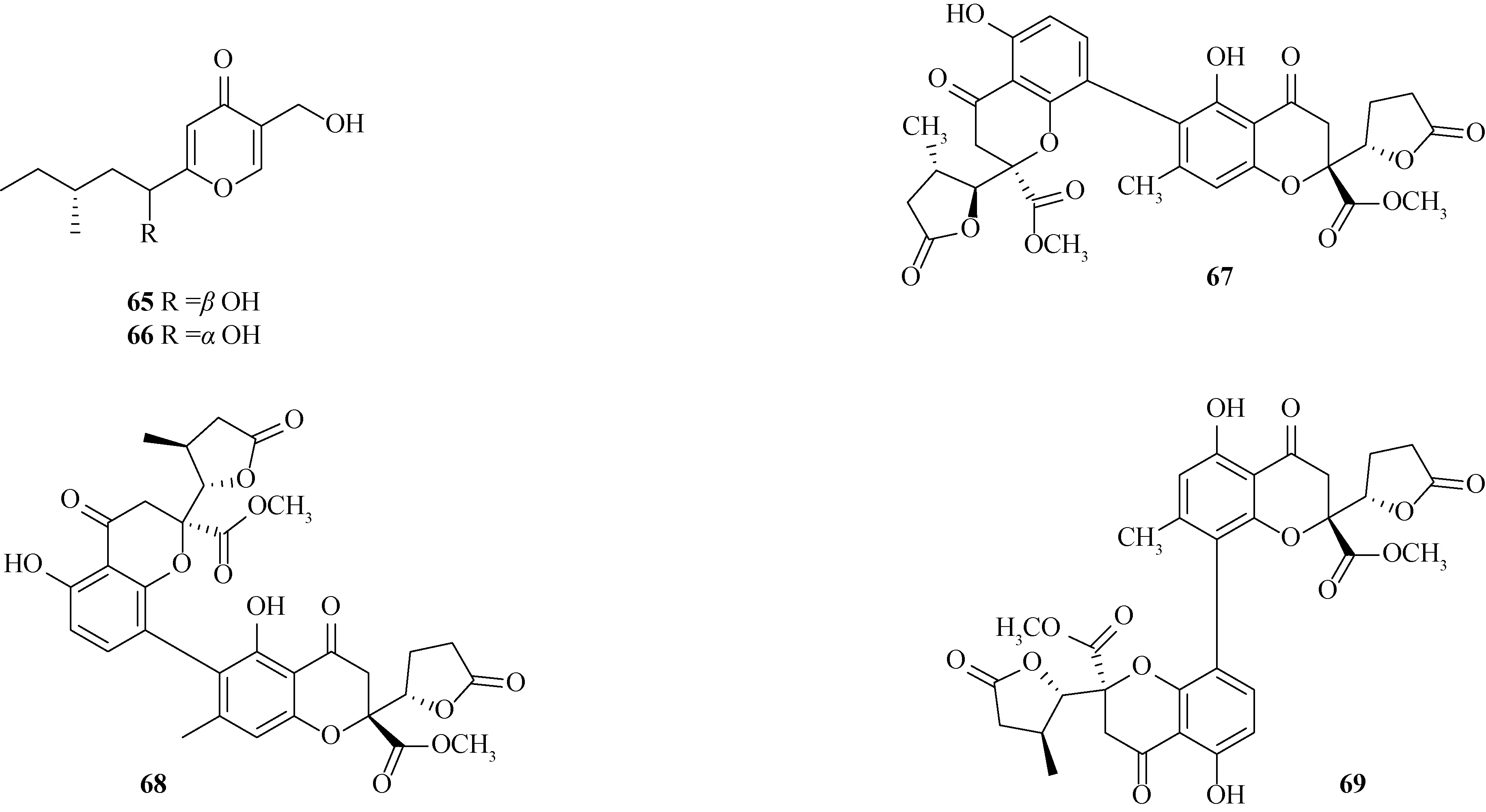
图3 炭角菌中吡喃酮类化合物结构
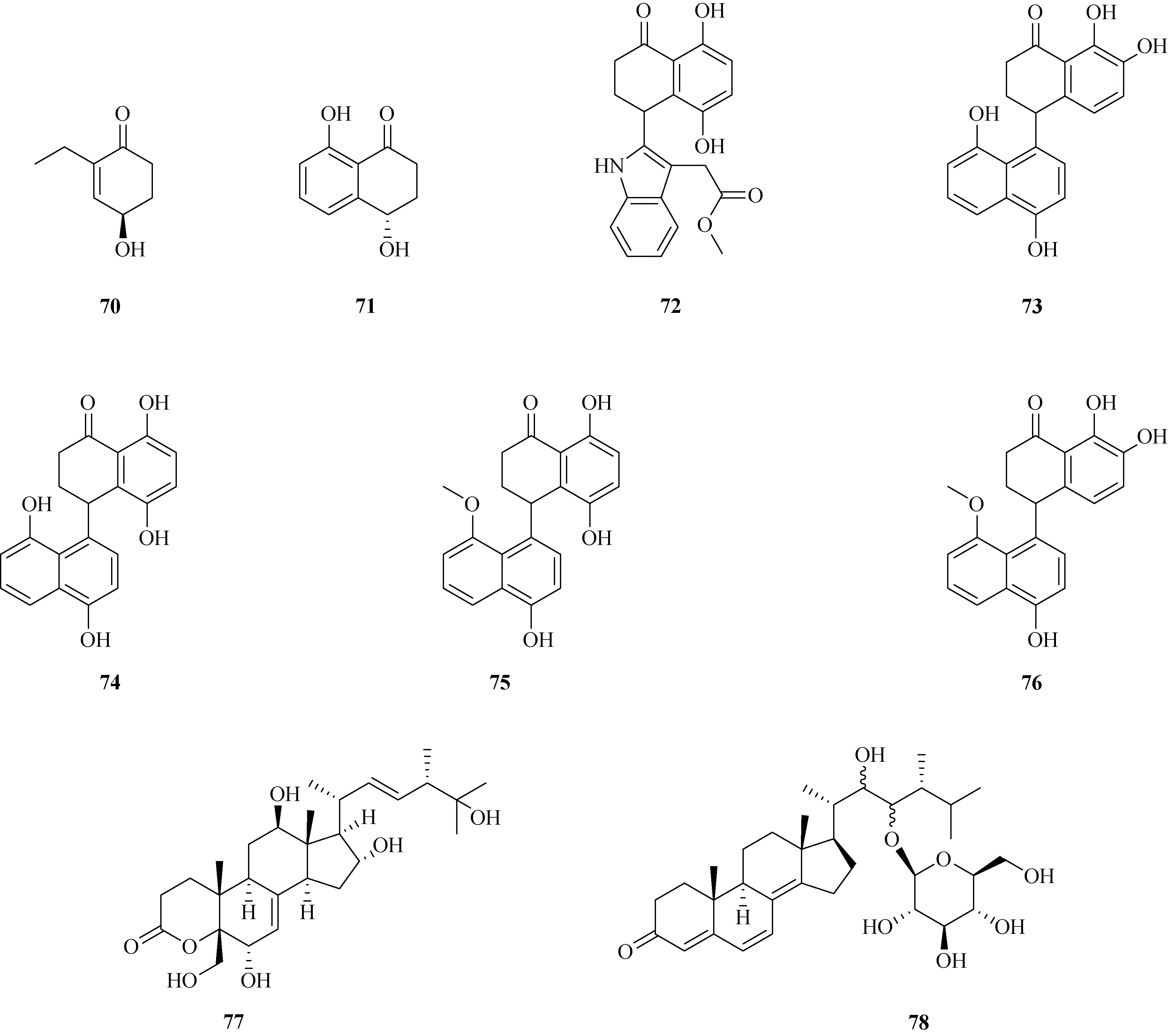
图4 炭角菌中环己酮类化合物结构
1.4 甾体类化合物甾体类化合物是以甾核(环戊烷多氢菲)为骨架的一类化合物,其与生物体的新陈代谢密切相关,故也是较常见的一类天然产物.目前,已从炭角菌属发现多种甾体类化合物,包括xylarester(77)[27]、(24R)-22,23-dihydroxy-ergosta-4,6,8(14)-trien-3-one 23-β-D-glucopyranoside(78)[27]、xyloneside A(79)[28]、具有较少见的在C-3和C-4位开环的麦角甾烷LD1(80)[29]以及3,4-seco-ergostane型甾体皂苷mannosylxylarinolide(81)[30].化合物结构见图5.
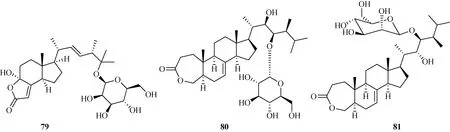
图5 炭角菌中甾体类化合物结构
1.5 内酯类化合物炭角菌属真菌中含有多种内酯类化合物,包括(3aS,6aR)-4,5-dimethyl-3,3a,6,6a-tetrahydro-2H-cyclopenta[b]furan-2-one(82)[31]、6-heptanoyl-4-methoxy-2H-pyran-2-one(83)[32]、annularin C(84)[33]、7-异色满羧酸(85)[29]、xylariamalin(86)[34]、xylarphthalide A(87)[35]、xylariahgins A~E(88~92)[36].化合物结构见图6.
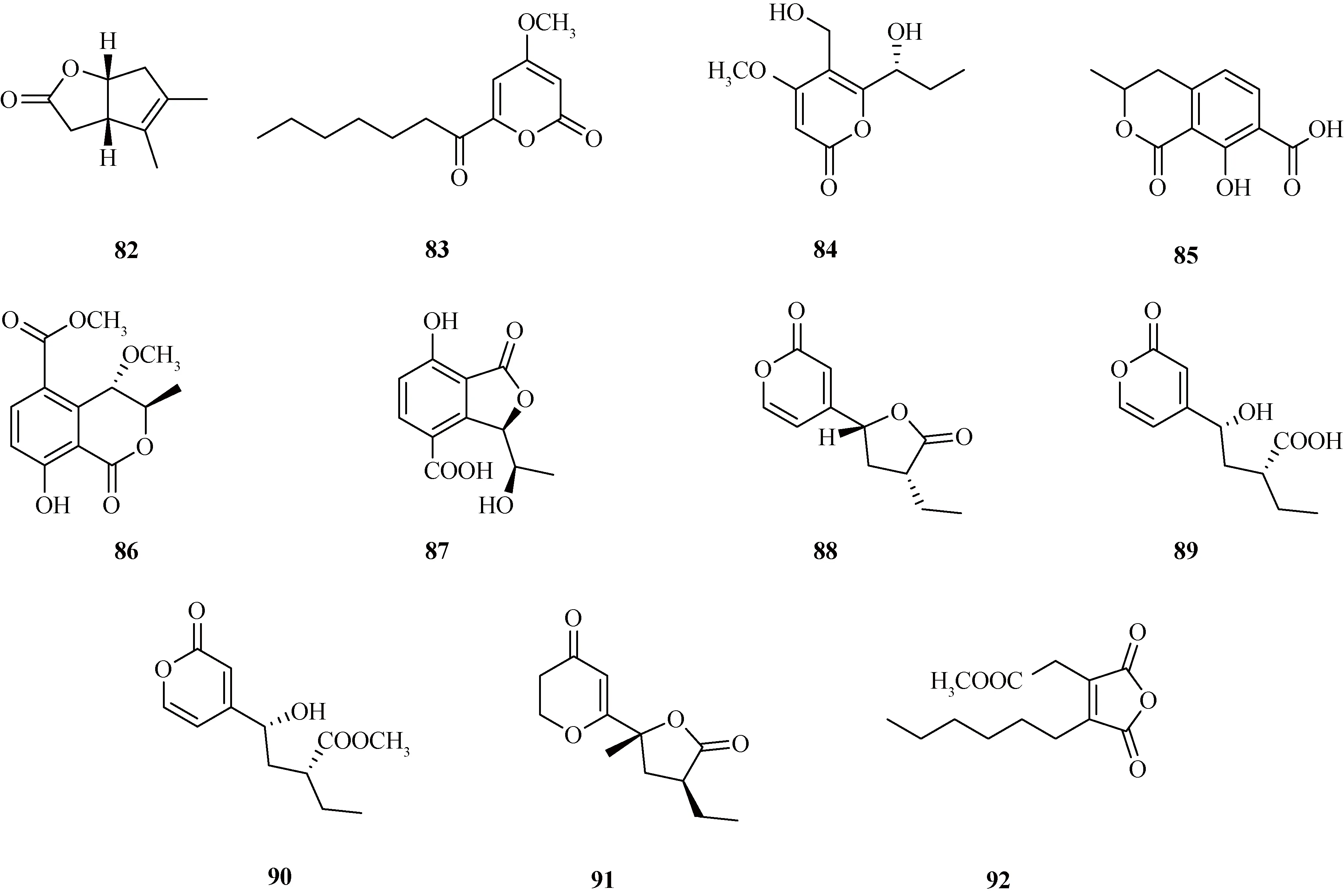
图6 炭角菌中内酯类化合物结构
1.6 其他类化合物从炭角菌中发现的其他类化合物包括有xylatriol(93)[37]、piliformic acid(94)[8]、hexacycloxylariolone(95)[37]、邻苯二甲酸二丁酯(96)[29]、2,5-diamino-N-(1-amino-1-imino-3-methylbutan-2-yl)pentanamide(97)[38]、xylariahgin F(98)[36]、(Z)-3-{(3-acetyl-2-hydroxyphenyl)diazenyl}-2,4-dihydroxybenzaldehyde(99)[39]、以及具有环五肽结构的LB4(100)[29]和pentaminolarin(101)[6].化合物结构见图7.
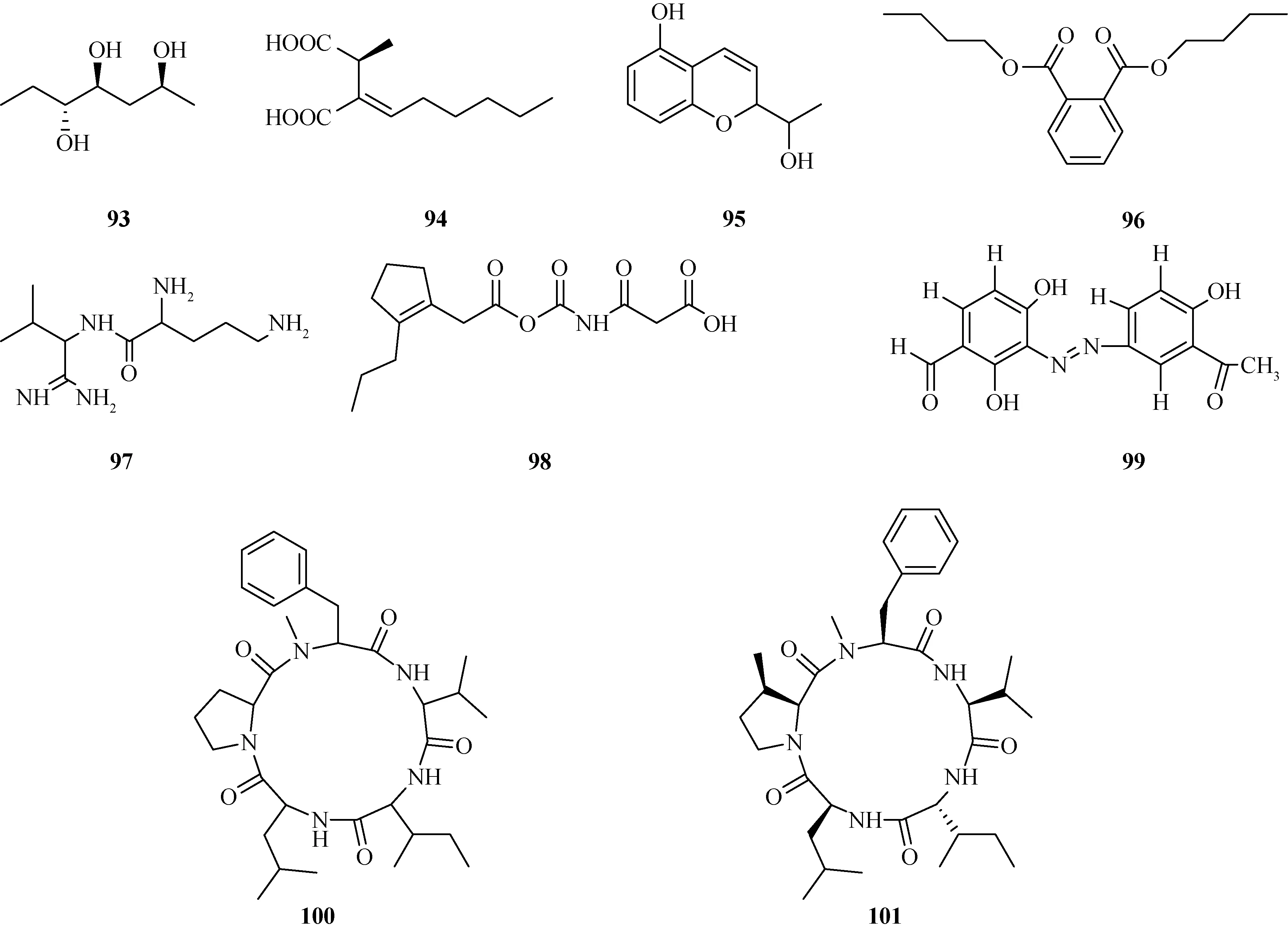
图7 炭角菌中其他类化合物结构
2 药理作用
2.1 抑菌活性从炭角菌中得到的多种类型的次生代谢产物如细胞松弛素类和内酯类化合物等,对真菌和细菌均有较好的抑制活性.Luciana等[8]从两株炭角菌Xylariasp. 249和Xylariasp. 214中分别得到羧酸类化合物piliformic acid(94)和细胞松弛素类化合物cytochalasin D(5),并利用纸片扩散法和肉汤微量稀释法测得这两个化合物对瓜拉纳炭疽病的病原真菌ColletotrichumGloeosporioides抑制率分别为51.33%和38.76%,最低抑菌浓度(MIC)分别为2.92和2.46 μmol/mL.Zheng等从Xylariasp. GDG-102中发现的两种内酯类化合物6-heptanoyl-4-methoxy-2H-pyran-2-one(83)[32]和xylarphthalide A(87)[35]对大肠杆菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus)均有抑制活性:前者对E.coli和S.aureus的MIC值均为50 μmol/mL,后者对E.coli的MIC值为25 μmol/mL,对S.aureus的MIC值为12.5 μmol/mL.此外,xylarphthalide A(87)还对枯草芽孢杆菌(Bacillussubtilis)具有较好的抑制作用,MIC值为2.5 μmol/mL;对巨型芽孢杆菌(Bacillusmegaterium)、副伤寒沙门氏菌(SalmonellaparatyphiB)和痢疾志贺氏菌(Shigelladysenteriae)等多种细菌的生长有抑制作用,MIC值为25 μg/mL.
2.2 抗氧化活性炭角菌发酵物的提取物中富含具有酚类母核结构的化学成分或多糖类组分,具有较好的抗氧化活性.Xylarianigripes菌丝体的热水提取物和70%乙醇提取物通过上调bcl2、下调bax和caspase3,抑制乳酸脱氢酶的释放,减轻DNA损伤,恢复线粒体膜电位,阻止异常凋亡,从而有效地保护PC12细胞免受H2O2诱导的氧化损伤.此外,两种提取物具有明显的DPPH·自由基清除作用(IC50值分别为(2.04 ± 0.06)和(1.13 ± 0.03) mg/mL)和脂质过氧化抑制作用(IC50值分别为(4.35 ± 0.09)和(1.08 ± 0.04) mg/mL)[40].薛凡尼氏炭角菌(Xylariaschweinitzii)菌丝体的水提物(2.5 mg/mL)对DPPH·自由基的清除率高达91.8%,可能与其具有较高的总酚和总黄酮含量有关[41].体外实验研究表明,Xylarianigripes发酵液中的多糖组分Xn-40有较强的抗氧化能力,其清除DPPH·自由基的IC50值为 1 300 mg/L,清除ABTS·+自由基的IC50值为699.16 mg/L.此外,体外活性实验表明,Xn-40能显著减少AAPH诱导的活性氧(ROS)的生成[42].
2.3 对酶的抑制活性文献报道从炭角菌发酵物中分离鉴定的萜类化合物对多种酶具有抑制活性.从Xylarianigripes中得到的萜类化合物nigriterpene C(48)能够剂量依赖性地抑制脂多糖(LPS)诱导的小鼠脑小胶质BV-2细胞中NO的产生,IC50值为(21.7 ± 4.9) μmol/L;Western blot结果表明,nigriterpene C(48)能够剂量依赖性地抑制一氧化氮合酶(iNOS)和环氧合酶-2(COX-2)的表达,IC50值分别为(8.1 ± 2.3)和(16.6 ± 5.5)μmol/L,推测化合物可能通过下调iNOS和COX-2的表达而达到抗神经炎症的功效[18].Xylariapolymorpha中发现的萜类化合物xylariaines A~C(53~55)和polymorphine B(57)在浓度均为50 mg/mL时,对乙酰胆碱酯酶(AchE)的抑制率分别在12.4%~18.0%之间[20].
2.4 抗肿瘤活性大量文献报道炭角菌的次生代谢产物如细胞松弛素类和甾体类化合物等,具有潜在的抗肿瘤活性.汪雯翰等[43]通过体外实验研究发现从牛肝菌Boletussp.中分离得到的一株炭角菌,其石油醚和氯仿的提取物均对人肺腺癌细胞SPCA-1具有明显的抑制活性,抑制率分别为60.08%和68.41%;体外实验结果表明,其抗肿瘤的药理作用机制可能是通过诱导细胞线粒体释放ROS,并上调促凋亡蛋白Caspase-3和Bax的表达、下调抗凋亡蛋白Bcl2的表达而实现的.此外,文献报道炭角菌的次生代谢产物对多种肿瘤细胞具有潜在的抗肿瘤活性.Chen等研究人员[9]从源自中国南海的Xylariasp. SOF11中发现了细胞松弛素类化合物cytochalasin P1(6):采用SRB(sulforhodamine B)法对其进行抗肿瘤活性评价,发现该化合物对MCF-7细胞和人神经癌细胞SF-268具有显著的抑制活性,IC50值分别为(0.71 ± 0.05)和(1.37 ± 0.06) μmol/L,优于阳性对照药物顺铂(IC50值分别为(5.87 ± 0.45)和(1.93 ± 0.16) μmol/L).Wang等学者[15]从Xylariacf.curta中发现的细胞松弛素类化合物xylarichalasin A(25)对人肝癌细胞SMMC-7721和人乳腺癌细胞MCF-7有明显的细胞毒活性(IC50值为6.2~8.8 μmol/L),对人早幼粒急性白血病细胞HL-60、人肺泡腺癌基底上皮细胞A549和人结肠癌细胞SW480有中等活性(IC50值为11.6~18.9 μmol/L).甾体类化合物(78)对MCF-7细胞增殖也具有显著的抑制作用:在浓度为40 μmol/L时,其对MCF-7细胞抑制率高达72%[27].
2.5 免疫调节活性炭角菌的次生代谢产物如萜类化合物和细胞松弛素类化合物等,具有一定的免疫调节活性.Wang等学者[11]对来自于Xylariacf.curta中的15个细胞松弛素类化合物(化合物7~9和11~22)进行免疫调节活性筛选,将雄性BALB/c小鼠中的脾细胞作为实验材料,筛选出对该细胞无毒性的化合物后,再通过CCK-8法对LPS诱导的B淋巴细胞和对ConA诱导的T细胞的增殖进行抑制活性筛选,发现curtachalasin F(12)对B细胞增殖有选择性抑制作用(IC50值为2.42 μmol/L),curtachalasin O(21)对T细胞增殖有选择性抑制作用(IC50值为12.15 μmol/L);根据细胞松弛素与活性的构效关系推测:这类化合物的7位氧取代的结构可能是抑制免疫活性的关键药效团.此外,Chen等人[17]从XylarialongipesHFG1018中分离得到的萜类化合物xylarilongipin A(44),对脂多糖诱导的B淋巴细胞和刀豆蛋白A(ConA)诱导的T淋巴细胞的增殖有一定的抑制作用(IC50值分别为22.4和13.6 μmol/L).
3 结语与展望
相较于同为炭角菌科的肉球菌属,如轮层炭壳属和炭垫属等真菌,炭角菌属真菌作为腐生、寄生或与植物共生的一类真菌,是研究最早、分布最广和种类最多的一类.目前,我国对炭角菌属真菌的研究主要以开发纵条纹炭角菌和黑柄炭角菌药用价值的相关研究居多.炭角菌次生代谢产物丰富多样,结构复杂,主要为细胞松弛素类、萜类、酮类、甾醇类和内酯类等化合物,这些化合物大都表现出多种药理活性,如抗菌、抗氧化、抗肿瘤、抑制酶活性及免疫调节作用等,为临床先导化合物的研发提供了极为丰富的天然药物资源.然而,对该属真菌活性成分的药理作用实验大都为对体外细胞的药效评价或采用生化试剂盒进行的药效评价;对化合物在体内的分子作用机制和在体内的吸收、分布、代谢和排泄等并未有系统的、深入的探究,如缺乏动物实验、毒理实验、生殖畸变、安全性评价及药物代谢动力学等系统研究.故此,为进一步开发该菌属真菌的药用价值,加快临床急需药物的研发进度,后续研究应在挖掘其丰富多样的次生代谢产物的基础上,加强对具有药物开发潜力的化合物的系统评价,推动对炭角菌属资源的充分开发和利用.

