曲妥珠单抗生物类似药对比原研药治疗HER-2阳性乳腺癌有效性和安全性的Meta分析Δ
邓为上,李梦婷,胡 佳,杨森森,陈吉生(广东药科大学附属第一医院临床药学重点专科,广州 510080)
2020 年,全球乳腺癌新发病例高达226 万例,超过了肺癌的220 万例,成为全球第一大癌[1]。乳腺癌的分子分型包括人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)阳性、HER-2阴性、三阴型、管腔A(Luminal A)型、Luminal B 型,不同类型乳腺癌的治疗方法和患者预后具有一定差异[2]。其中,HER-2 阳性患者占乳腺癌患者的20%~30%[3]。由于HER-2阳性乳腺癌的恶性程度较高,患者预后较差,常规放、化疗的特异性低,因此其诊治一直是相关研究的热点。曲妥珠单抗是一种由重组DNA衍生而成的人源化单克隆抗体靶向药物,能特异性地作用于HER-2,抑制依赖HER-2 的肿瘤细胞的增殖和存活,能极大地提高HER-2阳性患者的生存获益。然而,曲妥珠单抗在给患者带来治疗获益的同时,也带来了巨额的治疗支出,昂贵的价格限制了该药的使用。
随着原研药专利保护到期,曲妥珠单抗生物类似药(包括韩国的CT-P6、俄罗斯的BCD-022、新加坡的HD201 和我国的HLX02 等生物类似药)已获批上市[4]。生物类似药是指在质量、安全性和有效性方面与已获准注册的原研药具有相似性的治疗用生物制品,但由于生物类似药存在多种翻译后修饰形式,使其无法完全精确复制原研药的结构和功能[5]。基于此,本研究拟系统评价曲妥珠单抗生物类似药与其原研药的有效性和安全性,旨在为临床治疗提供循证证据(本研究已在国际前瞻性系统综述登记数据库中注册登记,注册号为CRD42021281383)。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 本研究纳入的文献类型为国内外公开发表的随机对照试验(randomized controlled trial,RCT);语种不限。
1.1.2 研究对象 纳入的患者均为HER-2阳性乳腺癌;种族、国籍、临床分期均不限;年龄≥18 岁;均符合中国临床肿瘤学会或美国国立综合癌症网络公布的乳腺癌诊断标准[6-7]。
1.1.3 干预措施 试验组患者给予曲妥珠单抗生物类似药;对照组患者给予曲妥珠单抗原研药。药物用法用量不限。
1.1.4 结局指标 结局指标包括——(1)客观缓解率(objective response rate,ORR);(2)病理完全缓解率(pathologic complete response,pCR);(3)生存人群比例:无进展生存(progression free survival,PFS)人群比例和总生存(overall survival,OS)人群比例;(4)免疫原性:抗药抗体(anti-drug antibody,ADA)阳性率、中和抗体(neutralizing antibody,Nab)阳性率;(5)不良反应发生率。
1.1.5 排除标准 排除标准包括:(1)重复发表的文献;(2)数据不完整的文献;(3)曲妥珠单抗生物类似药或原研药在治疗中发生临床互换的文献。
1.2 文献检索策略
计算机检索PubMed、Embase、Web of Science、Cochrane Library、中国期刊全文数据库、中国生物医学文献数据库、维普网和万方数据。中文检索词为“曲妥珠单抗生物类似药/国产曲妥珠单抗”“曲妥珠单抗原研药”“赫赛汀”“HER-2 阳性乳腺癌”“人表皮生长因子受体2 阳性乳腺癌”;英文检索词为“trastuzumab”“Herceptin”“biosimilar pharmaceuticals/biosimilars”“subsequent entry biologics”“HER-2 positive breast cancer”“human epidermal growth factor receptor 2-positive breast cancer”“HER2+breast cancer”。同时,手工检索Clinical-Trials.gov、中国临床试验中心等数据库和相关文献的参考文献以获得相关研究。采用主题词和自由词相结合的检索方式,检索时限均为2015年1月至2022年1月。
1.3 资料提取和质量评价
由2 位研究者按纳入与排除标准筛选文献,如遇分歧,则由第3位研究者裁决。提取信息包括第一作者、发表年份、临床试验注册号、干预措施、结局指标等。采用Cochrane 系统评价员手册5.1.0 推荐的偏倚风险评估工具对纳入文献质量进行评价,具体包括:随机方法、分配隐藏、试验盲法的实施、结果数据的完整性、其他偏倚来源。每个条目均分为“高偏倚风险”“低偏倚风险”“不清楚”[8]。
1.4 统计学方法
采用RevMan 5.4软件进行Meta分析。分类变量采用相对危险度(relative risk,RR)及其95%置信区间(confidence interval,CI)表示。采用Q检验评估研究间的异质性,当P<0.1 或I2>50%,表示各研究间有异质性,采用随机效应模型进行Meta分析;反之,则采用固定效应模型进行Meta分析。应用RevMan 5.4软件通过变换Meta分析效应模型来进行敏感性分析,若模型变换后得到的结果未发生翻转,表明Meta分析结果稳健。应用RevMan 5.4 软件对纳入研究数大于10 篇的指标进行发表偏倚分析。
2 结果
2.1 文献筛选流程与纳入研究基本信息
初检共获得相关文献436 篇。经阅读标题、摘要及全文后,最终纳入11 篇文献[9-19],共计5 812 例患者,其中试验组2 931例、对照组2 881例。文献筛选流程见图1,纳入研究基本信息见表1。
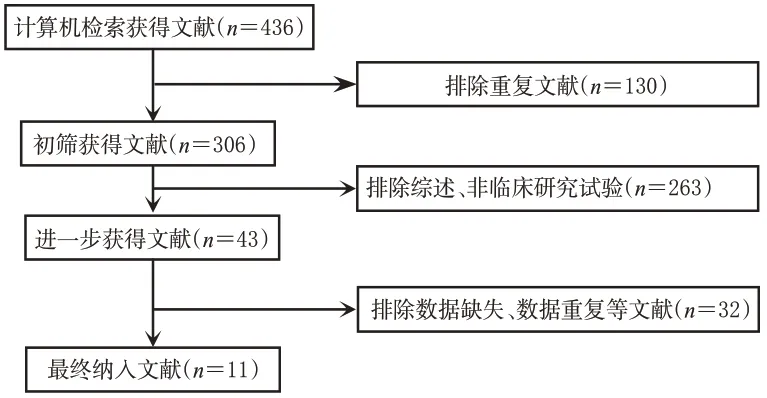
图1 文献筛选流程
2.2 纳入研究的质量评价结果
所有研究均为RCT[9-19],8项研究报道了具体的随机方法和分配隐藏方案[9-12,14-15,17-18],3 项研究仅提及随机[13,16,19];6 项研究采用了双盲方案[9-10,12,14,17-18],4 项研究未报道是否实施了盲法方案[11,13,16,19],1 项研究采用开放式标签[15]。结果见图2、图3。
2.3 Meta分析结果
2.3.1 ORR 9 项研究报道了ORR[11-19],包括8 项意向性治疗分配人群(intention-to-treat population,ITT)的ORR[11-12,14-19]和5 项按完成方案分配人群(per-protocol population,PP)的ORR[11-13,15,18]。Meta分析结果显示,两组ITT 的ORR[RR=1.02,95%CI(0.99,1.06),P=0.19]、PP 的ORR[RR=1.03,95%CI(0.99,1.06),P=0.14]比较,差异均无统计学意义。结果见图4(因ITT为按照设计方案纳入人群,包含了失访、脱落等患者,故ITT例数与表1 不一致;PP 为按照完成方案纳入人群,排除了失访、脱落等患者,故PP例数与表1不一致)。
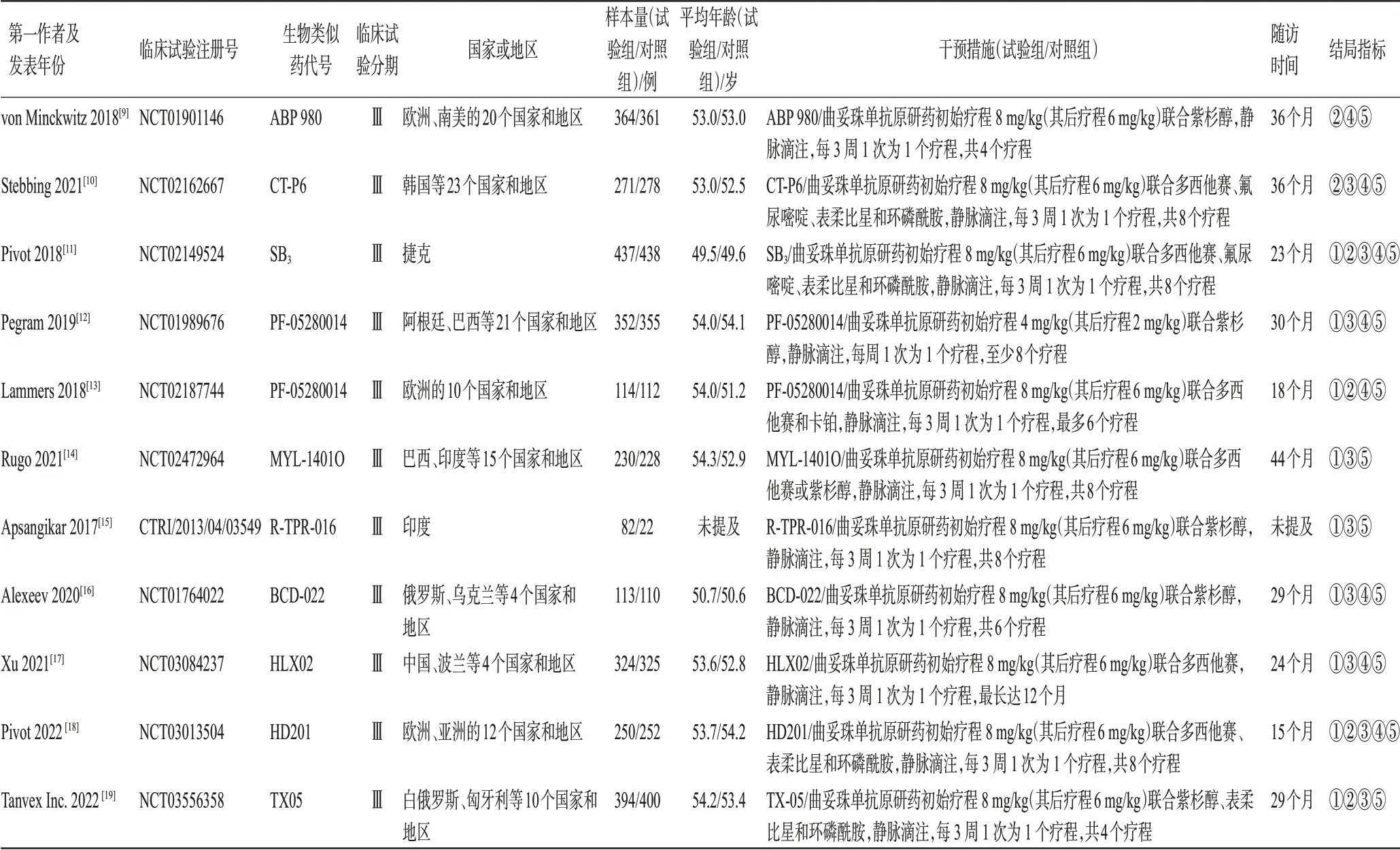
表1 纳入研究基本信息
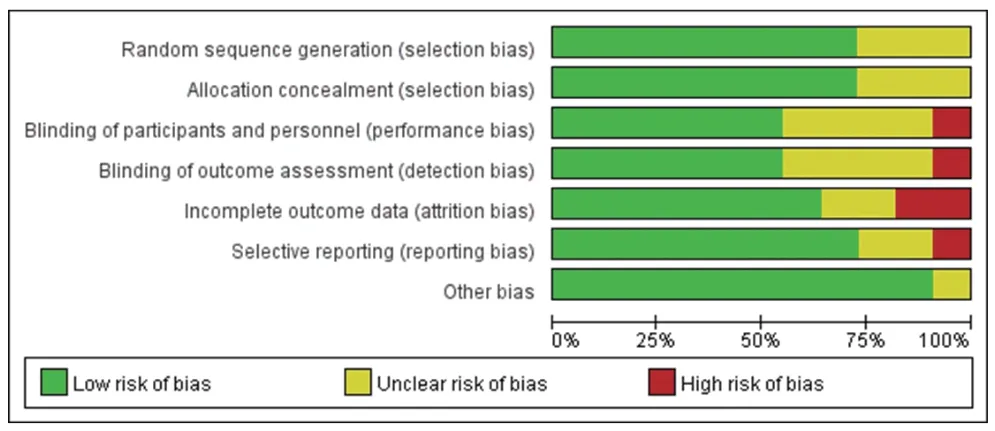
图2 偏倚风险条形图

图3 偏倚风险总图

图4 ORR的Meta分析森林图
2.3.2 pCR 6 项研究报道了pCR[9-11,13,18-19],各研究间有统计学异质性(P=0.07,I2=52%),采用随机效性模型进行Meta 分析,结果见图5。Meta 分析结果显示,两组患者的pCR[RR=1.06,95%CI(0.95,1.18),P=0.30]比较,差异无统计学意义(因部分研究均排除了失访患者,故例数与表1不同)。
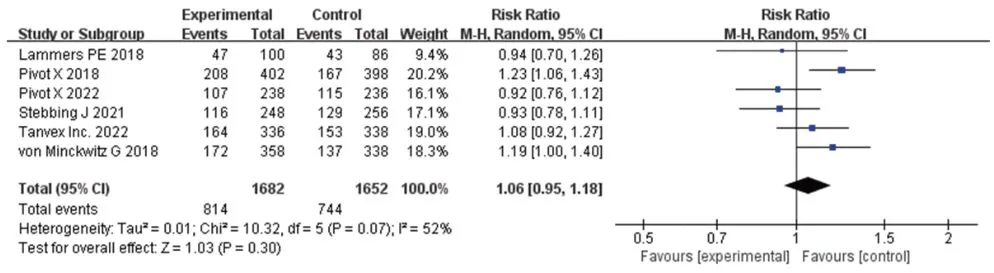
图5 pCR的Meta分析森林图
2.3.3 生存人群比例 7 项研究报道了PFS 人群比例[10-12,14-17],9项研究报道了OS人群比例[10-12,14-19]。两组的PFS 人群比例[RR=1.01,95%CI(0.96,1.05),P=0.77]、OS 人群比例[RR=1.01,95%CI(0.99,1.02),P=0.50]比较,差异均无统计学意义。结果见图6、图7(因部分研究排除了失访患者,故例数与表1不同)。

图6 PFS人群比例的Meta分析森林图
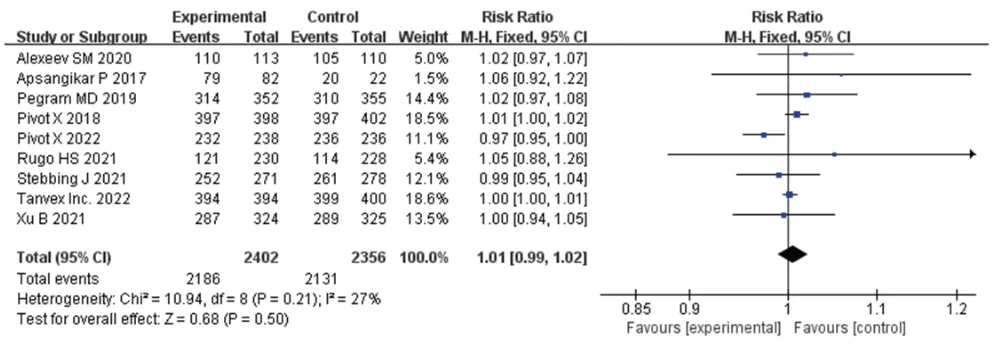
图7 OS人群比例的Meta分析森林图
2.3.4 免疫原性 7 项研究报道了ADA 阳性率[9-13,17-18],8 项 研 究 报 道 了Nab 阳 性 率[9-13,16-18]。Meta分析结果显示,两组患者的ADA 阳性率[RR=1.21,95%CI(0.61,2.38),P=0.59]、Nab 阳性率[RR=0.97,95%CI(0.39,2.44),P=0.95]比较,差异均无统计学意义。结果见图8、图9(因部分研究排除了失访患者,故例数与表1不同)。
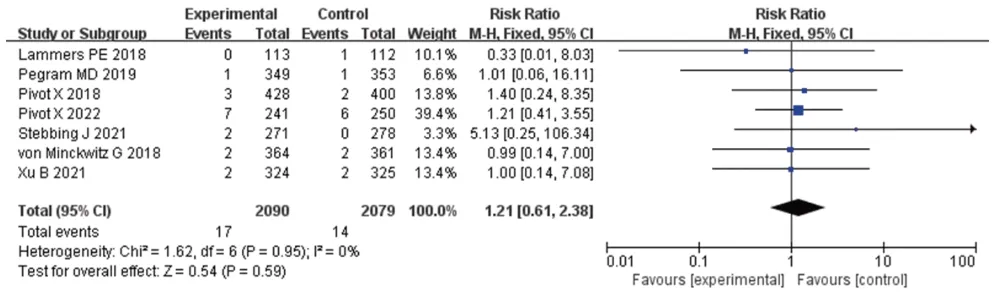
图8 ADA阳性率的Meta分析森林图
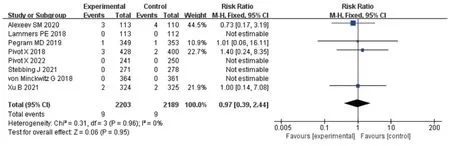
图9 Nab阳性率的Meta分析森林图
2.3.5 不良反应发生率 Meta分析结果显示,两组患者多种不良反应发生率比较,差异均无统计学意义(P>0.05)。结果见表2。
2.4 敏感性分析
经转换效应模型后,所有结局指标的Meta分析结果均未发生翻转,提示Meta分析结果稳健。
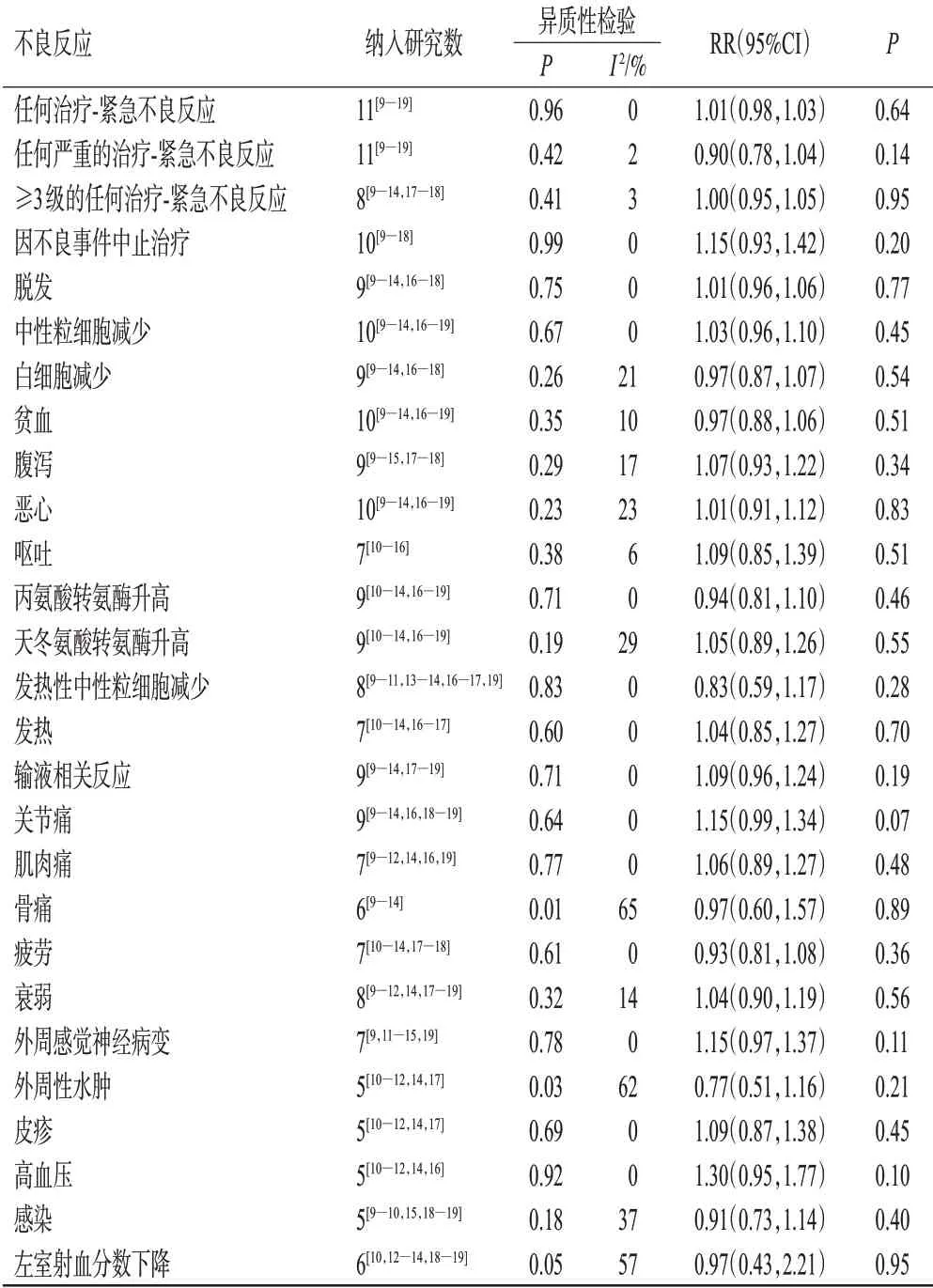
表2 不良反应发生率的Meta分析结果
2.5 发表偏倚分析
以任何治疗-紧急不良反应发生率和任何严重的治疗-紧急不良反应发生率为指标进行发表偏倚分析。结果显示,各研究散点均分布在倒漏斗图的两侧,基本位于95%CI 内,表明本研究存在发表偏倚的可能性较小,结果见图10(任何严重的治疗-紧急不良反应发生率发表偏倚所得结果类似,故图略)。

图10 任何治疗-紧急不良反应发生率的倒漏斗图
3 讨论
我国生物类似药的发展处于起步阶段,患者对生物类似药的了解尚浅,因此利用真实世界数据来比较生物类似药与原研药的疗效和安全性是十分必要的。ORR是抗肿瘤生物类似药比较研究的临床终点之一,其信息丰富且具有足够的敏感性;pCR作为乳腺癌新辅助化疗的评估指标,也是判断患者是否临床长期生存获益的预后因子之一[20]。本研究结果显示,在疗效方面,曲妥珠单抗生物类似药使用者的ORR、pCR与原研药使用者比较,差异均无统计学意义。在安全性方面,两组患者的免疫原性、不良反应发生率比较,差异均无统计学意义。
综上所述,曲妥珠单抗生物类似药与原研药的疗效和安全性均相当。本研究的局限性为:(1)部分研究仅将随机化方法描述为随机,无法确定其随机化方法是否适当,甚至有研究为开放标签,容易导致选择偏倚;(2)仅纳入RCT,其受试者往往经过严格的筛选,具有一定的限制,而在实际临床中患者具有明显的个体差异,故本研究所得结论还需更多严格设计、长期随访、更大规模的前瞻性双盲RCT或真实世界数据证实。

